BOLD-MRI评价含碘对比剂对糖尿病肾病兔肾脏氧含量的影响
2019-08-24王佳欢魏宝春
王佳欢,周 菲,魏宝春,林 红
(吉林市中心医院影像中心,吉林 吉林 132000)
随着糖尿病人群基数的增加[1]和含碘对比剂应用的普及,糖尿病患者接受碘对比剂检查的概率增高,注射碘对比剂导致急性肾损伤(post-contrast acute kidney injury, PC-AKI)也越来越引起关注[2]。2018年,对比剂安全委员会更新对比剂使用指南并规定PC-AKI是指静脉注射碘对比剂后2~3天,血清肌酐水平出现短暂性升高并超过基础值的1.5倍或绝对值增加26.5 μmol/L[2]。目前对PC-AKI尚无特殊治疗方法,合理使用对比剂和监测预防PC-AKI成为关键。含碘对比剂主要经肾脏代谢,使肾脏氧含量降低[3],而糖尿病肾病更加重了这一影响[4]。BOLD-MRI可通过R2*值反映肾脏氧含量的水平[5-6],R2*值越高,说明肾脏氧含量越低,反之,R2*值越低,说明肾脏的氧含量高。本研究建立糖尿病肾病兔模型,探讨不同浓度含碘对比剂对肾脏氧含量的影响及注射含碘对比剂后肾脏氧含量的变化规律。
1 材料与方法
1.1 实验动物和模型建立 选用健康成年雄性新西兰大白兔40只[吉林医药学院动物中心提供,许可证号SYXK(吉)2012-0004],体质量2.5~3.0 kg,平均(2.76±1.34)kg;其中8只作为对照组正常喂养,其余32只进行高脂高糖喂养。糖尿病肾病模型造模成功标准:喂养第12周时对实验兔进行血糖、肌酐、尿素氮及微量白蛋白的生化检查,指标升高为Ⅱ型糖尿病肾病模型造模成功[7]。
1.2 实验分组 将32只糖尿病肾病兔随机分为4组,每组8只,分别注射不同浓度(200、240、300、350 mgI/ml)含碘对比剂(通用制药上海有限公司提供),并命名为200亚组、240亚组、300亚组和350亚组。注射前将碘对比剂预热到37°C,采用22G静脉留置针经耳缘静脉手动注射,注射剂量为1 mgI/kg体质量[8]。对照组8只实验兔注射对应剂量的生理盐水。注射后1、24、48和72 h进行MR扫描。
1.3 仪器与方法 采用GE Signa HDxt 3.0T MR扫描仪,小动物线圈。扫描序列包括快速梯度回波T2W和BOLD序列。T2W参数:TR 512 ms,TE 88 ms,FOV 14 cm×14 cm,矩阵192×256,层厚3 mm,层间距1 mm,NEX 2。BOLD参数:采用多回波扰相梯度回波序列,TR 140 ms,TE 16 ms,翻转角30°,带宽31.25 kHz,矩阵160×160,FOV 18 cm×18 cm,层厚4 mm,层数6,NEX 4。
采用GE AW 4.5后处理工作站,以Functional软件自动生成BOLD图。于BOLD冠状位图像上,分别于每侧肾脏上部、中部和下部的肾皮质、外髓、内髓各放置6个ROI,双侧肾脏共测量36个ROI,尽量保持ROI大小及形态一致,避开肾窦脂肪及血管,测量其R2*值,计算肾皮质、外髓和内髓的平均R2*值。
1.4 病理检查 于MR扫描后每个时间点每组随机处死2只实验兔,测量肾脏质量,对肾脏进行HE染色,并采用HypoxyprobeTM-1染色法对实验兔肾脏进行缺氧组织标记。
1.5 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示。糖尿病肾病模型兔与对照组实验兔肾脏质量和生化指标比较采用t检验。对符合正态分布资料的多组间R2*值比较采用多因素方差分析及LSD进行两两组间比较。P<0.05为差异有统计学意义。
2 结果
32只实验兔均成功制备为糖尿病肾病模型,其肾脏质量及相关生化指标均高于对照组(P均<0.001,表1)。
2.1 R2*值改变 注射对比剂后1、24、48和72 h,各组肾皮质、外髓和内髓的R2*值的变化趋势为:注射含碘对比剂后1 h R2*值均升高,24 h升至最高,之后开始下降(图1、2)。多因素方差分析结果显示,对照组注射生理盐水后各时间点间肾皮质(P=0.878)、外髓(P=0.824)、内髓(P=0.752)的R2*值总体差异均无统计学意义。350亚组、300亚组、240亚组、200亚组肾皮质、外髓、内髓注射对比剂后不同时间点的R2*值总体差异均有统计学意义(P均<0.001),注射后24 h R2*值升至最高,与其他时间点两两比较差异均有统计学意义(P均<0.05),见表2~4。
表1 糖尿病肾病模型组与对照组兔肾脏质量和生化指标比较(±s)
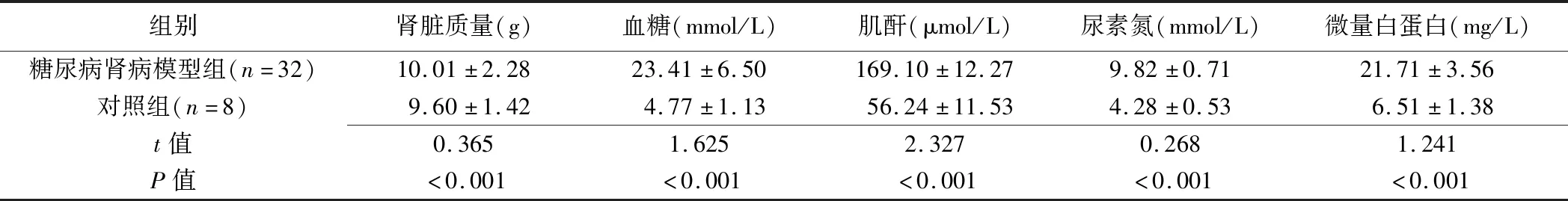
表1 糖尿病肾病模型组与对照组兔肾脏质量和生化指标比较(±s)
组别肾脏质量(g)血糖(mmol/L)肌酐(μmol/L)尿素氮(mmol/L)微量白蛋白(mg/L)糖尿病肾病模型组(n=32)10.01±2.2823.41±6.50169.10±12.279.82±0.7121.71±3.56对照组(n=8)9.60±1.424.77±1.1356.24±11.534.28±0.536.51±1.38t值0.3651.6252.3270.2681.241P值<0.001<0.001<0.001<0.001<0.001
表2 各组注射对比剂/生理盐水后肾皮质不同时间点R2*值比较(s-1,±s)
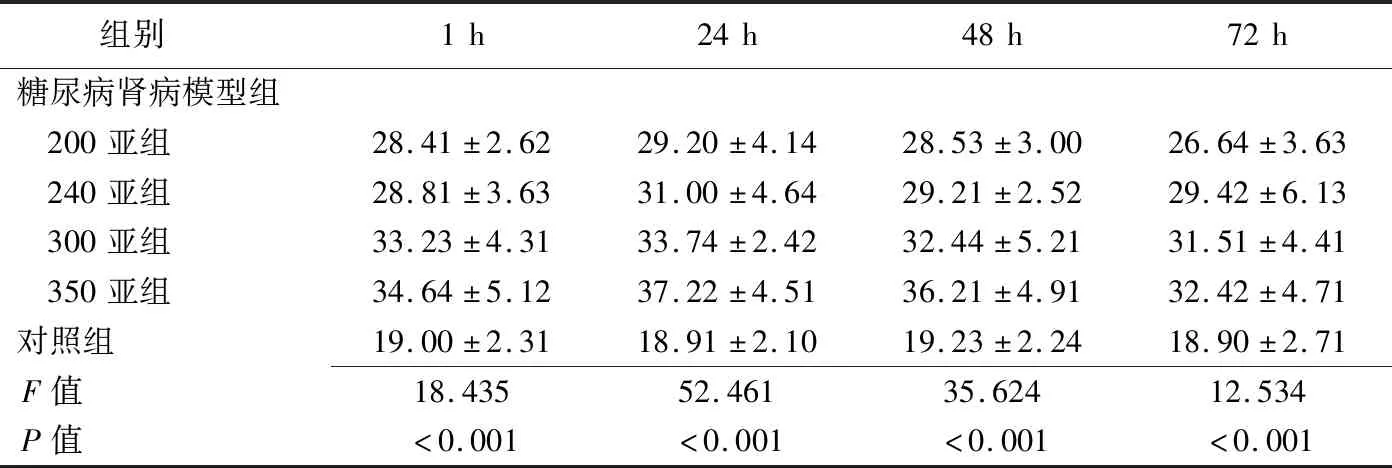
表2 各组注射对比剂/生理盐水后肾皮质不同时间点R2*值比较(s-1,±s)
组别1h24h48h72h糖尿病肾病模型组 200亚组28.41±2.6229.20±4.1428.53±3.0026.64±3.63 240亚组28.81±3.6331.00±4.6429.21±2.5229.42±6.13 300亚组33.23±4.3133.74±2.4232.44±5.2131.51±4.41 350亚组34.64±5.1237.22±4.5136.21±4.9132.42±4.71对照组19.00±2.3118.91±2.1019.23±2.2418.90±2.71F值18.43552.46135.62412.534P值<0.001<0.001<0.001<0.001
表3 各组注射对比剂/生理盐水后肾外髓不同时间点R2*值比较(s-1,±s)
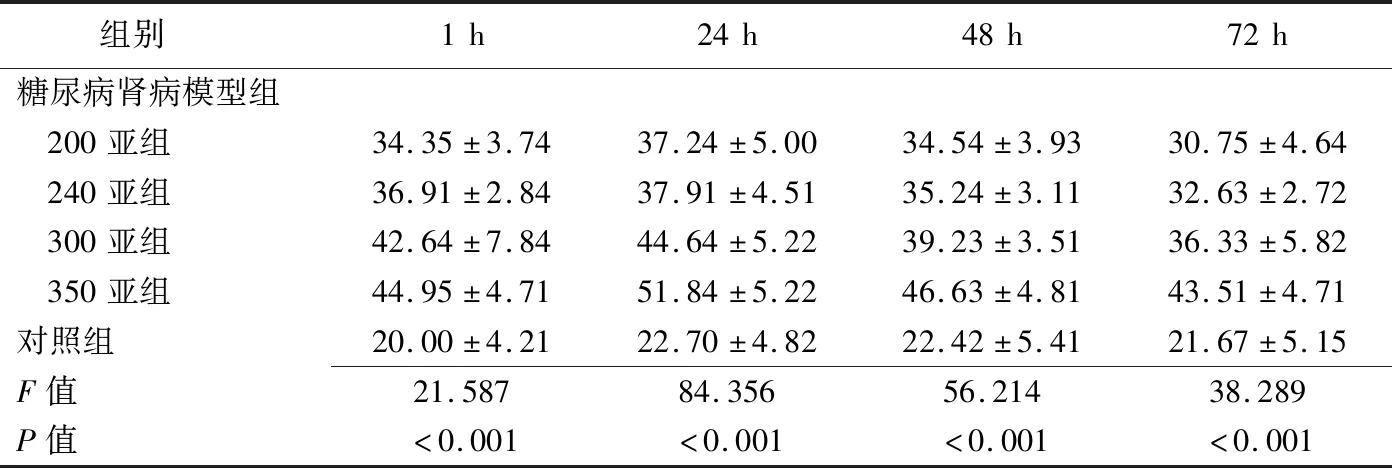
表3 各组注射对比剂/生理盐水后肾外髓不同时间点R2*值比较(s-1,±s)
组别1h24h48h72h糖尿病肾病模型组 200亚组34.35±3.7437.24±5.0034.54±3.9330.75±4.64 240亚组36.91±2.8437.91±4.5135.24±3.1132.63±2.72 300亚组42.64±7.8444.64±5.2239.23±3.5136.33±5.82 350亚组44.95±4.7151.84±5.2246.63±4.8143.51±4.71对照组20.00±4.2122.70±4.8222.42±5.4121.67±5.15F值21.58784.35656.21438.289P值<0.001<0.001<0.001<0.001
表4 各组注射对比剂/生理盐水后肾内髓不同时间点R2*值比较(s-1,±s)

表4 各组注射对比剂/生理盐水后肾内髓不同时间点R2*值比较(s-1,±s)
组别1h24h48h72h糖尿病肾病模型组 200亚组25.73±2.8229.84±3.7225.11±2.3123.62±3.13 240亚组27.51±3.0030.72±7.9329.24±4.9327.40±4.21 300亚组37.11±4.8238.74±6.9233.83±3.8328.14±5.32 350亚组38.20±5.6541.92±4.0039.53±4.6332.94±5.00对照组20.21±2.4220.00±3.6221.85±2.7420.52±3.22F值20.59874.24759.36535.247P值<0.001<0.001<0.001<0.001
注射对比剂后1、24、48和72 h,350亚组、300亚组、240亚组、200亚组与对照组间肾皮质、外髓、内髓的R2*值总体差异均有统计学意义(P均<0.001);两两比较,350亚组肾皮质、外髓、内髓的R2*值最高,差异有统计学意义(P均<0.05);见表2~4。注射后24 h,350亚组实验兔肾脏不同部位间比较,肾皮质、外髓和内髓间R2*值总体差异有统计学意义(F=12.512,P<0.001),外髓的R2*值最高,高于皮质和内髓,差异有统计学意义(P均<0.05)。
2.2 病理结果
2.2.1 HE染色 对照组实验兔注射生理盐水后的肾脏HE染色可见肾小球形态饱满,结构清晰,近曲小管上皮细胞未见肿胀。注射含碘对比剂后肾小球开始萎缩,近曲小管上皮细胞出现混浊,随着碘浓度的增加,表现更加显著。350亚组实验兔在注射含碘对比剂后1 h肾小球略肿胀,近曲小管上皮细胞略混浊、肿胀,间质内毛细血管充血;24 h肾小球出现混浊,近曲小管上皮细胞肿胀,伴空泡变性,间质内毛细血管充血;48 h肾小球呈萎缩改变,近曲小管上皮细胞肿胀,伴空泡变性;72 h肾小球明显萎缩,近曲小管上皮细胞空泡变性,间质内毛细血管充血;见图3。
2.2.2 免疫组织化学染色 对照组实验兔注射生理盐水后应用HypoxyprobeTM-1染色,肾皮质与髓质之间染色无明显差异。注射碘对比剂后应用HypoxyprobeTM-1染色,注射后1 h,肾髓质染色略有加深;24 h肾髓质染色明显加深;48 h肾皮质与髓质染色仍有差异;72 h肾髓质染色减轻;见图4。
3 讨论
在糖尿病肾病阶段,由于肾脏高代谢导致的Na+-K+-ATP酶活性增加和肾小管的负担过重,特别是在位于外髓的近曲小管和髓袢升支粗段,耗氧量明显增加[9],提示外髓受到的影响更明显[10-11]。本研究结果显示,350亚组实验兔中,在注射对比剂后各个时间点,外髓的R2*值升高最明显,高于内髓和皮质,提示含碘对比剂对肾脏外髓的氧含量影响最严重,且碘浓度越高,这一作用越明显。肾内氧代谢取决于氧供应和氧消耗的平衡状态[12],当含碘对比剂进入肾小血管,对比剂使血液变得黏稠,导致红细胞聚集能力增强,血液流动速度减慢,氧气输送能力降低,使供氧量明显减少,造成局部组织缺氧;同时对比剂进入肾血管后,肾脏的血流动力学亦发生改变,肾血管短暂性的扩张,血流量暂时性增加,之后可出现持续性的血管收缩,使肾灌注进一步减少,从而导致肾组织氧含量更加降低[13]。

图2 注射生理盐水或不同浓度含碘对比剂后肾皮质(A)、外髓(B)和内髓(C)R2*值折线图 变化趋势为注射含碘对比剂后1 h R2*值均升高,24 h升至最高,之后开始下降

图3 对照组和350亚组实验兔肾脏病理图(HE,×400) A.对照组; B~E.分别为350亚组注射对比剂后1、24、48和72 h

图4 对照组和350亚组实验兔肾脏HypoxyprobeTM-1免疫组织化学图(×200) A.对照组; B~E.分别为350亚组注射对比剂后1、24、48和72 h
BOLD-MRI可无创性评价肾脏氧含量水平[14],目前多采用R2*值间接评价组织氧含量的变化[15]。本研究中,注射不同浓度对比剂后,各组实验兔肾皮质、外髓、内髓的R2*值在各个时间点均升高,提示肾脏氧含量下降,注射后24 h达到峰值,之后开始降低,反映了肾脏损害于注射后24 h最明显,之后逐渐恢复的过程。注射不同浓度对比剂后,各组实验兔间肾皮质、外髓、内髓的R2*值均有差异,且350亚组最高,提示含碘对比剂对肾脏氧含量的影响随对比剂浓度增加而增强。本研究所采用的HypoxyprobeTM-1和其相关抗体是检测正常组织和肿瘤组织缺氧的重要标识。通过HypoxyprobeTM-1染色可以标记注射含碘对比剂后肾脏皮、髓质氧含量的不同[16]。本研究中,注射对比剂后24 h,350亚组实验兔的肾脏皮、髓质缺氧标记差别最明显,提示24 h时实验兔肾脏髓质氧含量最低,与本研究对R2*值的测量结果相符。
本研究的局限性:只选取4个时间点进行研究,未来应增加更多的时间点,以观察肾脏氧含量恢复至正常水平的总体趋势;样本量较小,有待增加样本量进一步深入研究。
总之,本研究通过动物实验发现碘对比剂可以降低肾脏氧含量,引起肾小球损害,以外髓最为明显,且随对比剂浓度增加,肾损伤加重,注射对比剂后24 h此损伤达峰值,之后逐渐恢复。BOLD-MRI可反映注射含碘对比剂后肾脏氧含量变化,有助于评估肾脏病理及功能损害,有望为临床合理应用对比剂和监测肾功能提供辅助信息。
