靶向肿瘤相关巨噬细胞的肿瘤治疗研究进展
2019-08-12杨永广刘文涛
夏 莹 张 岩 杨永广 刘文涛
(吉林大学第一医院转化医学研究院,器官再造与移植教育部重点实验室,人类疾病动物模型国家地方联合工程实验室,长春130021)
肿瘤相关巨噬细胞(Tumor-associated macrop-hage,TAM)是肿瘤局部免疫抑制微环境的重要组成成分,如何逆转其免疫抑制作用是全面调动免疫系统本身来对抗、减缓甚至是治愈肿瘤的关键。在肿瘤患者中,巨噬细胞根据不同的极化状态发挥促进和抑制肿瘤两方面作用,抑制TAM的促进肿瘤进展和转移功能、减少肿瘤中TAM的数量或促使其向抗肿瘤方向极化已成为靶向TAM疗法的重要方向。
1 TAM的来源和作用
巨噬细胞是实体肿瘤中浸润的主要淋巴细胞之一,有时肿瘤组织中巨噬细胞的比例大于50%[1]。肿瘤组织中的巨噬细胞是一个异质性的群体,组织驻留的巨噬细胞主要来源于胚胎的卵黄囊,周围组织中的巨噬细胞通过肿瘤局部趋化因子的趋化作用进入肿瘤组织,血液中的单核细胞也可以通过趋化因子受体2(C-C chemokine receptor type 2,CCR2)依赖的趋化作用进入肿瘤组织并成熟为巨噬细胞,在小鼠的研究表明肿瘤组织浸润的巨噬细胞主要是Ly-6C+[2,3]。
在天然状态下,巨噬细胞具有肿瘤编辑作用,可以通过产生的一氧化氮(Nitric oxide,NO)对肿瘤细胞产生杀伤作用,抑制肿瘤的生长。按照表型和功能不同巨噬细胞可分为M1型和M2型,M1型能够杀伤、抑制细胞生长和分泌炎性细胞因子,有利于刺激天然T细胞产生Th1型反应;M2型有利于刺激天然T细胞产生Th2型反应,能够分泌血管内皮生长因子(Vascular endothelial growth factor,VEGF)、表皮生长因子(Epidermal growth factor,EGF)、转录生长因子-β(Transforming growth factor-β,TGF-β)等细胞因子,促进修复和抑制免疫反应[4]。TAM实际上包含依赖于肿瘤微环境中细胞因子平衡而形成的多种巨噬细胞亚群,由于肿瘤微环境中存在的前列腺素E2(Prostaglandin E2,PGE2)和TGF-β以及肿瘤组织中不存在TOLL受体(Toll-like receptor,TLR)的活化、大部分肿瘤不存在特异性抗原等因素很难有M1型巨噬细胞的活化,因此TAM主要表现为M2型巨噬细胞表型,对肿瘤的发生、发展及转移具有促进作用[5]。这些TAM与发挥正常功能的巨噬细胞不同,他们可以通过一系列可溶性抑制因子及膜表面抑制因子抑制效应T细胞及自然杀伤细胞(Natural killer cell,NK)的抗肿瘤活性。TAM除了导致免疫抑制外,还可以通过一系列其他机制促进肿瘤生长及转移,如诱导肿瘤向间质组织的侵袭、向血管中泄露、促进血管生成等。
2 靶向TAM的治疗
TAM是肿瘤免疫抑制微环境的重要组成成分之一,并且巨噬细胞具有高度的可塑性,而且研究显示TAM同时具有M1型和M2型巨噬细胞的极化标志,具有向M1型巨噬细胞再极化的潜力[6,7]。动物模型和临床试验显示针对TAM的治疗,包括清除TAM、TAM的再极化以及提高TAM的抗原递呈功能等手段,不仅具有单独的抗肿瘤作用,而且还和免疫检查点等免疫治疗手段具有良好的协同作用。
2.1 减少或清除TAM
集落刺激因子-1(Colony stimulating factor-1,CSF-1):CSF-1是一种支持单核细胞和巨噬细胞群分化、增殖和功能的细胞因子,对小鼠的研究及对人的临床试验均显示,单独应用CSF-1/CSF-1R阻断剂已被证实不足以清除肿瘤,在阻断CSF-1/CSF-1R的同时应用化学疗法或检查点阻断剂可以提升其抗肿瘤效率。在胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)的小鼠模型中抑制CSF1R的信号传导可以增强巨噬细胞的抗原呈递功能、增强抗肿瘤的T细胞反应,但是这些肿瘤反应性T细胞中程序性死亡受体1(Programmed cell death protein 1,PD-1)等免疫检查点分子的表达增加,减弱了CSF1R抑制剂的抗肿瘤作用,联合应用免疫检查点抗体可以增强其抗肿瘤作用[8]。人体黑色素瘤细胞系在体外暴露于黑素瘤特异性CD8 T细胞产生的细胞因子后始终产生CSF1,与健康受试者相比患有转移性黑素瘤患者的血液中CSF1增加,CD8 T细胞与人黑色素瘤中的CSF1或各种TAM特异性标记物共富集,导致这部分患者对检查点阻断的无应答,抗PD-1和抗CSF1R抗体的组合诱导小鼠黑素瘤消退[9]。CSF1R抑制剂和CXCR2抑制剂的组合能够有效减少肿瘤微环境中TAM和多核型髓源抑制性细胞(Polymorphonuclear myeloid-derived suppre-ssor cells,PMN-MDSC)的数量并延迟肿瘤生长,但在两种不同的小鼠肿瘤模型中这两种单一药物对肿瘤生长没有任何影响[10]。
趋化因子2(Chemokine ligand,CCL2):肿瘤细胞通过释放CCL2从外周血募集表达CCR2的单核细胞到肿瘤部位并成熟为巨噬细胞。对膀胱癌的研究发现,肿瘤细胞表达的淋巴结转移相关转录物1(Lymph node metastasis associated transcript 1,LNMAT1)可以将异质核核糖核蛋白(heterogeneous nuclear ribonucleoprotein L,hnRNPL)募集到CCL2启动子而激活CCL2表达,CCL2上调将巨噬细胞募集到肿瘤中,并通过VEGF-C促进淋巴转移[11]。前列腺癌、乳腺癌、肝癌和黑色素瘤动物模型研究表明抑制CCL2能够减少肿瘤负荷与肿瘤转移[12]。
氯磷酸盐(Clodronate):肿瘤细胞糖酵解和缺氧是抗肿瘤治疗失败的主要因素,TAM清除剂和免疫检查点抗体联用可以增强免疫检查点抗体的抗肿瘤效率。Jeong等[13]在非小细胞肺癌的研究中表明,TAM可以分泌TNFα促进肿瘤细胞的糖酵解,而TAM中增加的AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)和过氧化物酶体增殖激活受体γ共激活因子1-α(Peroxisome proliferator-activat-ed receptor gamma coactivator 1-alpha,PPARGC1α)会导致肿瘤缺氧。应用氯磷酸盐清除TAM能够消除肿瘤的有氧糖酵解和使缺氧、使需氧的肿瘤细胞表达PD-L1显著增加、肿瘤中T细胞浸润增加,从而使原本对PD-L1抗体不反应的非小细胞肺癌患者产生了明显的抗肿瘤反应。
2.2 阻断TAM上抑制性受体信号促进TAM的吞噬作用和抗原递呈功能
CD47:肿瘤细胞高表达CD47,通过信号调节蛋白α (Signal regulatory protein alpha,SIRPα)-CD47信号限制巨噬细胞吞噬肿瘤细胞的能力,是一个主要的吞噬屏障。TTI-621(SIRPαFc)可以与CD47结合进而提升巨噬细胞的吞噬作用,在急性髓细胞白血病(Acute myelocytic leukemia,AML)原发患者的异种移植模型中TTI-621处理组骨髓和脾脏中的肿瘤负荷显著减少[14]。多形性胶质母细胞瘤(Glioblastoma multiforme,GBM)是一种致命的高度侵袭性恶性脑肿瘤,目前已发现TAM和小胶质细胞是肿瘤微环境中促进肿瘤的主要细胞,阻断SIRPα-CD47信号能够诱导TAM和小胶质细胞对肿瘤细胞的吞噬作用,此方法对包括GBM在内的各种脑肿瘤有效[15]。
由于红细胞及造血细胞上广泛表达CD47,因此应用抗体直接广泛阻断CD47-SIRPα信号会带来明显的副作用,而针对巨噬细胞或肿瘤部位定向阻断CD47-SIRPα信号能够减少副作用。SIRPα外泌体能够有效地向肿瘤部位聚集,体外和体内实验中极少量的外泌体SIRPα蛋白可以有效地引发巨噬细胞消灭肿瘤细胞的吞噬反应,促进肿瘤中的T细胞浸润[16]。肿瘤切除术后使用装载CD47抗体碳酸钙纳米颗粒的纤维蛋白凝胶并清除手术伤口中的H+,凝胶释放的CD47抗体能够阻断癌细胞的“不要吃我”信号,使TAM重新极化为M1表型、增加TAM的吞噬作用、“唤醒”宿主先天和适应性免疫系统,从而抑制术后局部肿瘤复发和潜在的转移性扩散[17]。
白细胞免疫球蛋白样受体B(Leukocyte immunoglobulin-like receptor subfamily B,LILRB)LILRB家族是髓系细胞表达的一类抑制性受体,其配体是MHCⅠ类分子。癌细胞表达的MHCⅠ类成分β2-微球蛋白可以直接保护其不被吞噬,这种保护作用是LILRB1介导的,LILRB1在巨噬细胞、尤其是TAM表面表达上调。阻断MHCⅠ类分子或LILRB1均可以增强阻断CD47分子后巨噬细胞的吞噬作用[18]。LILRB2拮抗剂抑制该受体介导的酪氨酸磷酸酶1/2激活并增强促炎反应。在M-CSF和IL-4存在的情况下,LILRB2拮抗作用也抑制AKT和STAT6活化,转录组分析显示LILRB2的拮抗作用改变了细胞骨架重塑、脂质/胆固醇代谢基因。阻断LILRB2可以有效抑制髓系来源的抑制性细胞(Myeloid-derived suppressor cells,MDSC)和Treg的浸润,并显著促进T细胞免疫检查点抑制剂的体内抗肿瘤作用。此外,LILRB2可通过重新编程肿瘤相关髓样细胞将来自非小细胞肺癌肿瘤组织内浸润的髓系细胞极化为炎性表型[19]。
2.3 促进TAM向抗肿瘤方向的再极化
CD40:CD40是一类高度保守的共刺激受体,主要表达在抗原提呈细胞上,如树突状细胞(Dendritic cell,DC)、巨噬细胞、B细胞、单核细胞和一部分肿瘤细胞,其配体CD40L主要表达在活化的T、B细胞上。许多研究表明,CD40激动剂的抗肿瘤效率可以通过与其他免疫调节疗法如TLR激动剂、细胞因子(包括Ⅰ 型 干扰素和白介素2)、过继性细胞转移和化疗的组合来增强[20]。在CT26和MC38肿瘤小鼠模型中发现结合CSF-1R阻断剂与CD40激动剂也可以显著提高抗肿瘤能力及生存率,应用该结合疗法后肿瘤微环境中Ly-6CloF4/80+TAM明显减少,而剩余的巨噬细胞表型从MHCⅡ10变为MHCⅡhi的促炎型巨噬细胞表型,共刺激分子CD80、CD86表达增加,该结合疗法证实了移除抑制性细胞群的同时激活免疫细胞表面活化信号的重要性[21]。
TLR:TLR是TAM表达的重要病原体识别受体,TLR3刺激后M1型标志物MHCⅡ和共刺激分子如CD86、CD80和CD40的上调。相反,M2型标志物CD206、T细胞免疫球蛋白和黏蛋白结构域3(T cell immunoglobulin domain and mucin domain-3,TIM-3)的表达降低。在小鼠肿瘤中使用TLR3L可以使M2型巨噬细胞变为M1型并使肿瘤生长退化[22]。TLR4对肿瘤的抑制性免疫反应具有重要作用,而TLR5放大该反应。在TLR5阴性的肠癌细胞系中,无毒力的鞭毛蛋白B-secreting鼠伤寒沙门氏菌释放多种TLR5配体,TLR5介导宿主的免疫抑制反应。敲除TLR4和MyD88后,TLR5介导的免疫抑制反应完全消失,鼠沙门氏菌刺激肿瘤微环境中的巨噬细胞向M1型极化,而M2型减少[23]。Ubil等[24]研究发现肿瘤分泌的Pros1抑制M1型巨噬细胞的极化,携带Pros1敲除肿瘤的小鼠表现出固有和适应性免疫反应增加、生存期明显延长。该研究表明Pros1/TAM的相互作用可能是肿瘤介导免疫抑制的一种新策略,抑制Pros1和TLR7、8有利于促进TAM向M1方向的极化,有利于抗肿瘤反应。
组蛋白去乙酰化酶(Histone deacetylase,HDAC):哺乳动物中有18种HDAC,分为4大类(Ⅰ、Ⅱ、Ⅲ类和Ⅳ类);Ⅱ类HDAC细分为ⅡA类(HDAC4、HDAC5、HDAC7和HDAC9)和ⅡB类(HDAC6和HDAC10)。Guerriero等[25]研究发现ⅡA HDAC抑制剂可以作为刺激巨噬细胞抗肿瘤能力的重要手段,在小鼠乳腺癌模型中HDAC抑制剂TMP195可以介导肿瘤内高度吞噬性和刺激性巨噬细胞的募集和分化,TMP195与抗PD-1抗体结合使用显示出显著的协同效应。另一项研究表明,一种同时抑制HDAC和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)的他汀类异羟肟酸酯能够减少肿瘤组织中的促炎细胞因子、趋化因子、环氧合酶Ⅱ(CyclooxygenaseⅡ,COX-Ⅱ)和细胞周期蛋白D1的表达,以及减少肿瘤周围区域中巨噬细胞和中性粒细胞的浸润,对小鼠模型中结肠炎和结肠炎相关结肠直肠癌具有预防作用[26]。
微小RNA(micro RNA,miRNA):miRNA是一大类小的非编码RNA,通过序列特异性方式负调节RNA的转录,其成熟受到miRNA加工酶双链RNA特异性内切核酸核糖酶(Double-stranded RNA-specific endoribonuclease,DICER)的调控。去除巨噬细胞中的DICER可以促进M1型TAM的编程、IFN-γ/STAT1信号通路的活化,从而减弱TAM的免疫抑制能力,并促进细胞毒性T淋巴细胞(Cytotoxic lymphocyte,CTL)募集到肿瘤,CTL产生的IFN-γ进一步加剧DICER缺失M1型巨噬细胞的极化并抑制肿瘤生长。此模型中PD-1检查点阻断剂和CD40激动剂联用能够实现肿瘤的完全根除[27]。
胞内磷脂酰肌醇3-激酶γ(Phosphoinositide 3-kinase γ,PI3Kγ):髓样细胞的PI3Kγ通过促进肿瘤中整联蛋白α4依赖性MDSC募集、刺激MDSC和TAM的免疫抑制极化促进肿瘤免疫抑制,PI3Kγ还通过激活mTOR、S6激酶α和CCAAT增强子结合蛋白β(CCAAT/enhancer binding protein-β,C/EBPβ)依赖性转录途径促进TAM极化,导致免疫抑制因子如精氨酸酶、IL-10和TGF-β的表达增加,促进肿瘤免疫抑制。阻断骨髓细胞中PI3Kγ-整合素α4通路可以通过调节肿瘤微环境和促进T细胞杀伤肿瘤细胞来恢复抗肿瘤免疫[28]。TAM表达的PI3Kγ在PDAC进展中起核心作用,PI3Kγ可以在体内和体外诱导巨噬细胞的M2型极化,在携带PDAC的小鼠中阻断PI3Kγ可以重编程TAM以刺激CD8 T细胞介导的肿瘤抑制并抑制肿瘤细胞侵袭、转移和结缔组织形成[29]。
E盒结合锌指蛋白1(Zinc-finger-enhancer binding protein 1,ZEB1):ZEB1在癌细胞中促进上皮-间质转化(Epithelial-mesenchymal transition,EMT)以促进肿瘤进展,TAM中的ZEB1是人卵巢癌中存活率较差的一个因素,TAM的肿瘤促进和化疗耐药功能需要ZEB1,表达完全水平ZEB1的TAM才能加速肿瘤生长,TAM中ZEB1的表达诱导TAM向F4/80lo表型极化、激活CCR2,诱导癌细胞表达CCL2、CD74和间充质/干样表型,其中CCL2和CD74与较差的预后相关。靶向ZEB1甚至是部分下调TAM中ZEB1的表达也足以废除TAM的促肿瘤作用[30]。
3 结语
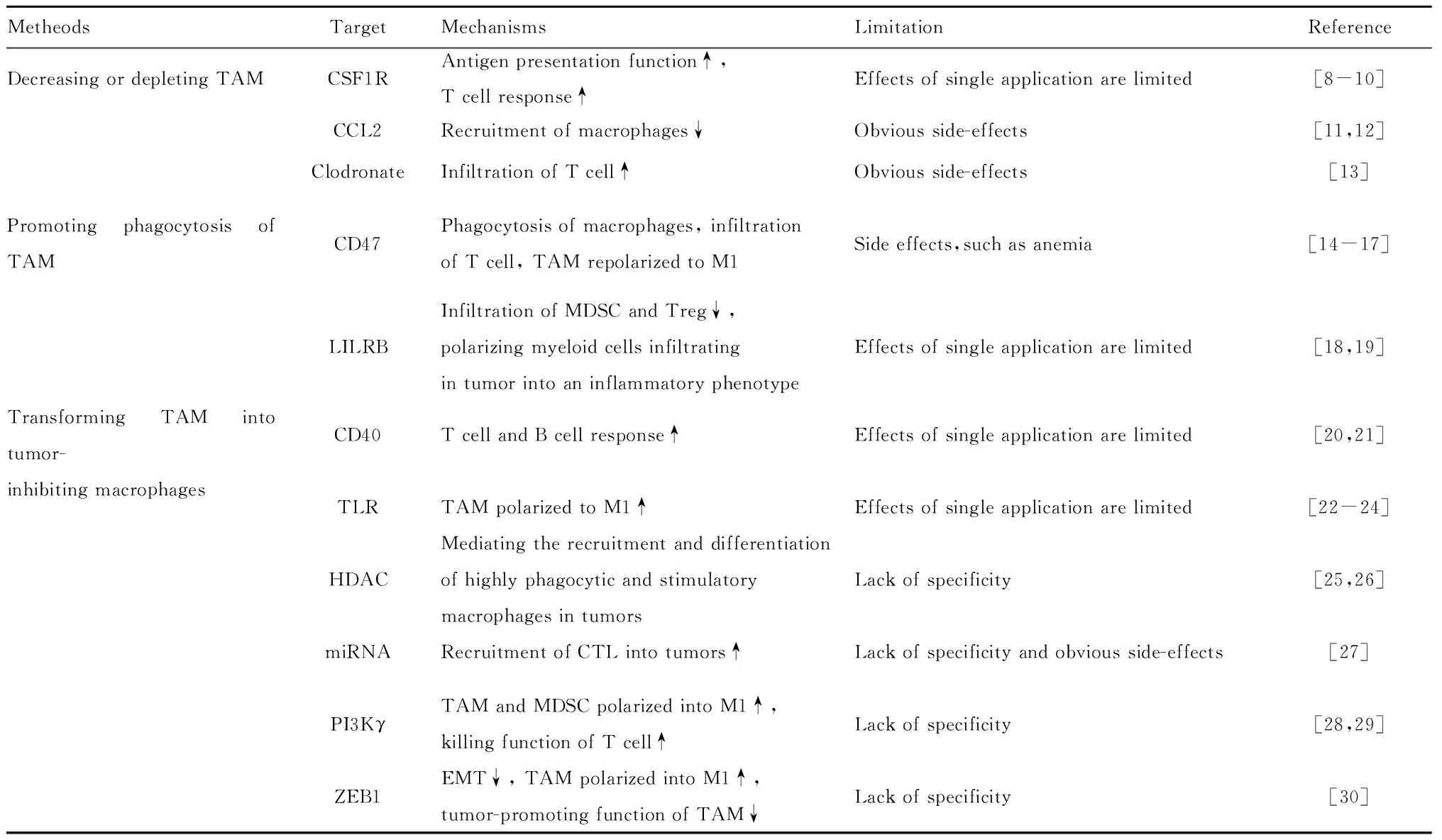
TAM是肿瘤微环境的重要组成成分,是一个具有高度可塑性的异质性群体,根据其活化状态不同具有抗肿瘤或促肿瘤作用,且能够影响适应性免疫反应的状态,无疑是极具吸引力的肿瘤免疫治疗靶标。针对TAM的肿瘤免疫治疗策略包括清除TAM和TAM的再极化目前已取得一定进展,但是还有相当多的问题仍有待进一步解决(表1)。例如:清除TAM对肿瘤治疗虽然有一定的效果,然而CSF1R抗体等对TAM的清除作用不具特异性且长期应用具有明显的毒性效应[31];并且PD-1和细胞毒T淋巴细胞相关抗原4(Cytotoxic lymphocyte antigen 4,CTLA4)抗体等免疫检查点阻断剂发挥作用需要DC或巨噬细胞的抗原递呈作用,因此促进TAM的抗原递呈功能以及向抗肿瘤方向的再极化策略似乎更具吸引力,但这仍然需要更具特异性的靶标以提高治疗效果和减轻副作用;此外,TAM仅是复杂肿瘤微环境中一个重要的组成成分,其与其他免疫抑制因素(如肿瘤相关成纤维细胞)的关系仍然不十分清楚。因此,靶向TAM的治疗仍然需要更具突破性的探索。
表1 靶向TAM的治疗方法和机制
Tab.1 Therapeutic methods and mechanisms of targeting TAM
MetheodsTargetMechanismsLimitationReferenceDecreasing or depleting TAMCSF1RAntigen presentation function↑, T cell response↑Effects of single application are limited[8-10]CCL2Recruitment of macrophages↓Obvious side-effects[11,12]ClodronateInfiltration of T cell↑Obvious side-effects[13]Promoting phagocytosis of TAMCD47Phagocytosis of macrophages, infiltrationof T cell, TAM repolarized to M1Side effects,such as anemia[14-17]LILRBInfiltration of MDSC and Treg↓,polarizing myeloid cells infiltratingin tumor into an inflammatory phenotypeEffects of single application are limited[18,19]Transforming TAM into tumor-inhibiting macrophagesCD40T cell and B cell response↑Effects of single application are limited[20,21]TLRTAM polarized to M1↑Effects of single application are limited[22-24]HDACMediating the recruitment and differentiationof highly phagocytic and stimulatorymacrophages in tumorsLack of specificity[25,26]miRNARecruitment of CTL into tumors↑Lack of specificity and obvious side-effects[27]PI3KγTAM and MDSC polarized into M1↑, killing function of T cell↑Lack of specificity[28,29]ZEB1EMT↓, TAM polarized into M1↑,tumor-promoting function of TAM↓Lack of specificity[30]
