细胞自噬调控颅内动脉瘤血管平滑肌细胞表型转化的体外研究①
2019-08-14袁广胜吴海东陈胜利李小梅王纪斌
袁广胜 吴海东 陈胜利 李小梅 邵 楠 王纪斌 张 婷
(东营胜利医院,东营257055)
血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)与其他类型的细胞如血管内膜的内皮细胞、心肌细胞和骨骼肌细胞等相比较,保留高度的可塑性[1]。在正常状态下,VSMCs具有收缩和舒张血管、维持血压平衡、调节血管张力和血流量等功能。当细胞周围环境发生改变时,VSMCs发生可逆转的表型转化,由生理状态下的收缩表型(分化表型)转变为合成表型(去分化表型),由此获得增殖、迁移及合成分泌大量细胞外基质和促炎因子的能力[2]。VSMCs表型转化是细胞自我修复的机制,同时也成为新生内膜形成和管腔狭窄的重要病理基础。最新文献报道显示VSMCs和VSMCs表型转化在颅内动脉瘤(intracranial aneurysms,IAs)的形成、进展和破裂中发挥重要作用[1,3,4]。IAs的形成是血流动力学因素以及一系列复杂的生物学反应所引起的脑血管瘤样突起,人群平均患病率1%~5%,高风险人群为19%[5]。IAs破裂是引起自发性蛛网膜下腔出血的首位原因,致残率和致死率高达 25%~50%,严重威胁人类生命和健康[6]。目前,IAs临床治疗主要包括手术治疗和血管介入治疗,尚未发现有效的药物。因此,深入阐述IA的分子生物学机制对于提供有效的药物靶点至关重要。本研究以体外培养的VSMCs为研究对象,揭示流体切应力对VSMCs表型转化的影响及相关的分子机制。
1 材料与方法
1.1 材料 DMEM低糖培养基、无血清培养基Opti-MEM、胎牛血清及胰蛋白酶(美国Gibco公司产品),实时荧光定量PCR试剂盒(TaKaRa公司),兔抗大鼠LC3、Beclin-1多克隆抗体(Sigma 公司),兔抗大鼠β-actin 单克隆抗体(艾比玛特生物医药有限公司),兔抗大鼠α-SMA、SM-22a、SM-MHC多克隆抗体,兔抗大鼠MMP-2和TNF-α多克隆抗体(美国 Santa 公司),免疫组织化学试剂盒SABC、DAB显色试剂盒及BCA蛋白浓度测定试剂盒均购自武汉博士德生物技术有限公司,Lipofectamine 2000(美国Invitrogen公司)。
1.2 方法
1.2.1 VSMCs培养及鉴定 大鼠脑VSMCs购自A.T.C.C.(Manassas,VA,U.S.A.)。VSMCs用含10%胎牛血清的DMEM完全培养基培养,置于37℃、5%CO2的细胞培养箱中,用0.25%胰蛋白酶消化传代,实验用第3~5代细胞。应用倒置相差显微镜观察细胞形态和α-SMA的免疫细胞化学染色对VSMCs进行鉴定。
1.2.2 流体切应力冲击VSMCs 将传至3~5代的VSMCs接种到载玻片上,待细胞融合达到60%~70%后转移到流室的测试区,密封后进行流体剪切实验。提供的流室内剪切力为15.28 dyne/cm2,细胞经15.28 dyne/cm2流体剪切力分别处理6、12、24 h。蠕动泵为实验系统提供稳定的定常流,用无血清DMEM 培养基作为灌流液体。对照组VSMCs静止培养,不经剪切力处理。SS+3-MA组与SS+Rapa组分别于流体剪切力冲击VSMCs前6 h给予3-MA或 Rapa预处理。
1.2.3 Real-time PCR 分别收集各组各时间点细胞,按照总RNA抽提取试剂盒说明书提取mRNA,反转录及定量PCR反应均按试剂说明书操作。引物序列如下:α-SMA引物序列:上游5′-AGTCGCCATCAGGAACCTCGAG-3′,下游5′-ATCTTTTCGATGTCGTCCCAGTTG-3′;SM-22a引物序列:上游5′-GCATAAGAGGGAGTTCACAGACA-3′,下游5′-GCCTTCCCTTTCTAACTGATGATC-3′;MMP-2引物序列:上游5′-CCAGCCAGTCCGATTTGA-3′,下游5′-CTGATAACCTGGATGCAGTCGT-3′;TNF-α引物序列:上游5′-AAAGCATGATCCGAGATGT-3′,下游5′-AGCAGGAATGAGAAGAGGC-3′;内参GAPDH引物序列:上游5′-CCCATCTATGAGGGTTACGC-3′,下游5′-TTTAATCTCACGCACGATTTC-3′。 反应条件:94℃预变性3 min,94℃扩增变性30 s,60℃退火30 s,72℃延伸30 s,35个循环,使用2-ΔΔCt法计算 mRNA 表达量。
1.2.4 免疫细胞化学染色 将接种于置有灭菌盖玻片的24孔板,每孔约1×105个,细胞融合至50%~70%时用甲醛固定,加入3%双氧水浸泡,5% BSA封闭液30 min,甩干后滴加兔抗大鼠的α-SMA 和LC-3多克隆抗体(稀释度均为1∶100),4℃孵育过夜。次日用PBS漂洗3次,5 min/次,滴加羊抗兔的辣根过氧化物酶标记的IgG,37℃孵育30 min,SABC液孵育40 min,DAB显色3~5 min。终止反应后苏木精复染、脱水、透明、中性树胶封片,镜下观察。
1.2.5 Western blot法 收集各组细胞,按常规方法提取蛋白质,以12 000 r/min离心15 min后留取上清。BCA法测定上清液蛋白浓度,蛋白变性后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,以干转法将分离蛋白转移至硝酸纤维素膜上,电转时间为50 min。5% 脱脂奶粉室温封闭1 h,滴加兔抗大鼠多克隆抗体(稀释度1∶500),4℃孵育过夜。次日以TBST洗膜5次,5 min/次,滴加羊抗兔的二抗(稀释度1∶5 000),室温孵育2 h,以TBST洗膜5次,5 min/次,ECL显色液进行曝光。Image J医学图像分析系统进行半定量分析,以β-actin作为内参计算蛋白相对表达水平。
2 结果
2.1 VSMCs的鉴定结果 倒置相差显微镜下观察细胞形态可见贴壁细胞以梭形为主,也呈现不规则形或星形,有多个细胞突起,胞浆丰富,细胞核卵圆形位于中央,某些区域重叠生长,表现为典型的“谷峰状”生长(图1A)。免疫细胞化学染色:制作细胞爬片,待细胞融和达到 50%~70% 时,使用特异性抗体α-SMA 鉴定VSMCs,光镜下可见胞浆呈现深棕黄色,证实细胞α-SMA相关抗原表达呈现阳性(图1B),鉴定细胞为VSMCs。
2.2 流体切应力诱导VSMCs的表型转化 与对照组比较,SS组VSMCs的收缩表型标志基因α-SMA(P6 h=0.026 2,P12 h=0.014 1,P24 h=0.004 0),SM-22a(P6 h=0.031 8,P12 h=0.016 5,P24 h=0.008 2)mRNA水平明显下调,而合成表型标志基因MMP-2(P6 h=0.010 4,P12 h=0.004 9,P24 h=0.000 3)和TNF-α(P6 h=0.022 1,P12 h=0.007 4,P24 h=0.000 8)的mRNA水平明显上调,从6 h到24 h下调/上调基因的改变均呈现显著的时间依赖性。这些结果表明流体切应力可促进VSMCs由收缩表型向合成表型的转化(图2)。
2.3 流体切应力促进VSMCs的自噬激活 据报道自噬在血管重塑中扮演重要角色,参与多种血管疾病的病理过程。为了明确流体切应力是否可激活VSMCs自噬,我们采用免疫细胞化学检测自噬相关蛋白LC3的蛋白定位情况,结果显示:流体切应力暴露后24 h,VSMCs胞浆呈现深棕褐色,免疫反应强阳性,揭示流体切应力可激活VSMCs自噬(图3)。为进一步验证这一结论,采用免疫印迹的方法检测不同时间点VSMCs中LC3和Beclin-1的蛋白表达情况。结果显示:SS组与正常组相比VSMCs中LC3和Beclin-1的蛋白表达明显升高(P<0.05,图4)。
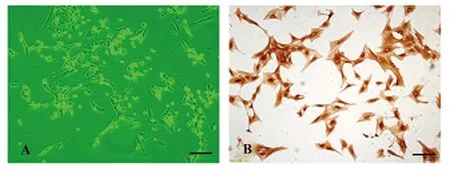
图1 VSMCs的鉴定结果Fig.1 Identification results of VSMCsNote: Morphological feature of VSMCs under inverted phase contrast microscope(A) and the locational expression of α-SMA in VSMCs(B),Bar=20 μm.
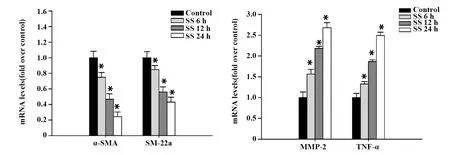
图2 VSMCs收缩表型与合成表型标志基因的表达Fig.2 Expressions of VSMCs contractile and synthetic marker genesNote: Real-time PCR results showed that SS could induced phenotypic modulation of VSMCs.*.P<0.05 vs control group.
2.4 自噬可调控SS诱导的VSMCs的表型转化 如上的结果已经证实流体切应力可诱导VSMCs自噬的激活,但激活的自噬在VSMCs表型转化中的调控作用尚不明确。本研究在流体切应力冲击前6 h 用自噬激动剂(Rapa)或抑制剂(3-MA)预孵育细胞,探讨自噬水平的高低对VSMCs表型转化的影响。与SS组相比,自噬激动剂组VSMCs中α-SMA 和SM-22a蛋白表达显著升高,而MMP-2和TNF-α的表达明显降低(P<0.05),表明自噬水平上调能够促进流体切应力诱导的VSMCs表型转化。与之相反,自噬水平下调可以显著抑制流体切应力诱导的α-SMA和SM-22a的下调,以及MMP-2和TNF-α表达的上调(P<0.05),揭示自噬水平下调可以抑制流体切应力诱导的VSMCs表型转化。总之,这些结果表明流体切应力通过激活自噬调控VSMCs的表型转化(图5)。
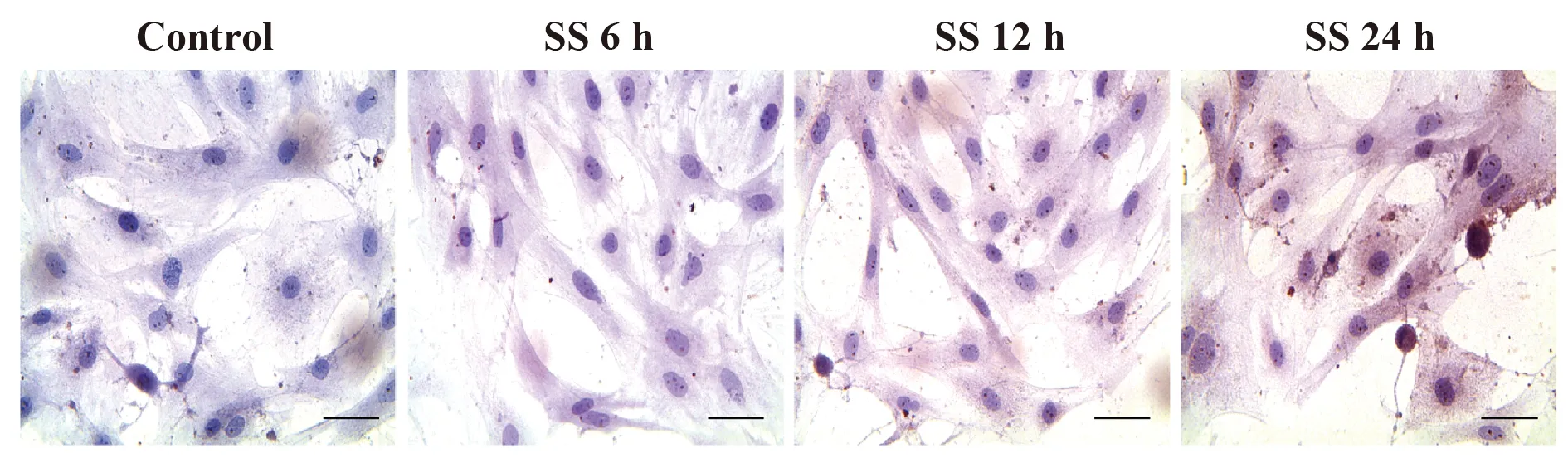
图3 自噬标记分子在VSMCs中的蛋白定量表达Fig.3 Location of autophagy marker protein LC3 inVSMCsNote: Immunocytochemical staining indicated that SS could effectively induced the expression of LC3 in the cells,Bar=20 μm.
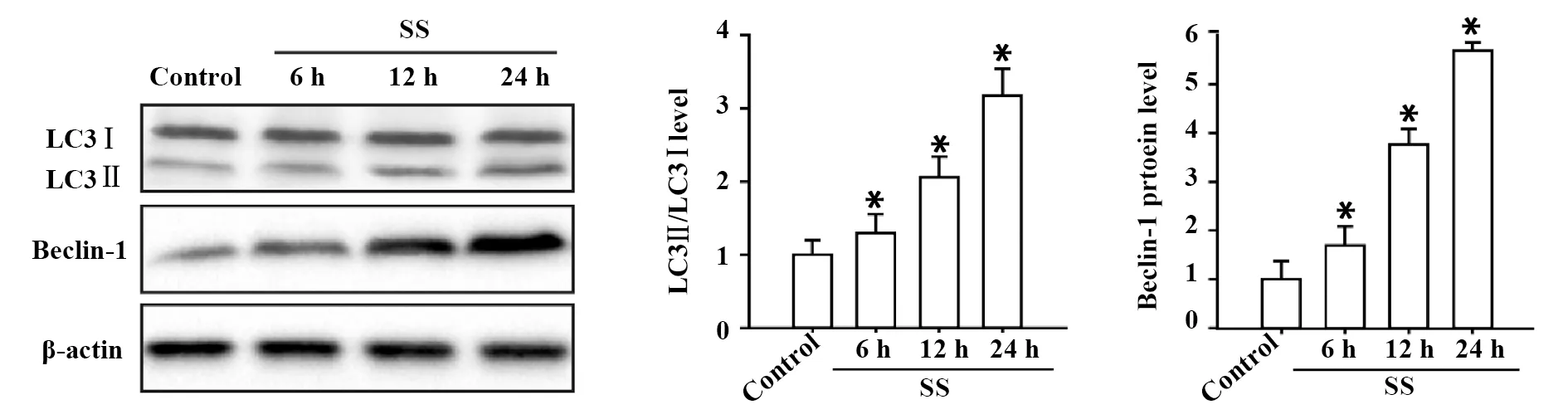
图4 VSMCs中LC3和Beclin-1的蛋白表达变化Fig.4 Expression of autophagy protein LC3 and Beclin-1 in VSMCsNote: Representative photographs and Histograms of Western blot.*.P<0.05 vs control group.
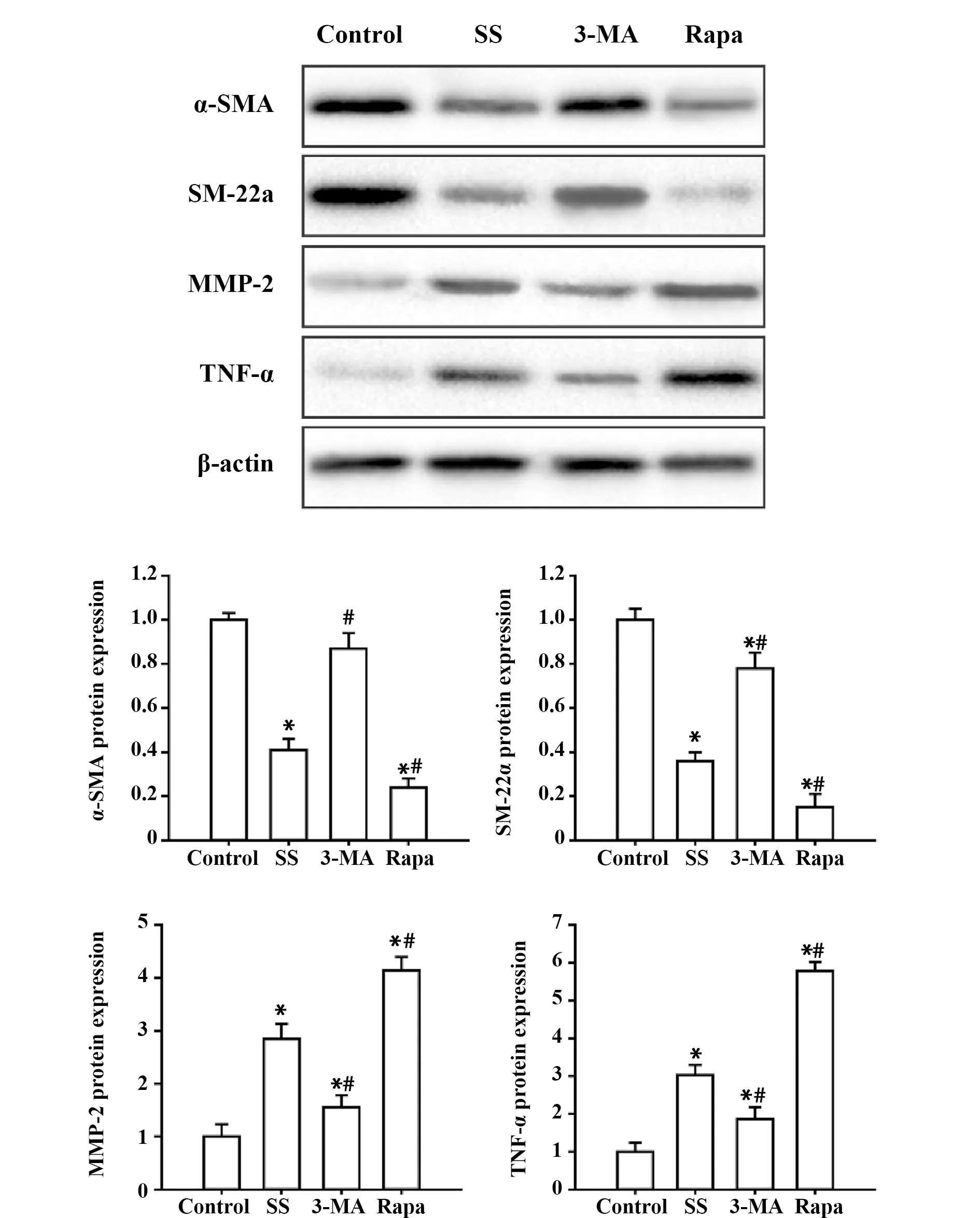
图5 Rapa 和 3-MA 预处理对 α-SMA、SM-22a、MMP-2和TNF-α蛋白表达的影响Fig.5 Effects of Rapa or 3-MA on α-SMA,SM-22a,MMP-2 and TNF-α expressionsNote: Representative photographs and Histograms of Western blot.*.P<0.05 vs control group; #.P<0.05 vs SS group.
3 讨论
VSMCs不是终末分化细胞,其可以调节自身表型以适应周围环境因素的改变。文献已报道VSMCs由分化状态(收缩表型)向去分化状态(合成表型)的转化在多种增生性心血管疾病中扮演重要角色,包括动脉粥样硬化、高血压、血管成形术后再狭窄等[7]。近年来越来越多的研究表明VSMCs表型转化也参与了IAs的形成、发展及破裂[3,4]。在IAs形成早期,VSMCs迁移到内膜中,增殖并合成大量细胞外基质成分。Nakajima等[8]应用免疫组织化学的方法在IAs的瘤壁中清晰显示VSMCs的表型转化,即瘤壁VSMCs的收缩表型标志蛋白表达减少,合成表型蛋白表达增多,然而在破裂动脉瘤中两种表型均消失。VSMCs由收缩表型到合成表型的转化,其增殖和合成新细胞外基质,最终可增强不断退化的IAs瘤壁的抗拉强度。因此,调控VSMCs表型转化在IAs瘤壁的退化和最终破裂中至关重要。本研究采用流体切应力诱导体外培养大鼠VSMCs表型转化模型,模拟IAs发生发展中VSMCs的病理改变,揭示VSMCs表型转化的上游分子调控机制,为IAs的早期诊断及药物治疗提供新的靶点。
血流切应力是引发IAs发生及其发展的首要因素。近年来研究发现Willis环大动脉局部的高切应力参与了颅内动脉瘤的发病机制[9]。并且流体切应力可以调节VSMCs的增殖、迁移、分化及内皮细胞的功能[10]。因此本研究第一部分以大鼠动脉VSMCs为研究对象,观察不同时间流体切应力冲击VSMCs能否诱导体外培养VSMCs的表型转化。Real-time PCR和免疫印迹结果显示流体切应力作为一种应激刺激因素,可降低VSMCs的收缩表型(分化表型)标志基因的表达水平,然而可上调合成表型(去分化表型)标志基因的表达量。这些结果表明流体切应力可诱导大鼠的VSMCs发生表型转化,并且具有一定的时间依赖性。然而,流体切应力对大鼠VSMCs表型的调控是否与自噬相关,有待进一步探讨。
自噬是细胞在自噬相关基因(Autophagy related gene,ATG)的调控下利用溶酶体降解自身受损的细胞器和大分子的过程,在维持细胞内稳态中扮演重要角色[11]。先前的研究报道显示诱发血管疾病的刺激物和应激源可以激活自噬过程,进而导致VSMCs表型和功能发生改变[12]。其次多数生长因子被证实为VSMCs表型转化的重要调控因子,其部分通过调节自噬活性实现[13]。本研究在VSMCs暴露切应力刺激后的不同时间点检测自噬相关蛋白LC3和Beclin-1的表达,其各时间点LC3和Beclin-1表达的上调证实流体切应力可激活VSMCs自噬。尽管多数研究已证明VSMCs自噬在再狭窄、动脉粥样硬化和高血压血管壁中被激活,但是自噬在血管健康和疾病中作用尚不明确。本研究发现流体切应力冲击可增强体外培养大鼠VSMCs的自噬水平,进一步应用自噬抑制剂3-MA与Rapa探讨自噬在流体切应力诱导的VSMCs表型转化中的作用。结果显示自噬抑制剂可以部分逆转VSMCs的表型转化,与之相反,自噬激动剂可以进一步促进切应力刺激下VSMCs表型转化。据报道血小板源性生长因子(Platelet-derived growth factor-BB,PDGF-BB)可快速诱导VSMCs由收缩表型向合成表型转化,值得注意的是PDGF-BB可增强VSMCs自噬水平,激活自噬可清除收缩蛋白与被脂质亲电试剂损伤的蛋白[14,15]。依据本实验结果及相关文献我们推断流体切应力可通过激活自噬诱导大鼠VSMCs的表型转化。
综上所述,本研究通过系列实验证实流体切应力可诱导体外培养大鼠VSMCs表型转化,深入探讨其相关分子调控机制发现流体切应力通过激活自噬调控VSMCs表型转化。本研究深化了对IAs形成、发展及破裂机制的理解,为IAs的早期诊断及药物治疗提供可能的分子靶点。目前对流体切应力激活自噬过程中所涉及的分子信号通路尚不清楚,这将是本课题组下一步的研究目标。
