红景天苷对缺氧复氧星形胶质细胞细胞损伤的影响
2019-08-14许德超方丽丽王颖怡
许德超 方丽丽 陈 辉 王颖怡
(齐齐哈尔医学院附属第二医院神经内五科,齐齐哈尔161006)
在脑组织中星形胶质细胞的数量远高于神经元,是哺乳动物体内数量最多的脑细胞,对脑组织正常功能的维持具有重要作用[1]。脑缺血再灌注损伤是常见的脑组织损伤,星形胶质细胞与脑组织的毛细血管紧密相连,脑缺血再灌注损伤发生时,星形胶质细胞损伤是早期事件。损伤的星形胶质细胞不仅能够直接影响脑组织的正常功能,还可以通过促进炎症反应杀伤周围正常的神经元细胞,减轻缺氧复氧星形胶质细胞损伤是治疗脑缺血再灌注的关键[2]。红景天苷(Salidroside)是一种红景天科植物中提取出的有效活性成分,具有抗氧化、消炎等功效,对于肾组织损伤、心肌损伤等均具有保护作用[3,4]。最近有研究显示,红景天苷对于脑缺血再灌注损伤大鼠具有保护作用,其能够降低损伤脑组织中氧化应激水平,减轻脑组织炎症反应,对于大鼠神经功能也具有改善作用[5,6]。本实验分离培养大鼠星形胶质细胞,通过探讨红景天苷对缺氧复氧星形胶质细胞氧化损伤、炎症因子分泌等过程的影响,明确红景天苷对体外缺氧复氧星形胶质细胞的作用,为红景天苷应用于脑缺血再灌注的临床治疗提供基础。
1 材料与方法
1.1 材料 出生1~2 d的SD大鼠由齐齐哈尔医学院提供,雌雄不限。红景天苷购自上海哈灵生物科技有限公司;乳酸脱氢酶(Lactate dehydrogenase,LDH)含量检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)活性检测试剂盒购自美国Sigma;还原型谷胱甘肽(Glutathione,GSH)活性检测试剂盒及丙二醛(Malonaldehyde,MDA)含量检测试剂盒购自南京建成生物研究所;活化型Caspase-3(Cleaved Caspase-3)抗体购自美国AbSci;CCK8细胞活力检测试剂盒购自南京恩晶生物科技有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(Interleukin-1β,IL-1β)、IL-6含量检测试剂盒购自美国Thermo;活化型Caspase-9(Cleaved Caspase-9)抗体购自美国Cell Signaling Technology;线粒体膜电位检测试剂盒购自南京森贝伽生物科技有限公司。
1.2 方法
1.2.1 星形胶质细胞分离培养 参照文献[7]步骤,取出生1~2 d的SD大鼠,分离脑组织,加入DMEM洗涤3次,将血管和脑膜组织剔除以后,取大脑皮质,剪碎,在组织中加入0.25%胰蛋白酶,37℃孵育8 min,150目筛网过滤,加入D-Hanks液洗涤,1 200 g离心5 min。添加含有青链霉素的DMEM/F12培养液(含有10%胎牛血清),混合后,接种到多聚赖氨酸包被后的6孔细胞培养板中,细胞接种密度为5×105个/ml,放在饱和湿度、5%CO2培养箱中孵育2 d,换液,继续培养。细胞长满以后,在37℃、220 r/min条件下振荡孵育18 h,将小胶质细胞和神经元去除,用0.25%的胰蛋白酶将贴壁的细胞消化,将细胞接种到多聚赖氨酸包被的培养皿中,培养7 d,经GFAP免疫荧光鉴定为星形胶质细胞。
1.2.2 缺氧复氧模型构建及细胞分组 缺氧复氧模型构建参照文献[2],取星形胶质细胞,用PBS将细胞洗涤3次,换成无血清的低糖培养液,置于1%O2、5%CO2、94%N2培养箱内继续培养6 h,将低糖培养液吸除,加入含有10%胎牛血清的DMEM/F12培养液,放在5%CO2培养箱内培养18 h。星形胶质细胞在缺氧复氧前4 h向细胞培养液中加入红景天苷,使其终浓度为80、160、320 mmol/L,分别记为Salidroside-L、Salidroside-M、Salidroside-H。设置H/R组,H/R组在缺氧复氧前4 h,用0 mmol/L红景天苷细胞培养液预处理。设置Control组,Control组用0 mmol/L红景天苷细胞培养液预处理,不进行缺氧复氧处理。
1.2.3 CCK8检测 将星形胶质细胞接种到96孔板内,按照Control、H/R、Salidroside-L、Salidroside-M、Salidroside-H分组处理,在每个孔内加入10 μl的CCK8溶液,放在培养箱内继续培养4 h,把没有添加细胞的孔作为空白调零孔,检测紫外-可见分光度计450 nm处每孔的吸光度值(A值),计算细胞存活率变化。存活率=100%×(实验组A值/Control组A值)。
1.2.4 LDH漏出率检测 各组细胞按照上述方法处理以后,收集Control、H/R、Salidroside-L组、Salidrosi-de-M、Salidroside-H组细胞和培养液上清,用LDH含量检测试剂盒(二硝基苯肼法)检测上清和细胞中LDH含量,计算LDH漏出率。LDH漏出率=100%×上清中LDH含量/(上清中LDH含量+细胞中LDH含量)。
1.2.5 细胞SOD活性、GSH活性及MDA含量检测 各组细胞按照上述方法处理以后,收集Control、H/R、Salidroside-L、Salidroside-M、Salidroside-H组细胞,在细胞中添加0.1 mol/L TBA、0.05 mmol/L EDTA溶液,混合后,加入1%Triton-X100 50 μl,置于振荡器上反应1 min,加入100 μl的HPO3溶液将蛋白沉淀,4℃、12 000 r/min离心10 min,使用SOD活性检测试剂盒(黄嘌呤氧化法)、GSH活性检测试剂盒(改良二硫双硝基苯甲酸定量法)、MDA含量检测试剂盒(硫代巴比妥酸法)分别检测SOD活性、GSH活性及MDA含量。
1.2.6 细胞培养上清液中TNF-α、IL-1β、IL-6水平检测 各组细胞按照上述方法处理以后,收集Control、H/R、Salidroside-L、Salidroside-M、Salidroside-H组细胞培养上清液,用ELISA法分别检测TNF-α、IL-1β、IL-6含量,步骤按照试剂盒标准流程操作。
1.2.7 细胞凋亡检测 各组细胞按照上述方法处理以后,收集Control、H/R、Salidroside-L、Salidroside-M、Salidroside-H组细胞,用PBS洗涤,收集5×105个细胞,在细胞中添加500 μl的Binding Buffer,再加入Annexin V-FITC 5 μl和PI 5 μl,放在室温中避光反应10 min,经400目的尼龙网过滤,流式细胞仪检测细胞凋亡变化。
1.2.8 细胞线粒体膜电位检测 收集Control、H/R、Salidroside-L、Salidroside-M、Salidroside-H组细胞,加入0.25%的胰蛋白酶消化,收集细胞,PBS洗涤3次,在细胞中加入罗丹明123避光孵育30 min,用流式细胞仪检测,结果以Control组为对照,分析各组细胞线粒体膜电位变化。
1.2.9 Cleaved Caspase-3、Cleaved Caspase-9蛋白水平检测 收集Control、H/R、Salidroside-L、Salidro-side-M、Salidroside-H组细胞,在细胞中添加蛋白裂解液,冰上充分裂解,4℃,12 000 g离心10 min。将上清分装,保存在-80℃。用BCA法对蛋白定量检测,在蛋白中添加1/4体积的5×上样缓冲液,置于沸水中反应10 min。每孔上样量为30 μg,在80 V电压条件下观察预染的Marker开始分离以后,调节电压至120 V,电泳约2 h后,90 V电压将蛋白转移到PVDF膜上,经封闭液(5%牛血清白蛋白)室温封闭1.5 h,再与TBST按照1∶500稀释的一抗在4℃孵育过夜,再与TBST按照1∶3 000稀释的二抗室温反应1 h,ECL发光,用Bio-Rad分析图像,根据条带的光密度值分析蛋白表达水平,内参为GAPDH。
2 结果
2.1 红景天苷对缺氧复氧诱导的星形胶质细胞活力和LDH漏出率的影响 结果见图1和表1,缺氧复氧后的星形胶质细胞的存活率降低,细胞LDH漏出率升高,缺氧复氧诱导星形胶质细胞损伤。用高、中、低浓度的红景天苷处理缺氧复氧星形胶质细胞,细胞的存活率升高,LDH漏出率降低,红景天苷可以呈浓度依赖性减轻缺氧复氧星形胶质细胞损伤。
2.2 红景天苷对缺氧复氧诱导的星形胶质细胞SOD活性、GSH活性和MDA含量的影响 结果见表2,缺氧复氧后的星形胶质细胞SOD活性和GSH活性均降低,MDA含量升高,缺氧复氧诱导星形胶质细胞氧化损伤。用高、中、低浓度的红景天苷处理缺氧复氧星形胶质细胞,细胞MDA含量降低,SOD活性、GSH活性升高,红景天苷可以呈浓度依赖性减轻缺氧复氧星形胶质细胞氧化损伤,提高细胞中抗氧化酶活性。
2.3 红景天苷对缺氧复氧诱导的星形胶质细胞分泌TNF-α、IL-1β、IL-6的影响 结果见表3,缺氧复氧后的星形胶质细胞培养液中TNF-α、IL-1β、IL-6表达水平升高,缺氧复氧诱导星形胶质细胞分泌炎症因子。用高、中、低浓度的红景天苷处理缺氧复氧星形胶质细胞,细胞分泌的TNF-α、IL-1β、IL-6减少,红景天苷可以呈浓度依赖性减轻缺氧复氧星形胶质细胞炎性损伤,减少细胞分泌炎症因子。
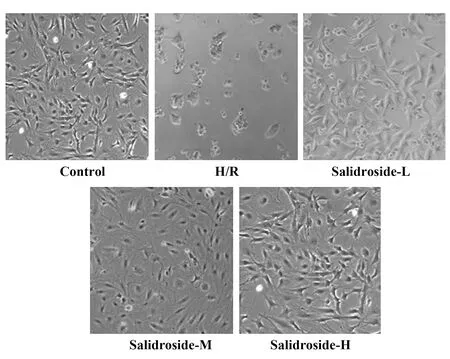
图1 各组星形胶质细胞生长状态Fig.1 Growth state of astrocytes in each group


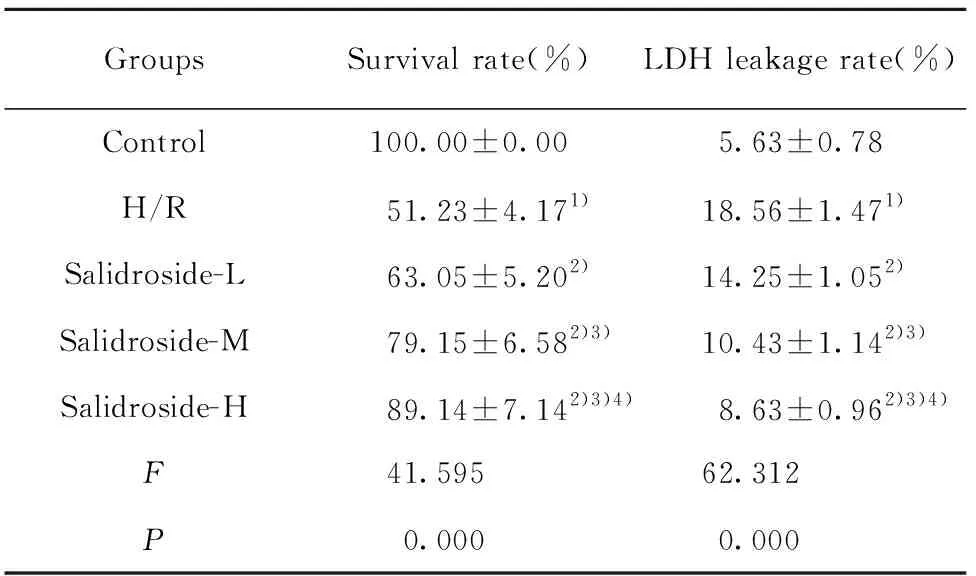
GroupsSurvival rate(%)LDH leakage rate(%)Control100.00±0.005.63±0.78H/R51.23±4.171)18.56±1.471)Salidroside-L63.05±5.202)14.25±1.052)Salidroside-M79.15±6.582)3)10.43±1.142)3)Salidroside-H89.14±7.142)3)4)8.63±0.962)3)4)F41.59562.312P0.0000.000
Note:Compared with Control,1)P<0.05;compared with H/R,2)P<0.05;compared with Salidroside-L,3)P<0.05 compared with Salidroside-M,4)P<0.05.
2.4 红景天苷对缺氧复氧诱导的星形胶质细胞凋亡的影响 结果见图2和表4,缺氧复氧后的星形胶质细胞凋亡率升高,缺氧复氧诱导星形胶质细胞凋亡。用高、中、低浓度的红景天苷处理缺氧复氧星形胶质细胞,细胞凋亡率降低,红景天苷可以呈浓度依赖性抑制缺氧复氧对星形胶质细胞凋亡诱导作用。


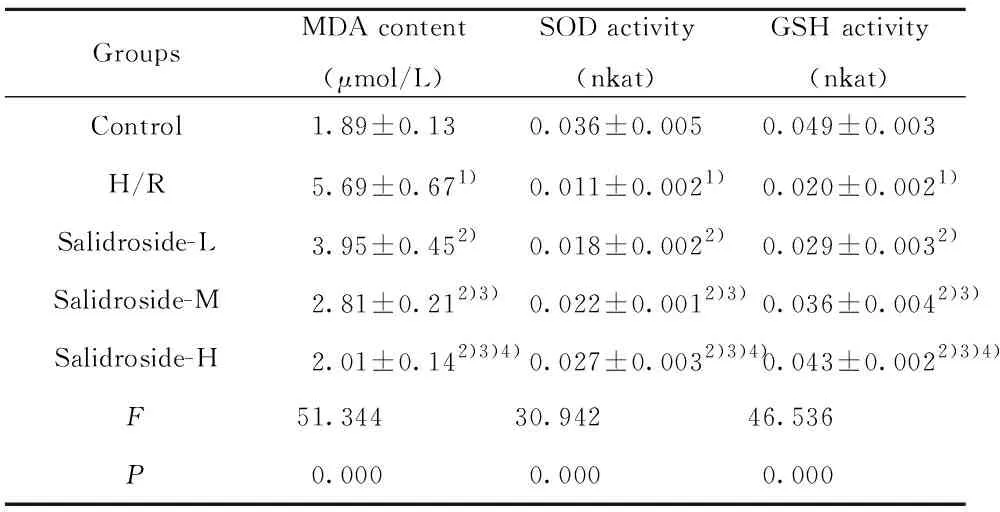
GroupsMDA content(μmol/L)SOD activity(nkat)GSH activity(nkat)Control1.89±0.130.036±0.0050.049±0.003H/R5.69±0.671)0.011±0.0021)0.020±0.0021)Salidroside-L3.95±0.452)0.018±0.0022)0.029±0.0032)Salidroside-M2.81±0.212)3)0.022±0.0012)3)0.036±0.0042)3)Salidroside-H2.01±0.142)3)4)0.027±0.0032)3)4)0.043±0.0022)3)4)F51.34430.94246.536P0.0000.0000.000
Note:Compared with Control,1)P<0.05;compared with H/R,2)P<0.05;compared with Salidroside-L,3)P<0.05;compared with Salidroside-M,4)P<0.05.


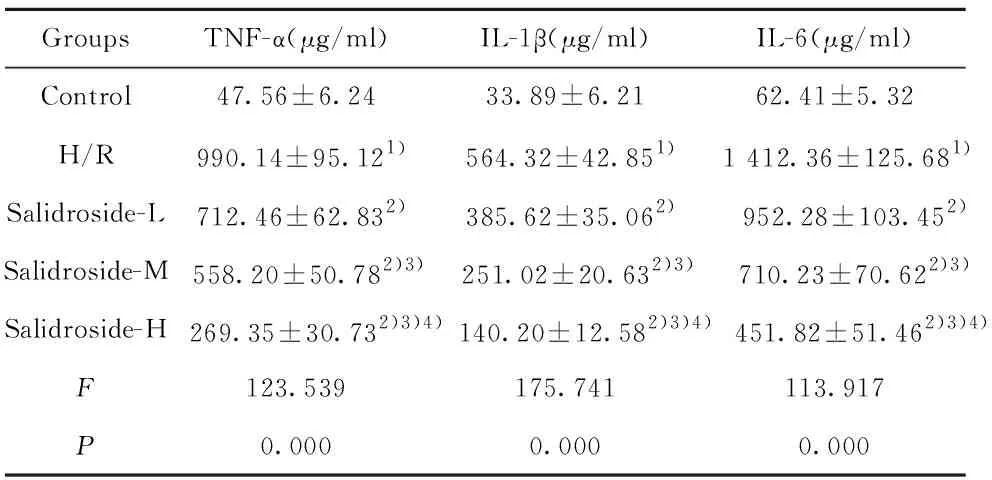
GroupsTNF-α(μg/ml)IL-1β(μg/ml)IL-6(μg/ml)Control47.56±6.2433.89±6.2162.41±5.32H/R990.14±95.121)564.32±42.851) 1 412.36±125.681)Salidroside-L712.46±62.832)385.62±35.062) 952.28±103.452)Salidroside-M558.20±50.782)3)251.02±20.632)3) 710.23±70.622)3)Salidroside-H 269.35±30.732)3)4) 140.20±12.582)3)4) 451.82±51.462)3)4)F123.539175.741113.917P0.0000.0000.000
Note:Compared with Control,1)P<0.05;compared with H/R,2)P<0.05;compared with Salidroside-L,3)P<0.05;compared with Salidroside-M,4)P<0.05.
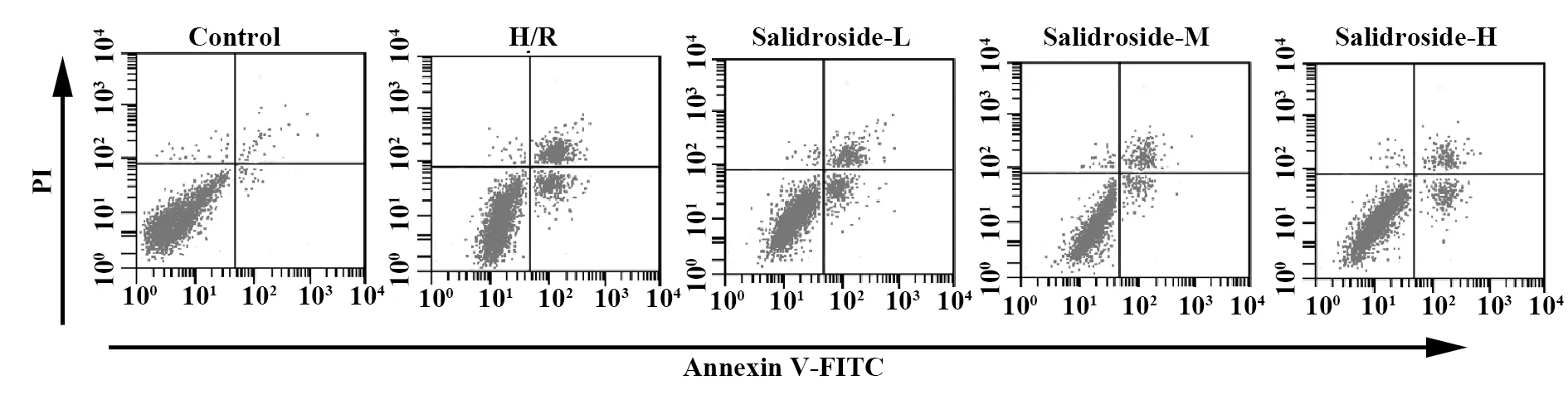
图2 流式细胞术检测细胞凋亡情况Fig.2 Flow cytometry to detect cell apoptosis


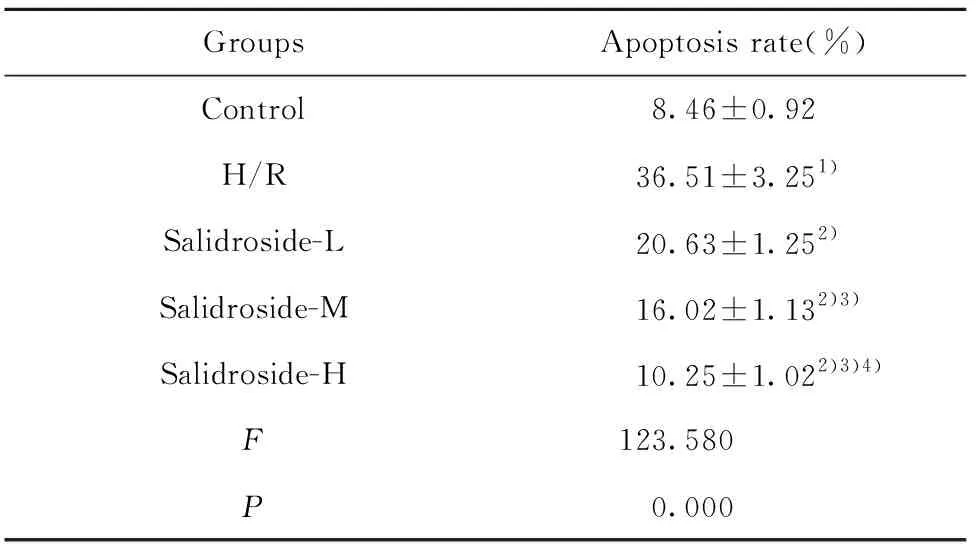
GroupsApoptosis rate(%)Control8.46±0.92H/R36.51±3.251)Salidroside-L20.63±1.252)Salidroside-M16.02±1.132)3)Salidroside-H10.25±1.022)3)4)F123.580P0.000
Note:Compared with Control,1)P<0.05;compared with H/R,2)P<0.05;compared with Salidroside-L,3)P<0.05;compared with Salidroside-M,4)P<0.05.
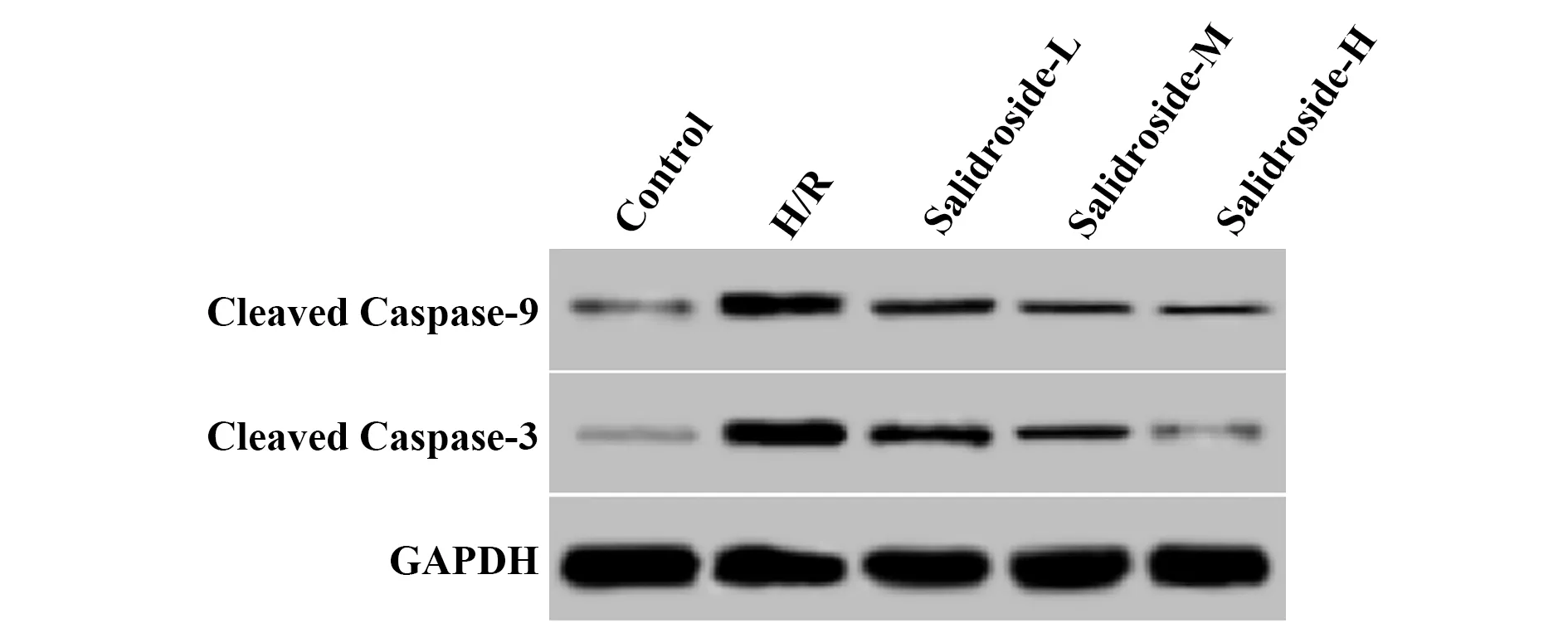
图3 Western blot检测红景天苷处理后缺氧复氧星形胶质细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白水平Fig.3 Western blot to detect Cleaved Caspase-3 and Cleaved Caspase-9 protein expression in anoxia reoxygenation astrocytes after treatment with salidroside
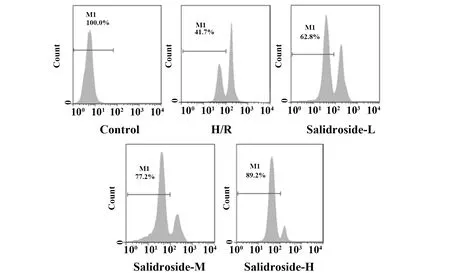
图4 流式细胞术检测红景天苷处理后缺氧复氧星形胶质细胞线粒体膜电位Fig.4 Flow cytometry to detect mitochondrial membrane potential in anoxia reoxygenation astrocytes after salidroside treatment


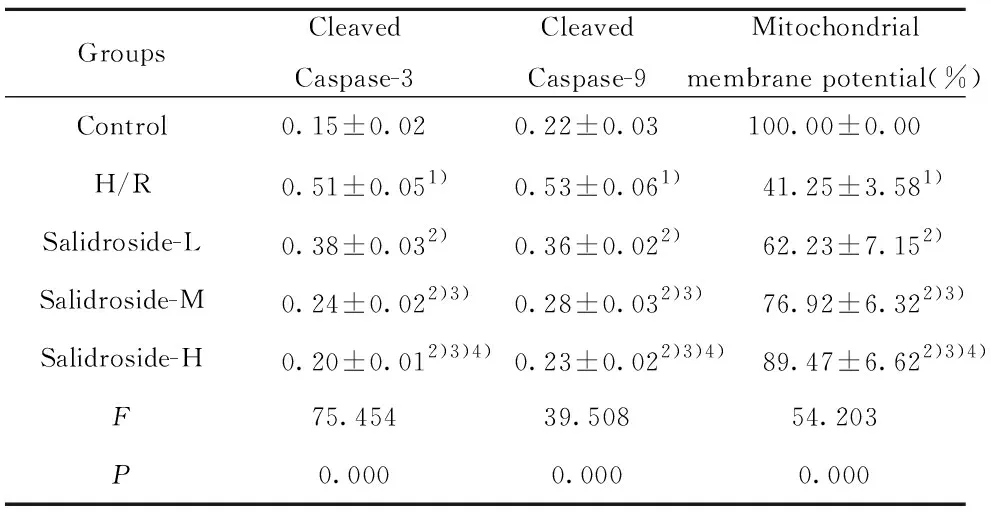
GroupsCleavedCaspase-3CleavedCaspase-9Mitochondrialmembrane potential(%)Control0.15±0.020.22±0.03100.00±0.00H/R0.51±0.051)0.53±0.061)41.25±3.581)Salidroside-L0.38±0.032)0.36±0.022)62.23±7.152)Salidroside-M0.24±0.022)3)0.28±0.032)3)76.92±6.322)3)Salidroside-H0.20±0.012)3)4)0.23±0.022)3)4)89.47±6.622)3)4)F75.45439.50854.203P0.0000.0000.000
Note:Compared with Control,1)P<0.05;compared with H/R,2)P<0.05;compared with Salidroside-L,3)P<0.05;compared with Salidroside-M,4)P<0.05.
2.5 红景天苷对缺氧复氧星形胶质细胞中Cleaved Caspase-3、Cleaved Caspase-9蛋白表达及线粒体膜电位的影响 结果见图3、4和表5,缺氧复氧后的星形胶质细胞中Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平升高,线粒体膜电位降低,缺氧复氧诱导星形胶质细胞线粒体凋亡途径激活。用高、中、低浓度的红景天苷处理缺氧复氧星形胶质细胞,细胞中Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平降低,线粒体膜电位升高,红景天苷可以呈浓度依赖性抑制缺氧复氧对星形胶质细胞线粒体凋亡途径激活作用。
3 讨论
脑缺血再灌注损伤的发生与氧自由基代谢异常、炎症因子分泌等因素有关,星形胶质细胞是脑组织中较大的胶质细胞,其在脑组织中的分布远多于神经元,脑缺血损伤发生首先会引起毛细血管周围的星形胶质细胞损伤,而星形胶质细胞损伤后过度凋亡和释放炎症因子,可以促进周围细胞凋亡和炎症发生[8,9]。LDH在正常细胞中常存在于细胞内,细胞受到外界因素刺激以后,LDH分泌到细胞外,LDH漏出率是检测细胞损伤的重要指标[10]。本实验的结果显示,缺氧复氧后的星形胶质细胞活力降低,LDH漏出率升高,说明缺氧复氧星形胶质细胞损伤模型构建成功。
氧自由基在人体多种器官和组织中广泛存在,具有杀灭细菌、降解毒物等作用,其还是一种重要的免疫调节因子[11]。脑缺血再灌注损伤的发生与脑组织中氧自由基大量积累有关,过量的氧自由基能够将蛋白质、脂质、核酸等物质过氧化,引起细胞功能异常,MDA是脂质过氧化的产物,SOD和GSH等是机体抗氧化系统的重要蛋白酶,SOD、GSH活性和MDA含量的高低是反映细胞氧化损伤程度的重要指标[12,13]。另外,机体内过量的氧自由基可以刺激线粒体,诱导线粒体膜电位下降,使细胞色素C进入到胞质,激活Caspase-9,诱导Caspase-3活化,最终诱导细胞凋亡的发生,这一过程又称为线粒体凋亡途径[14,15]。红景天苷具有抗氧化、减少细胞凋亡等作用,对于过氧化氢等诱导的心肌细胞、晶状体上皮细胞等细胞氧化损伤具有保护作用[16,17]。本实验表明,红景天苷处理缺氧复氧星形胶质细胞,细胞SOD、GSH活性升高,MDA含量降低,细胞凋亡减少,细胞中活化的Caspase-3和Caspase-9蛋白水平降低,红景天苷具有减轻缺氧复氧星形胶质细胞氧化损伤、减少细胞凋亡的作用。
脑缺血再灌注产生大量的氧自由基,这些氧自由基不仅可以引起细胞损伤,还可以通过促进炎症因子释放,诱发炎症反应而诱导周围正常细胞功能损伤[18,19]。星形胶质细胞是除中性粒细胞、巨噬细胞之外的脑缺血再灌注损伤炎症细胞,具有合成和分泌TNF-α、IL-1β、IL-6等炎症因子的作用,这些炎症因子可以损伤周围正常细胞,诱导细胞凋亡发生[20-22]。研究显示,红景天苷具有降低脑缺血再灌注中炎症反应的功能,另外在肝缺血再灌注、哮喘等炎症反应中也具有抑制作用[23-25]。本实验表明,红景天苷可以抑制缺氧复氧星形胶质细胞释放TNF-α、IL-1β、IL-6,说明红景天苷在缺氧复氧星形胶质细胞中具有抗炎作用。
总而言之,红景天苷具有减轻缺氧复氧星形胶质细胞细胞损伤的作用,可以减少星形胶质细胞氧化损伤和炎症因子释放,对于细胞凋亡具有抑制作用,红景天苷可以发展为治疗脑缺血再灌注损伤的药物,这对于红景天苷治疗脑缺血再灌注损伤具有重要的临床应用意义。
