人CD4+CD25-CD45RA+T细胞和CD4+CD25-T细胞诱导获得iTreg细胞的方法学研究①
2019-08-12张少鹏干晓杰
张少鹏 高 骥 干晓杰 鞠 峥 古 鉴 吕 凌
(南京医科大学第一附属医院肝胆中心,南京210029)
CD4+CD25+Foxp3+调节性T细胞(regulatory T cells,Treg)是一类特异性表达Foxp3的CD4+T细胞亚群,在诱导移植术后免疫耐受和维持体内免疫稳态中极为重要[1,2]。自1995年Sakaguchi 等首次报道Treg以来,越来越多的研究表明Treg与肿瘤、自身免疫性疾病如类风湿性关节炎、系统性红斑狼疮等、移植物抗宿主病、慢性感染等疾病状态的发生、发展密切相关[3-5]。目前关于Treg过继疗法治疗某些疾病已经取得了积极的进展,但是体外无法直接获得足够数量的nTreg用于多次大量的细胞回输。为了解决这一问题,近年来如何在体外获取诱导性调节性T细胞(induced regulatory T cells,iTreg)备受关注,我们先前研究发现全反式维甲酸可以促进CD4+CD25-T细胞(conventional T cells,Tcon)诱导生成iTreg,CD39+T细胞诱导生成的iTreg表现出更强的免疫抑制能力[6,7]。国内外多个团队在体外采用CD4+CD25-T 细胞进行诱导获取iTreg,其中姚智团队报道称在第6天iTreg产率最高,可达41.08%[8-10],但是这样的产率仍无法满足细胞治疗所需的数量,而且iTreg纯度及免疫调节能力对细胞治疗效果极为重要。
CD4+CD25-CD45RA+T细胞又称naive T细胞,其在外周血中的占比远高于nTreg细胞,也可在TGF-β、IL-2和CD3/CD28磁珠共刺激下诱导生成效应iTreg[11],目前关于采用CD4+CD25-T细胞或CD4+CD25-CD45RA+naive T细胞进行iTreg诱导的比较尚无报道。本实验旨在对比两种细胞亚群诱导iTreg的产率及诱导出的iTreg的功能差异,为后续iTreg的诱导和细胞治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞提取 自南京医科大学研究生志愿者提供的外周血中提取细胞,所有实验操作遵循南京医科大学伦理委员会批准的操作原则。通过MSC+血细胞分离机采集志愿者外周血,用Ficoll细胞分离液(BD公司)密度梯度离心分离出人单个核细胞,离心后分离出中层云雾层细胞,计数后重悬于适量PBS中,加入适量购自美天旎公司的Naive CD4+T Cell Biotin-Antibody Cocktail Ⅱ(每107个细胞加入10 μl),置于4℃冰箱5 min再加 naive CD4+T Cell MicroBeads (每107个细胞加入20 μl),置于4℃冰箱10 min,再通过美天旎磁性细胞分选机(Magnetic actived cell sorting,MACS,San Diego,CA,USA)筛选出CD4+T细胞。同样加入适量CD45RA microbeads和CD25 microbeads (美天旎,德国)分选出CD4+CD25-CD45RA+naive T细胞和CD4+CD25-T细胞。
1.1.2 实验动物 健康雌性NOD/SCID小鼠15只(8~12周)购自北京维通利华实验室。
1.2 方法
1.2.1 细胞培养与诱导 用含10%胎牛血清(Hyclone)、双抗生素(Gibco)、anti-CD3/28(1 bead∶5 cells,BD)、IL-2(100 U/ml)和TGF-β(5 ng/ml)的培养基(LONZA)将两组细胞重悬至1×106ml-1,加至96孔板中培养(200 μl/孔)。部分添加IL-1β(10 ng/ml)和IL-6(10 ng/ml)模拟炎性环境下的诱导,将细胞分为4组:CD4+CD25-CD45RA+naive T细胞普通诱导、CD4+CD25-T细胞普通诱导、CD4+CD25-CD45RA+naive T细胞炎性条件下诱导、CD4+CD25-T细胞炎性条件下诱导,第3、6天通过流式细胞仪检测。
1.2.2 流式检测 细胞离心去上清后加入细胞流式抗体(全部购自BD公司),anti human CD4-PE-cy7、anti human CD25-APC-cy7、anti human CD45RA-APC置于4℃冰箱20 min。加入细胞固定破膜液(BD公司),加入核内抗体anti human Foxp3-Alexa Flour647、anti human CD152-PE,置于4℃冰箱30 min。细胞因子的测定首先加入 PMA,ionomycin和brefeldin A 刺激封闭,在5%CO2,37℃ 的条件下孵育4~6 h,固定破膜后加入细胞因子流式抗体(全部购自BD公司):anti human IL-17-BV421、anti human IL-10-PE、anti human IL-2-PE、anti human IL-1β-Alexa Flour647、anti human TGF-β-Alexa Flour488、anti human IFN-γ-APC,置于4℃冰箱30 min 后上流式机检测,数据用FlowJo 软件分析。本实验中采用的Isotype流式抗体分别为APC/Cy7 Rat IgG2b、Alexa Flour 647 Rat IgG2b、Brilliant Violet 421TM Rat IgG1、APC Rat IgG1(BD公司)。
1.2.3 小鼠移植物抗宿主疾病(Graft versus host disease,GVHD)模型建立 第0天,小鼠在动物中心接受辐照(50 cGy)以破坏小鼠自身免疫系统,然后随机分成3组,通过尾静脉注射细胞:组1单纯注射10 ×106人外周淋巴细胞;组2注射10×106人外周淋巴细胞+10×106由naive T诱导的iTreg;组3注射10×106人外周淋巴细胞+10×106由CD4+CD25-T诱导的iTreg。小鼠饲养于南京医科大学动物中心无菌鼠房,操作均遵守南京医科大学动物伦理委员会通过的协议,每周称重3次,观察小鼠的活力,并记录小鼠存活情况。
2 结果
2.1 T细胞分选纯度和诱导前细胞因子表达情况 通过MACS分选出CD4+CD25-CD45RA+naive T细胞和CD4+CD25-T细胞后,我们随即对两组细胞的纯度和细胞因子分泌情况进行流式鉴定。如图1所示:两组细胞的CD4+CD25-T细胞的分选纯度都在90%以上,CD4+CD25-CD45RA+naive T细胞中CD45RA+T 细胞占CD4+CD25-T细胞的(98.00±0.81)%。与此同时,两组CD4+T细胞均不表达Foxp3,但是均表达细胞因子IL-17且两组间无明显差异,分别为(60.00±1.32)%和(61.00±2.19)%。而TGF-β、CTLA-4、IL-10、IL-2、IFN-γ等细胞因子两组细胞在第0天均未检测到明显表达(图未显示)。
2.2 不同组iTreg诱导产率的差异 第3天诱导后,我们在CD4+T细胞群中圈取CD25和Foxp3双阳的T细胞为iTreg。结果显示CD4+CD25-CD45RA+T细胞组和CD4+CD25-T细胞组在TGF-β和IL-2共刺激下,iTreg诱导率分别为(28.37±2.80)%和(23.87±0.87)%,前者高于后者,且差异有统计学意义(P<0.05)。 而在炎性环境下,两组的诱导率为(25.63±2.15)%和(18.80±1.47)%,同样是前者大于后者(P<0.01),同时我们发现炎性因子刺激下调iTreg的诱导率,尤其对CD4+CD25-T细胞组的影响比较大(P<0.05)。先前研究证明第6天iTreg的诱导率达到峰值,本实验测得四组第6天诱导率分别为(96.00±0.21)%、(81.97±1.29)%、(60.23±0.50)%、(56.80±0.43)%,见图2A、B。结果显示,CD4+CD25-CD45RA+T细胞组在普通和炎性条件下诱导率均高于CD4+CD25-T细胞组,且炎性因子刺激下调iTreg诱导率,差别有统计学意义。
2.3 iTreg功能相关分子和抑炎因子的表达变化趋势 毒性T淋巴细胞相关抗原-4(Cytotoxic T lym-phocyte-associated antigen-4,CTLA-4/CD152)和CD80/86具有高亲和力,对iTreg发挥免疫抑制功能非常重要。此次实验发现,第3天炎性环境下诱导生成的iTreg中CTLA-4表达率较高,第6天四组均高表达CTLA-4(见图2C、D)。转化生长因子-β(Transforming growth factor-β,TGF-β)和白介素-10(Interleukin-10,IL-10)作为重要的抑炎因子,是衡量iTreg免疫调节能力的重要指标。分析发现第3天炎性环境下表达TGF-β的iTreg比例较高(P<0.01),到第6天,TGF-β和IL-10的表达均在95%以上,组间未见明显差异(P>0.05),见图3。
2.4 促炎因子在不同组iTreg的表达情况 第3天检测发现iTreg基本不表达IL-2,而第6天,不同组iTreg中IL-2表达水平差异较大, 两种环境下CD4+
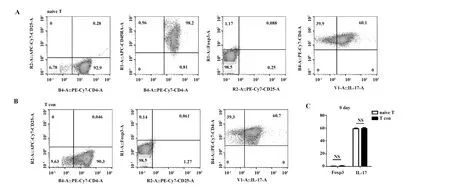
图1 T细胞分选纯度和诱导前细胞因子表达水平Fig.1 Purity of T cells and expression levels of cytokines before inducationNote: A.The purity of CD4+CD25-T cells was (92.00±3.68)%in naive T cells group and CD45RA+ T cells account for (98.00±0.81)% in CD4+CD25-T cells.Foxp3 and IL-17 expression levels were tested in CD4+CD25-CD45RA+T cells(flow cytometry);B.The purity of CD4+CD25-T cells was (90.00±1.74)% in conventional T cells group,Foxp3 and IL-17 expression levels were tested by flow cytometry;C.No significant difference was found in Foxp3 and IL-17 expression between two groups.NS.Not significant.
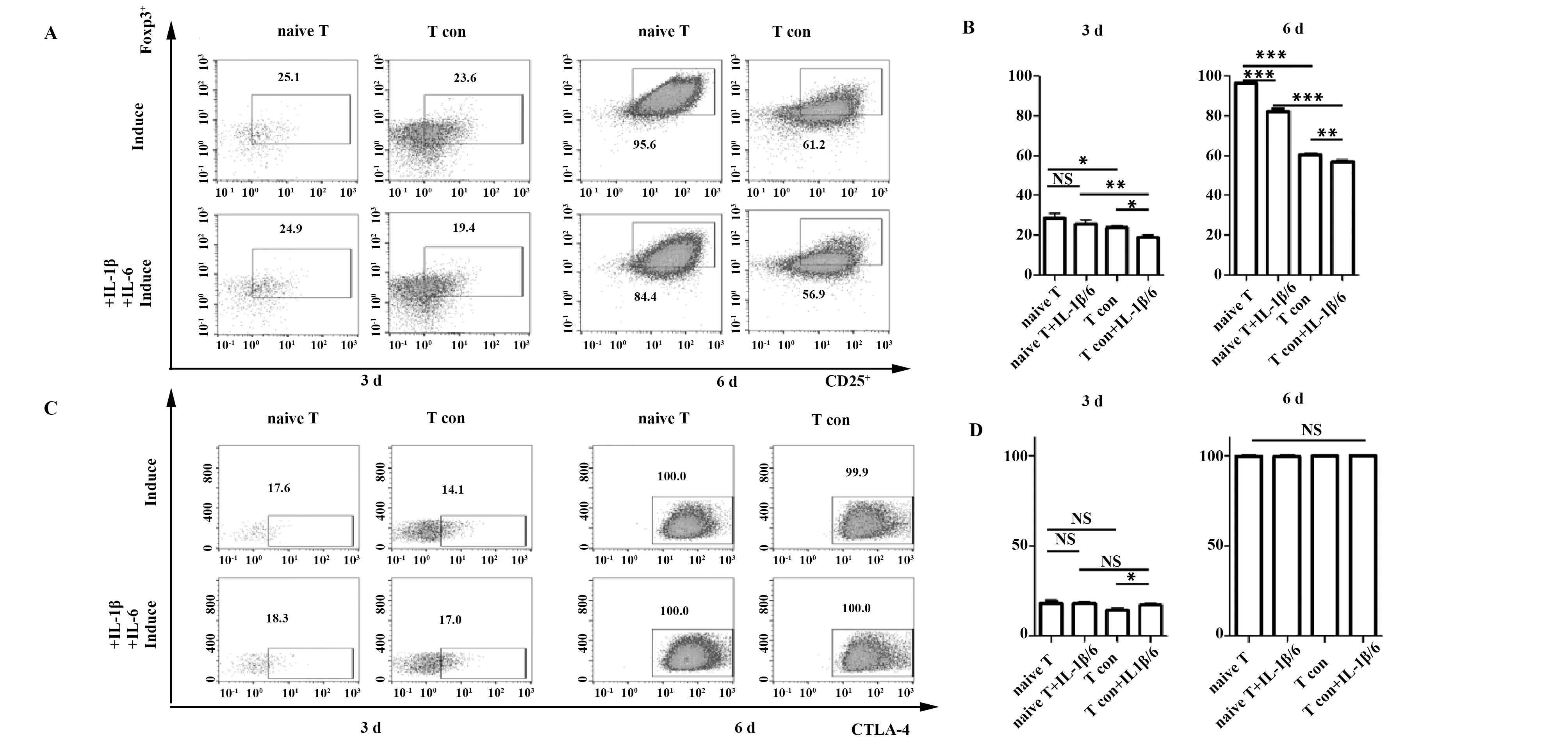
图2 iTreg细胞诱导产率和iTreg细胞CTLA-4蛋白表达水平Fig.2 Yield rate of iTreg and expression level of CTLA-4 in iTregNote: A,B.Yield rate of iTreg induced from human CD4+CD25-CD45RA+T cells(naive T) exhibited remarkable increase on day 3 and 6 compared with CD4+CD25-T cells(T con)in normal/inflammatory conditions(flow cytometry);C,D.CTLA-4 expression level in iTregs showed no significant difference between two groups(flow cytometry).NS.Not significant;*.P<0.05;**.P<0.01;***.P<0.001.
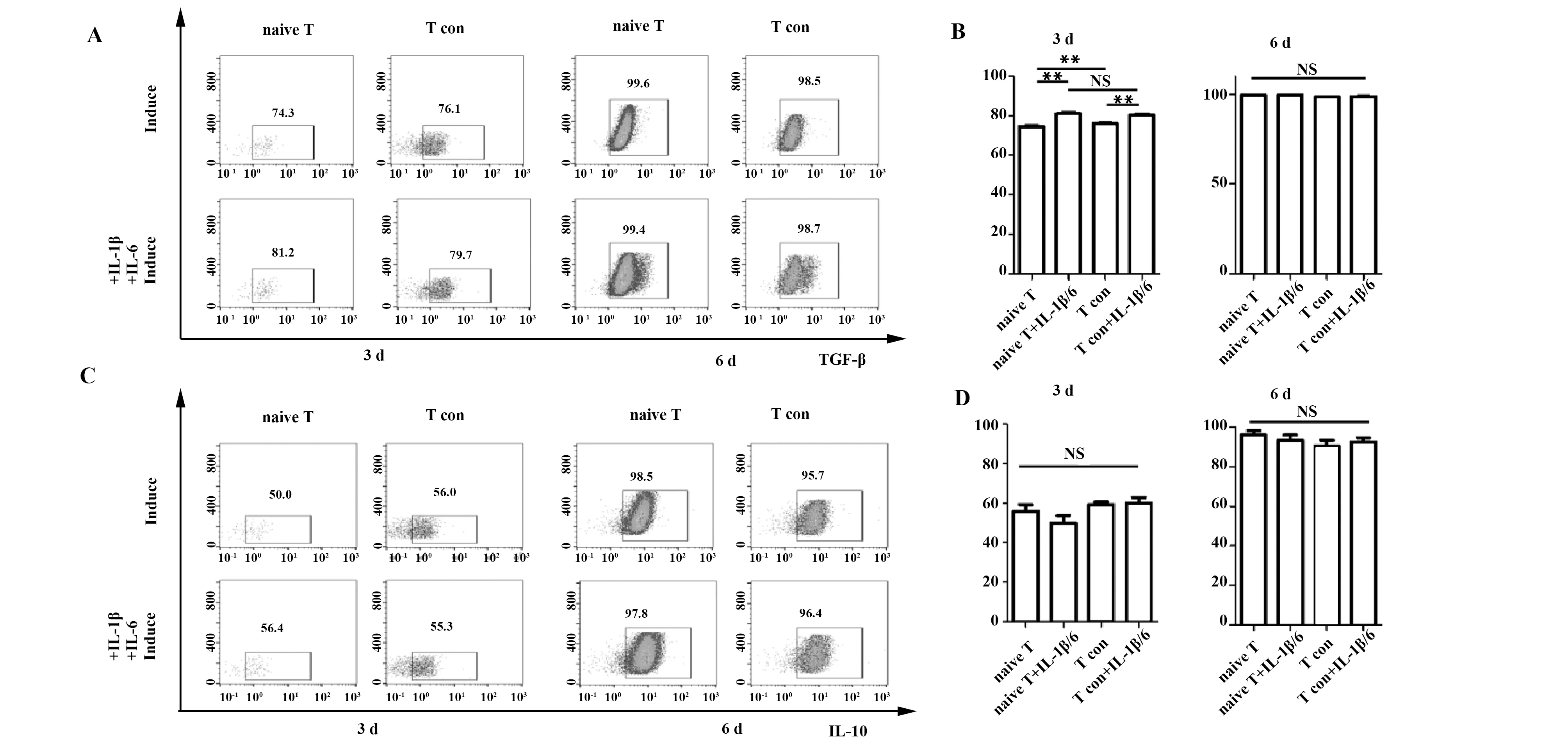
图3 iTreg细胞TGF-β和IL-10细胞因子表达水平Fig.3 Expression levels of TGF-β and IL-10 in iTregNote: A,B.TGF-βexpression level in iTreg showed no significant difference between two groups(flow cytometry);C,D.IL-10 expression level in iTreg showed no significant difference between two groups(flow cytometry).NS.Not significant;**.P<0.01.
CD25-T细胞组IL-2+iTreg占比都显著高于CD4+CD25-CD45RA+T细胞组[(25.20±1.74)% vs (2.77±0.14)%,(18.23±0.66)% vs (4.47±0.29)%],研究还发现炎性因子刺激上调IL-2+iTreg比例(P<0.05)。IL-17在第3天均有少量表达,炎性环境下表达较高[(2.36±0.21)% vs (3.27±0.18)%,(2.96±0.15)% vs (4.21±0.17)%],差异具有统计学意义。第6天观察发现,普通环境和
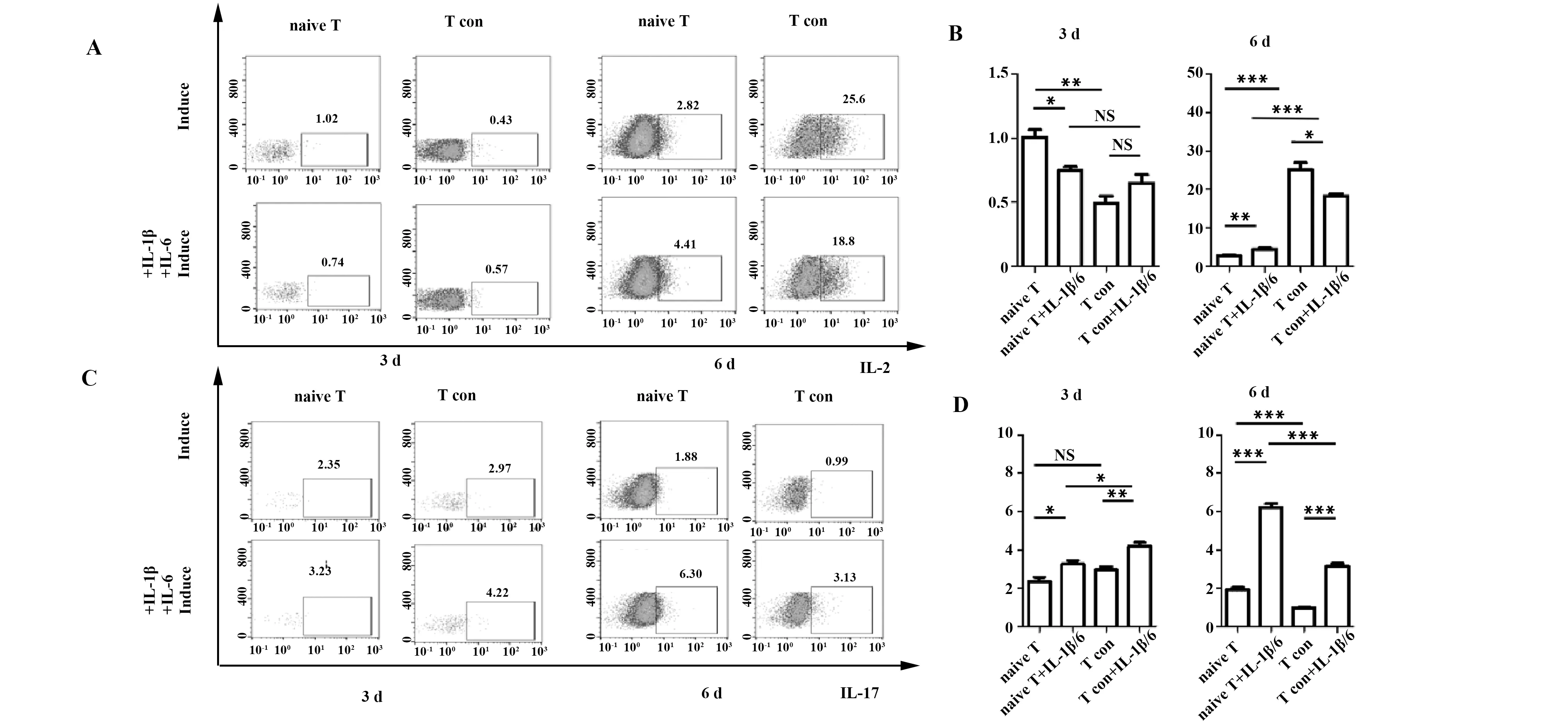
图4 iTreg细胞IL-2和IL-17细胞因子表达水平Fig.4 Expression levels of IL-2 and IL-17 in iTregNote: A,B.IL-2 expression level in human CD4+CD25-CD45RA+T cells(naive T) was much lower than CD4+CD25-T cells(T con);C,D.An increase on IL-17 expression level was detected in iTreg under inflammatory environment(flow cytometry).NS.Not significant;*.P<0.05;**.P<0.01;***.P<0.001.

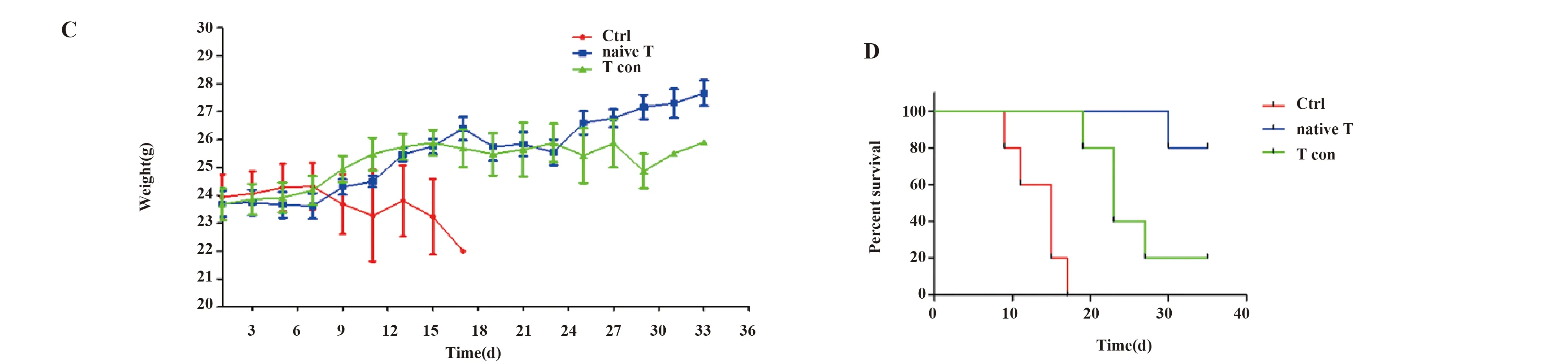
图5 iTreg细胞IFN-γ细胞因子表达水平和GVHD小鼠模型存活情况
Fig.5 Expression levels of IFN-γ in iTreg and survival status of GVHD mice
Note: A,B.IFN-γ expression level in iTreg showed no difference on day 3 but exhibited an increase on IL-1β/6 treatment groups on day 6(flow cytometry);C,D.The weight and percent survival of GVHD mice.Mice injected with iTreg induced from naive T cells exhibited minimum weight loss and highest percent survival. NS.Not significant,*.P<0.05;**.P<0.01;***.P<0.001.
炎性环境下IL-17表达差异性显著增大[(1.94±0.09)% vs (6.22±0.18)%,(0.96±0.09)% vs (3.07±0.24)%],但CD4+CD25-T细胞组IL-17表达水平却低于CD4+CD25-CD45RA+T细胞组,见图4。干扰素-γ(Interferon-γ,IFN-γ)是一类比较特殊的细胞因子,诱导第3天IFN-γ+iTreg占比都在50%左右,第6天检测发现CD4+CD25-CD45RA+T细胞组诱导获得的IFN-γ+iTreg占比较低,且两组细胞在炎性刺激因子刺激下IFN-γ+iTreg占比均增加(见图5A、B)。
2.5 iTreg对GVHD模型小鼠免疫调节能力的分析 体外实验初步证明CD4+CD25-CD45RA+T细胞组诱导获得的iTreg具有更高的纯度和免疫调节能力,为了进一步验证此猜想,我们通过建立GVHD小鼠模型,进行体内实验。我们将小鼠随机分成3组,分别通过尾静脉注射PBMC±普通环境下不同组诱导获得的iTreg,结果显示单纯注射PBMC的小鼠体重下降较快,第9天开始死亡,到第17天全部死亡,而同时注射CD4+CD25-T细胞组iTreg的小鼠体重下降较慢,且存活时间显著延长(P<0.05),CD4+CD25-CD45RA+T细胞组小鼠第35天生存率依然保持80%,死亡率明显低于其他两组(P<0.05),见图5C、D。
3 讨论
Treg分为天然型Treg(natural Treg,nTreg)与诱导型Treg,有研究报道nTreg在炎性微环境下抑制功能不稳定[12,13],而大部分需要免疫调节治疗的患者体内均为炎性环境,因此iTreg 的细胞疗法成为研究热点。iTreg细胞免疫疗法近年来取得了长足的进展,越来越多的动物实验证明,过继性输注 iTreg 细胞能稳定而有效地抑制多种自身免疫疾病[14]。但在 iTreg 体外诱导培养过程中发现,iTreg 细胞存在诱导效率不高和细胞数量不足两大问题,限制了iTreg 细胞疗法进一步推广到临床运用的步伐。因此,本研究目的在于对比两种不同扩增 iTreg 细胞的方法,以求寻找出iTreg诱导产率较高,炎性微环境下细胞功能相对稳定的途径,以期增加细胞数量和提高疗效以满足临床输注要求,从而提高iTreg 细胞疗法运用于临床的可行性。
Foxp3(Forkhead box protein P3) 属于叉头样转录因子家族,它主要在CD4+CD25+Treg中表达,是调控 Treg 分化和行使免疫调节功能的主控基因[15]。Foxp3的表达水平是衡量iTreg诱导是否成功和判断细胞是否具有免疫调节能力的重要指标。共刺激分子CD152(CTLA-4)被证实与iTreg中的Foxp3表达紧密相关,对维持iTreg抑制功能至关重要,阻断CTLA-4的表达会造成iTreg免疫调节能力下降[16]。TGF-β是一种诱导机体耐受、调节免疫反应的重要的抑制性细胞因子,它诱导Treg 细胞分化,并能抑制 T 细胞的增殖和作用,是调节性 T 细胞分化、功能维持的关键因子,IL-10是参与介导iTreg抑制Th17细胞增殖的主要抑炎因子,因此IL-10和TGF-β的分泌是iTreg发挥免疫抑制功能的关键[17]。
我们发现,CD4+CD25-CD45RA+T细胞组诱导的iTreg产率最高,即使在炎性环境下也高于CD4+CD25-组。我们猜测:①CD4+T细胞内包含CD45RA-CD45R0+T细胞,即记忆T细胞,该细胞已在外周环境中被激活,相对CD45RA+T细胞较难分化为Treg细胞;②CD45RA+T细胞在分化为iTreg过程中可分泌大量抗炎细胞因子,如TGF-β、IL-10等,这些细胞因子可提高Treg细胞Foxp3的表达,增强细胞功能以及炎症环境下的稳定性。各组诱导出的iTreg细胞本身在CTLA-4、TGF-β和IL-10表达水平上没有明显差异,说明不同方法获得的iTreg都具备维持其稳定和发挥免疫功能的基本要素。
IL-2是一种重要的促炎因子,分泌IL-2被认为是iTreg免疫调节功能缺失的一个重要特征[18]。本研究发现CD4+CD25-组诱导所得的IL-2+iTreg占比显著高于CD4+CD25-CD45RA+T组,因此我们推测CD4+CD25-组iTreg的功能可能较弱。在炎性环境下诱导的IL-17+iTreg细胞比例增加且CD4+CD25-CD45RA+T组较高,具体机制尚不清楚,可能与炎性环境下的IL-6刺激相关。IFN-γ被认为是1型辅助性T细胞(Th1细胞)的标志性细胞因子,后来发现Treg细胞同样可以产生IFN-γ,且IFN-γ在抗炎症、抗肿瘤和免疫调节方面发挥着重要的作用[19]。甚至有研究报道移植物功能良好的患者体内表达IFN-γ的CD4+iTreg(CD4+CD25+Foxp3+IFN-γ+)数量明显升高,提示IFN-γ也许在诱导人移植物免疫耐受中发挥着重要作用[20]。本研究发现IFN-γ+iTreg在各组中均有一定的表达,但IFN-γ作为一种促炎因子,难以作为评判iTreg功能的单一因素。体内实验初步表明两组诱导获得的iTreg均能改善GVHD模型小鼠的免疫疾病,且CD4+CD25-CD45RA+T细胞组的iTreg调节能力更强,这与体外实验结果一致。
综上所述,我们首次发现在TGF-β、IL-2和CD3/CD28磁珠共刺激下,在普通环境和炎性微环境下由CD4+CD25-CD45RA+T细胞诱导生成iTreg产率较CD4+CD25-T细胞高,CD4+CD25-CD45RA+T细胞诱导生成iTreg细胞功能也强于同等条件下由CD4+CD25-T细胞诱导获得的iTreg。这一新的研究发现,将为解决 iTregs 诱导率低和细胞数量不足两大难题提供新思路,从而加快 iTreg 细胞疗法在治疗自身免疫性疾病相关方面的前进步伐。
