miR-10b通过下调KLF10促进高糖诱导的肾小管上皮细胞EMT*
2019-07-30张黎黎李劲高徐安平
张黎黎, 吕 军, 杨 荟, 付 莎, 李劲高, 黄 蓉, 宛 霞, 徐安平
(中山大学孙逸仙纪念医院肾内科, 广东 广州 510210)
一直以来,肾纤维化被认为是多种慢性肾疾病进展至终末期肾病的病理损伤过程,它与肾功能障碍和最终器官衰竭密切相关,但是目前仍然没有有效干预手段以阻止肾纤维化的发生和发展[1-2]。尽管投入了大量的研究工作,肾纤维化是如何产生的仍颇具争议性[2-3],而其中肾小管上皮-间充质转化(epithelial-mesenchymal transition,EMT)是导致肾纤维化发生的机制之一[4]。在EMT过程中,上皮细胞会失去自身的特性而获得基质细胞的特点,如细胞形态改变;波形蛋白(vimentin)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等表达增加,细胞迁移能力增强;E-钙黏蛋白(E-cadherin)表达减少,细胞间连接下降;细胞外基质蛋白,如纤连蛋白(fibronectin,FN)等表达增加[5]。几乎每一种肾损伤都会不同程度地诱导肾小管上皮细胞经历EMT的不同阶段从而导致纤维化,但是EMT是如何参与肾纤维化的进程及其具体分子机制尚知之甚少,这意味着对EMT的充分了解将会使我们为肾纤维化更好地提出有效的干预策略。
最近有研究表明一些特异的微小RNA(micro-RNA,miRNA,miR)在组织的纤维化进程中扮演着至关重要的角色[6-7]。miRNA是一类由长约20~25 nt的单链非编码RNA,它主要通过抑制靶基因的翻译在转录后水平调控靶基因的表达[8]。miR-10前体家族成员编码了一系列短非编码RNA,它们广泛参与到基因的调控过程中[9],其中,miR-10b是维甲酸诱导的细胞分化事件中的关键调控子[10]。除此之外,miR-10b也被证实可以通过促进细胞的增殖、侵袭以及迁移等过程参与肿瘤生成,包括低级别胶质瘤和乳腺癌等[11-13],这些事件与EMT有很多共同的调控分子,比如生长分化因子15(growth differentiation factor 15, GDF15)可以同时促进转移和EMT[14];Ski可以参与细胞的侵袭和EMT[15],基于以上研究,我们推测miR-10b很可能在EMT进程中发挥着重要的作用,且其潜在的机制也有待深入研究。
在本研究中,我们检测了2型糖尿病合并肾纤维化患者肾组织样本中的miR-10b表达水平,并在体外实验中研究了miR-10b是否参与了高糖诱导的肾小管上皮细胞的EMT,并对其相关机制进行了探索,以期为糖尿病肾病肾纤维化的有效治疗提供潜在的候选靶点。
材 料 和 方 法
1 实验试剂
胎牛血清(fetal bovine serum,FBS)和DMEM-F12培养基购自Gibco;SuperReal PreMix试剂盒购自北京天根公司;RNAiso Plus试剂盒、TRIzol试剂盒和M-PER试剂盒购自Life Technologies;Lipofectamine 2000转染试剂和Lipofectamine RNAiMAX试剂盒购自Thermo Fisher Scientific;BCA法蛋白定量试剂盒购自江苏碧云天公司;miR-10b 模拟物(mimic)和抑制物(inhibitor)购自广东瑞博生物公司;抗FN、SLUG、KLF10和β-actin抗体购自Abcam;抗N-cadherin、p-Smad3和转化生长因子β(transforming growth facton-β,TGF-β)抗体购自CST;抗SNAI1抗体购自Proteintech;双萤光素酶报告基因检测试剂盒购自Promega。
2 临床样本
10例癌旁肾组织来自病理科留存的肾癌切除术后癌旁正常肾组织(经病理科检验为正常肾组织);10例肾病患者肾组织来自于经肾穿刺检测的2型糖尿病合并肾纤维化患者肾组织,该项实验经过患者知情同意。实验经过中山大学孙逸仙纪念医院伦理委员会批准。
3 方法
3.1细胞培养与高糖诱导肾小管上皮细胞EMT模型的建立 人永生化肾小管上皮细胞HK-2购自ATCC。细胞在含10%胎牛血清的DMEM-F12培养体系中进行培养,培养环境为5% CO2、95%相对湿度,Thermo 3111型37 ℃恒温密闭式细胞培养箱中。采用30 mmol/L D-葡萄糖分别作用于HK-2细胞0、12、24和48 h,建立高糖诱导肾小管上皮细胞EMT模型。
3.2瞬时转染实验 HK-2细胞接种于35 mm培养皿中,静置贴壁后以Lipofectamine RNAiMAX转染KLF10过表达质粒、miR-10b mimic和inhibitor,乱序RNA片段作为对照,12 h后更换含10% FBS的DMEM-F12培养基并给予高糖刺激相应时间。具体步骤如下:先向250 μL Opti-MEM培养基中加入相应浓度片段,再向250 μL Opti-MEM培养基中加入Lipofectamine RNAiMAX 5 μL,然后将上述稀释好的Lipofectamine RNAiMAX和miR-10b mimic或inhibitor片段混合,室温静置5 min;将混合物滴加到所需转染培养皿中(培养基体积为2.5 mL),最终培养体系为3 mL。
3.3RT-qPCR实验 对于组织:取适量样本组织加入1 mL RNAiso Plus至匀浆器进行匀浆,液体澄清后转移至1.5 mL离心管中,室温静置5 min后,按照说明书提取组织总RNA。对于细胞:当细胞生长至对数期时,以每孔2×105密度接种于6孔板中,贴壁后给予相应处理。处理结束后除去上清,按照说明书每孔中加入1 mL TRIzol试剂提取细胞RNA。总RNA经Qubit 2.0荧光计测定浓度后,以1 μg总RNA进行逆转录反应,PCR参数为42 ℃ 60 min,70 ℃ 10 min以终止逆转录反应。cDNA按照SuperReal PreMix试剂盒说明书操作,与引物一起进行实时定量PCR实验。miRNA-10b的上游引物序列为5’-ACATCATACCCTGTAGAACCGAA-3’, 下游引物序列为5’-GATTGGATGTTCTCCACAGTCTC-3’; U6的上游引物序列为5’-GCTTCGGCACATATACTAAAAT-3’, 下游引物序列为5’-CGCTTCACGAATTTGCGTGTCAT-3’。设置PCR参数为:95 ℃ 10 min; 95 ℃ 10 s、62 ℃ 30 s、72 ℃ 30 s进行40个循环,缓慢升温至95 ℃。反应结束后,按照2-ΔΔCt法计算miR-10b的相对表达量。
3.4Western blot法检测蛋白表达 HK-2细胞接种于35 mm培养皿中,经过各组处理至相应时间后去除上清,预冷PBS轻柔洗涤3次。每孔加入200 μL细胞裂解液,按照M-PER试剂盒说明书提取细胞总蛋白,之后利用BCA法试剂盒测定蛋白浓度。蛋白定量至相同浓度后,取蛋白样品20 μg,加入5×SDS蛋白上样缓冲液并在沸水中煮5 min使蛋白彻底变性。之后行SDS-PAGE分离;湿转法转移到PVDF膜。5%脱脂奶粉室温封闭1 h后加入稀释后的 I 抗(抗体稀释液为5% BSA),4 ℃孵育过夜;次日用TBST 洗涤3次,每次5 min,加入相应 II 抗室温孵育1 h,TBST洗涤3次后利用化学发光法显色拍照。
3.5双萤光素酶报告基因实验 将KLF10基因3’-UTR克隆至pGL3质粒以构建pGL3-KLF10野生型载体和突变型载体。HK-2细胞接种于12孔板中,静置贴壁后以Lipofectamine 2000按照实验设计共转染pGL3-KLF4野生型载体或突变型载体以及miR-10b模拟物。24 h后,根据双萤光素酶报告基因实验试剂盒说明书利用Synergy H1型多功能酶标仪检测萤火虫萤光素酶活性,以海肾萤光素酶活性作为内参照。
4 统计学处理
使用GraphPad Prism 6 软件进行实验数据统计分析。所有实验均进行3次或者3次以上,数据采用均数±标准差(mean±SD)表示。两组或多组定量资料在满足正态分布和方差齐的条件下,分别采用双侧t检验和单因素方差分析(one-way ANOVA)方法。以P<0.05为差异具有统计学意义。
结 果
1 miR-10b在肾纤维化组织中高表达
癌旁正常肾组织和2型糖尿病合并肾纤维化患者肾组织中miR-10b表达的分析结果显示,在2型糖尿病合并肾纤维化患者肾组织样本中,miR-10b的表达水平较正常对照组显著增加(P<0.01),见图1。
Figure 1.The expression level miR-10b was up-regulated in the tissues from type 2 diabetes patients with kidney fibrosis. The relative expression level of miR-10b in para-carcinoma normal tissues(PC) and type 2 diabetes patients with kidney fibrosis (KD) tissues were detected by RT-qPCR. Mean±SD.n=10.**P<0.01vsPC group.
图1 在2型糖尿病合并肾纤维化患者肾组织中miR-10b的表达增加
2 miR-10b在高糖刺激的HK-2细胞中高表达
30 mmol/L D-葡萄糖分别作用于HK-2细胞0、12、24和48 h后,可时间依赖性地促进miR-10b的表达,其中刺激24 h和48 h后,miR-10b的表达较正常对照组显著上调(P<0.01),见图2A。进一步利用30 mmol/L甘露醇作用于HK-2细胞48 h,miR-10b的表达并没有改变,见图2B。 结果说明,本研究排除了渗透压改变,miR-10b表达上调是高糖引起的。
3 下调miR-10b抑制高糖诱导的肾小管上皮细胞EMT
HK-2细胞转染miR-10b inhibitor 24 h后,给予30 mmol/L D-葡萄糖刺激48 h,观察细胞形态变化和EMT标志蛋白表达改变。结果显示,正常对照(normal control, NC)组HK-2细胞呈现鹅卵石形状,高糖(high glucose,HG)组细胞表现为成纤维细胞样的长条形,而miR-10b inhibitor预处理可以抑制由高糖刺激诱导的细胞形态学改变,见图3A。同时,与NC组相比,高糖刺激可诱导EMT的分子标志蛋白fibronectin、SLUG、N-cadherin和SNAI1上调(P<0.01);与高糖组相比,miR-10b inhibitor预处理可抑制高糖诱导的EMT分子指标表达(P<0.01),见图3B。
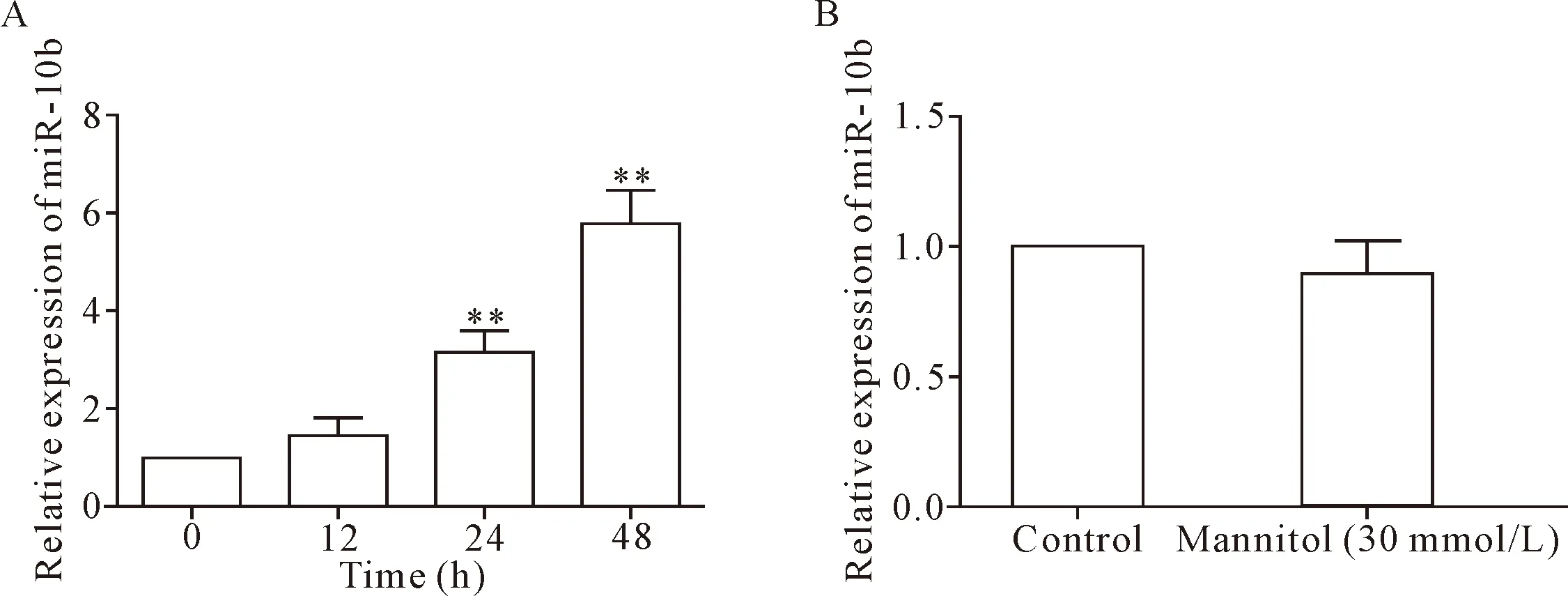
Figure 2.The expression level of miR-10b was up-regulated in high glucose-stimulated HK-2 cells in a time-dependent manner (A), however, 30 mmol/L mannitol had none affect on miR-10b expression (B). The relative expression of miR-10b in each treatment group was detected by RT-qPCR. Mean±SD.n=3.**P<0.01vs0 h group.
图2 高糖刺激以时间依赖的方式诱导HK-2细胞中miR-10b表达上调

Figure 3.Downregulation of miR-10b inhibited high glucose-induced EMT in renal tubular epithelial cells. A: the morphological changes of HK-2 cells were observed by microscope (scale bar=20 μm); B: the expression levels of indicated EMT markers were detected by Western blot. Mean±SD.n=4.**P<0.01vsNC group;#P<0.05,##P<0.01vsHG group.
图3 下调miR-10b抑制高糖诱导的肾小管上皮细胞EMT
4 miR-10b可直接作用于KLF10并抑制其表达
通过在线数据库miRBase对miR-10b的靶点进行预测,结果显示KLF10(Krüppel-like transcription factor 10)是miR-10b的一个结合靶点,见图4A。进一步在HK-2细胞转染miR-10b mimic或inhibitor,检测KLF10表达水平,结果显示在转染miR-10b mimic之后,KLF10的表达显著下降(P<0.01);而在转染miR-10b inhibitor后,KLF10的表达明显增加(P<0.01),见图4B、C。为了进一步验证KLF10是否为miR-10b的直接作用靶点,在pGL3载体中克隆入KLF10 3’-UTR的野生型和突变型,结果显示,在共转染pGL3-KLF10野生型质粒与miR-10b前体质粒时,萤光强度被明显抑制(P<0.01);而与miR-10b结合区域被突变后,萤光强度与正常水平类似,见图4D。这些结果提示miR-10b可直接作用于KLF10并抑制其表达。
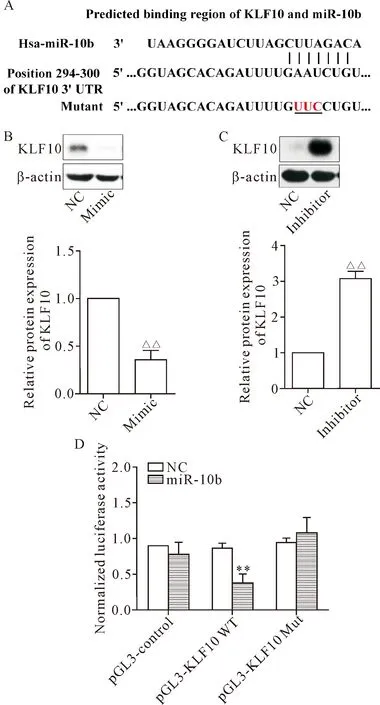
Figure 4.miR-10b directly targeted KLF10 mRNA and negatively regulated its expression. A: schematic representation of KLF 3’-UTR showing putative miR-10b binding site; B and C: miR-10b mimic inhibited KLF10 expression, whereas inhibitor augmented KLF10 expression; D: relative luciferase activity of KLF10-WT and KLF10-mutant. Mean±SD.n=3.△△P<0.01vsNC group.
图4 miR-10b直接作用于KLF10并抑制其表达
5 KLF10过表达抑制高糖诱导的肾小管上皮细胞EMT
为研究KLF10对肾小管上皮细胞EMT的直接作用,用KLF10过表达质粒转染HK-2细胞,24 h后再用高糖刺激48 h,分析KLF10对EMT的影响,结果显示,KLF10过表达可以逆转由高糖诱导的HK-2细胞的形态学改变,见图5A,并显著抑制fibronectin、SLUG、N-cadherin和SNAI1的表达(P<0.01),见图5B。这些结果提示KLF10过表达抑制肾小管上皮细胞的EMT。
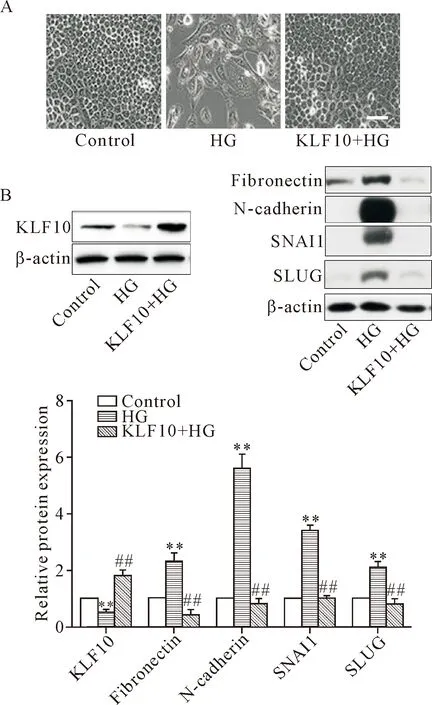
Figure 5.KLF10 over-expression reversed high glucose-induced EMT in HK-2 cells. A: the morphological changes of HK-2 cells were examined by microscope (scale bar=20 μm); B: the expression levels of EMT markers were detected by Western blot. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsHG group.
图5 过表达KLF10可以逆转高糖刺激诱导的HK2细胞EMT
6 KLF10过表达抑制TGF-β/Smad3激活
Western blot结果显示,高糖可诱导TGF-β/Smad3通路激活,而KLF10过表达抑制高糖诱导的TGF-β/Smad3通路激活(P<0.01),见图6A,该结果与图5结果共同说明KLF10通过抑制TGF-β/Smad3信号通路,抑制肾小管上皮细胞EMT。接下来,进一步研究miR-10b对EMT的促进作用是否由KLF10/TGF-β/Smad3通路所介导,直接在HK-2细胞中转染miR-10b mimic可显著增强TGF-β/Smad3通路活性,而KLF10过表达可逆转miR-10b的作用(P<0.01),见图6B。以上结果共同说明miR-10b促进高糖诱导的肾小管上皮细胞EMT的作用是通过KLF10/TGF-β/Smad3信号通路介导的。

Figure 6.KLF10 over-expression inhibited EMT by suppression of TGF-β/Smad3 signaling pathway. A: KLF10 over-expression reversed high glucose-stimulated TGF-β/Smad3 activation; B: KLF10 over-expression inhibited miR-10 mimic-induced TGF-β/Smad3 activation. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsNC group;△△P<0.01vsmiR-10b mimic group.
图6 KLF10过表达通过抑制TGF-β/Smad3信号通路逆转EMT
讨 论
研究表明肾小管上皮细胞EMT在肾纤维化过程中扮演着重要的角色[16],除此之外,众多研究者在多种模型中也发现抑制EMT可以有效减轻肾纤维化的发生[17-19]。这些研究背景从不同层面表明了EMT在肾纤维化过程中的重要性。在这些研究中,miRNAs在EMT事件中所扮演的角色一直受到人们的关注。本研究发现在高糖诱导的HK-2细胞纤维化过程中miR-10b表达上调,且抑制miR-10b能部分抑制高糖诱导的HK-2细胞纤维化。进一步研究发现KLF10是miR-10参与高糖诱导的HK-2细胞纤维化过程中的直接靶点,miR-10b是通过下调KLF10来完成促进高糖诱导的HK2细胞纤维化的。KLF10是一个含有锌指蛋白结构域的转录因子,TGF-β是它一个早期应答基因[20]。大量研究表明TGF-β/Smad3在肾纤维化的EMT中扮演着重要的角色[20-22]。因此本研究探讨KLF10是否通过TGF-β/Smad3通路影响肾小管上皮细胞EMT。我们发现miR-10b可以通过抑制KLF10的表达从而促进EMT进程;同时,miR-10b表达也促进TGF-β/Smad3的激活。同样在肺癌细胞A549的研究中表明KLF10可以通过占据促EMT转录因子SLUG启动子中的GC高含量区域,从而抑制HDAC1的招募导致SLUG的下调表达,这些事件协同作用阻碍了EMT的进程[23]。与此结果一致,在本研究中,我们发现KLF10的上调表达可以抑制包括SLUG在内的一些促EMT转录因子的表达,同时也可抑制EMT的发生。除此之外,KLF10的高表达也可以抑制促EMT转录因子SNAI1的表达。但是KLF10是通过何种作用机制使得它们的表达受到影响还需要我们进一步证明。总而言之,我们的结果证明了KLF10是miR-10b介导的EMT事件中不可缺少的一环。
综上所述,我们的研究表明miR-10b可通过直接抑制KLF10的表达从而促进高糖刺激的肾小管上皮EMT。miR-10b在糖尿病肾病肾纤维化的诊断与治疗中有望成为一个有潜力的候选靶点。
