囊性纤维化跨膜转导调节因子对低氧诱导的心肌H9c2细胞凋亡的影响*
2019-07-30郭青榜冯文化
郭青榜, 冯文化, 张 钊
(南阳市中心医院特需二科, 河南 南阳 473000)
囊性纤维化跨膜转导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)是一种cAMP激活的ATP门控氯离子通道,是ATP结合蛋白家族成员[1]。CFTR基因突变可导致囊性纤维化的产生,主要表现为呼吸道和胃肠道等上皮细胞氯通道功能异常[2]。除了广泛分布于胃、肠和呼吸道等上皮细胞外,在哺乳动物的心肌细胞和平滑肌细胞也发现CFTR的丰富表达[3-4],同时CFTR还参与到一系列心血管疾病的发病过程中,比如血管平滑肌的收缩[5]和心肌细胞动作电位的形成[6]。CFTR基因敲除小鼠可观察到心脏功能的异常[5, 7]。随着CFTR在心血管疾病中研究的深入,它的一些新功能被进一步揭示,例如最近在CFTR基因敲除小鼠研究中发现CFTR参与了缺血预处理对缺血再灌注损伤心肌的保护作用,这可能与其抑制心肌细胞凋亡的作用相关[8];同时,囊性纤维化患者较常人也更容易发生心肌细胞死亡[9]。但是,这些变化是由于CFTR的广泛缺失所造成还是直接由心肌细胞中CFTR的功能缺陷所导致却依然未知。因此,CFTR在心血管疾病中的病理生理作用仍有待全面阐述。
为此,本文利用专业缺氧工作站使大鼠心肌 H9c2细胞暴露于1% 氧含量环境中建立低氧模型,探究CFTR在低氧环境中对心肌细胞凋亡的直接影响。
材 料 和 方 法
1 实验材料
大鼠心肌 H9c2细胞购自中国武汉典型培养物保藏中心。胎牛血清、DMEM-F12培养基和Opti-MEM培养基购自Gibco;Lipofectamine 3000、MTT试剂、BCA试剂盒、抗β-actin抗体和辣根过氧化物酶标记山羊抗小鼠IgG(H+L)购自江苏碧云天公司;Annexin V-FITC/PI细胞凋亡试剂盒购自江苏凯基生物公司;Hoechst 33342、RNA定量试剂盒和ReverseAid 逆转录酶购自Thermo Fisher Scientific;CFTR过表达质粒购自GeneCopoeia;CFTR特异性抑制剂CFTRinh-172购自Selleck; DMSO和dNTP Mix购自Sigma-Aldrich;ROS检测试剂盒购自Abcam;TRIzol试剂盒购自Life Technologies;SuperReal PreMix试剂盒购自Tiangen;抗CFTR抗体购自Santa Cruz。
2 实验方法
2.1细胞培养和低氧细胞模型的建立 大鼠心肌H9c2细胞生长在有10%胎牛血清的DMEM-F12培养基中,置于5% CO2、95%相对湿度、37 ℃恒温密闭式培养箱(Thermo 3111)内培养。取对数期细胞,在专业缺氧工作站(Coy LABORATORY PRODUCTS)中给予低氧(1% O2、5% CO2、其余以氮气填充)处理12 h后,建立低氧细胞模型。
2.2细胞转染实验 大鼠心肌H9c2细胞以每孔5×105个细胞接种于6孔板中,待细胞融合至80%左右时,更换无血清培养基,按照Lipofectamine 3000说明书进行转染CFTR过表达质粒。取100 μL无血清 Opti-MEM培养基加入6 μL Lipofectamine 3000,混匀,室温孵育5 min;取100 μL无血清 Opti-MEM培养基中加入4 μg CFTR过表达质粒,之后加入4 μL Lipofectamine 3000,充分混匀,室温孵育5 min;把二者混合,室温孵育20 min后,把混合物加入到细胞,与细胞共孵育6 h,去除培养基,更换含10%胎牛血清的DMEM-F12培养基继续培养48 h。此细胞经检测转染效率后,用于后续实验。
2.3细胞CFTR特异性抑制剂CFTRinh-172的处理 20 μmol/L CFTR特异性抑制剂CFTRinh-172处理大鼠心肌H9c2细胞12 h,此细胞用于后续实验。
2.4MTT实验检测细胞活力 细胞处于对数生长期时,每孔5×103个细胞接种于96孔板中,经相应处理后,每孔中加入10 μL MTT溶液(5 g/L,溶剂为PBS缓冲液),反应4 h后,去除培养基,每孔加入100 μL DMSO溶液,振荡混匀后,利用多功能酶标仪(Synergy H1)在570 nm处检测各孔吸光度(A)值。
2.5Hoechst 33342染色法检测细胞凋亡 以每孔2×104个细胞接种于24孔板中,给予相应处理后,在细胞培养基中加入终浓度为50 mg/L的Hoechst 33342溶液染色,30 min后用PBS洗3次,每次5 min,以除去残余染料。染色结束后用荧光显微镜(Olympus BX53)进行拍照以观察细胞凋亡情况。
2.6Annexin V-FITC/PI双染色法检测细胞凋亡 以每孔5×105个细胞接种于6孔板中,给予相应处理后,按照Annexin V-FITC /PI细胞凋亡试剂盒说明书操作步骤,室温1 000 ×g离心5 min收集细胞,PBS重悬细胞2次,然后每个样品中加入500 μL 试剂盒自带的结合缓冲液用来制备细胞悬液。加入 5 μL Annexin V-FITC试剂室温避光孵育10 min,再加入5 μL碘化丙啶试剂室温避光孵育10 min,流式细胞仪(Beckman Cytomics FC 500)读取激发波长488 nm和发射波长530 nm处的荧光强度,并采用FlowJo V.7.6.2软件分析其凋亡率。
2.7DCF-DA探针检测细胞内活性氧簇(reactive oxygen species,ROS)的生成 以每孔1×104个细胞接种于48孔板中分组处理,利用不含EDTA的胰蛋白酶消化收集细胞。400×g离心5 min后弃去上清,之后根据ROS检测试剂盒说明书进行细胞内ROS检测。DCF染色30 min结束后,用荧光显微镜(Olympus BX53)进行细胞内ROS检测和数据分析。
2.8总RNA提取及RT-qPCR检测CFTR 的mRNA表达水平 以每孔5×105个细胞接种于6孔板中给予相应处理后,去除培养基,使用PBS洗细胞3次。然后按照TRIzol试剂盒说明书操作提取细胞总RNA。提取的总RNA以DEPC水溶解后,按照RNA定量试剂盒说明书使用Qubit 2.0荧光计进行RNA浓度定量。以1 μg总RNA进行逆转录反应(总体系为20 μL),具体步骤如下:每个样品管中加入1 μg总RNA和50 μmol/L(1 μL)Oligo dT混合均匀后,加DEPC水至13 μL混匀后65 ℃反应5 min,随后冷却至4 ℃,然后分别依次加入4 μL 反应缓冲液,2 μL dNTP Mix和1 μL ReverseAid 逆转录酶,充分混匀,42 ℃ 60 min、70 ℃ 10 min逆转录为cDNA。逆转录完成后按照SuperReal PreMix试剂盒说明书进行实时荧光定量PCR(反应体系为10 μL)。CFTR正向引物为5’-ATGTGAAGCACGGAGACTGA-3’,CFTR反向引物为5’-CTAGGGTCCAGAGACACACCC-3’;Actb正向引物为5’-GCAGGAGTACGATGAGTCCG-3’,Actb反向引物为5’-ACGCAGCTCAGTAACAGTCC-3’。设置参数:95 ℃ 15 min; 95 ℃ 10 s、62 ℃ 30 s、72 ℃ 30 s,共40个循环,最后缓慢升温至95 ℃。以Actb为内参照,采用2-ΔΔCt法分析CFTR的mRNA相对水平。
2.9Western blot检测相关蛋白表达 以每孔5×105个细胞接种于6孔板中给予相应处理后,去除培养基,使用PBS洗细胞3次,加入蛋白裂解液,萃取总蛋白。总蛋白以BCA试剂盒定量后,进行SDS-PAGE。依次经过电泳、电转、封膜后,加入稀释比例为1∶1 000的CFTR抗体和稀释比例为1∶5 000的β-actin抗体,4 ℃孵育过夜,洗膜3次,加入稀释比例为1∶2 000的辣根过氧化物酶标记的山羊抗小鼠IgG(H+L),室温孵育1 h,洗膜3次,暗室ECL化学发光曝光显影,以β-actin为内参照,Image Pro Plus软件扫描CFTR灰度值。
3 统计学处理
所有数据均使用Graphpad Prism 6 软件进行分析。实验结果表述为均数±标准差(mean±SD)。对于两组资料比较采用双侧t检验,多组资料中数据比较采用单因素方差分析(one-way ANOVA)方法后行SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 低氧抑制H9c2细胞CFTR的表达
相对于正常氧培养组,H9c2细胞在给予低氧(1%氧气含量)处理12 h后,CFTR mRNA和蛋白表达水平均显著降低(P<0.05),见图1。
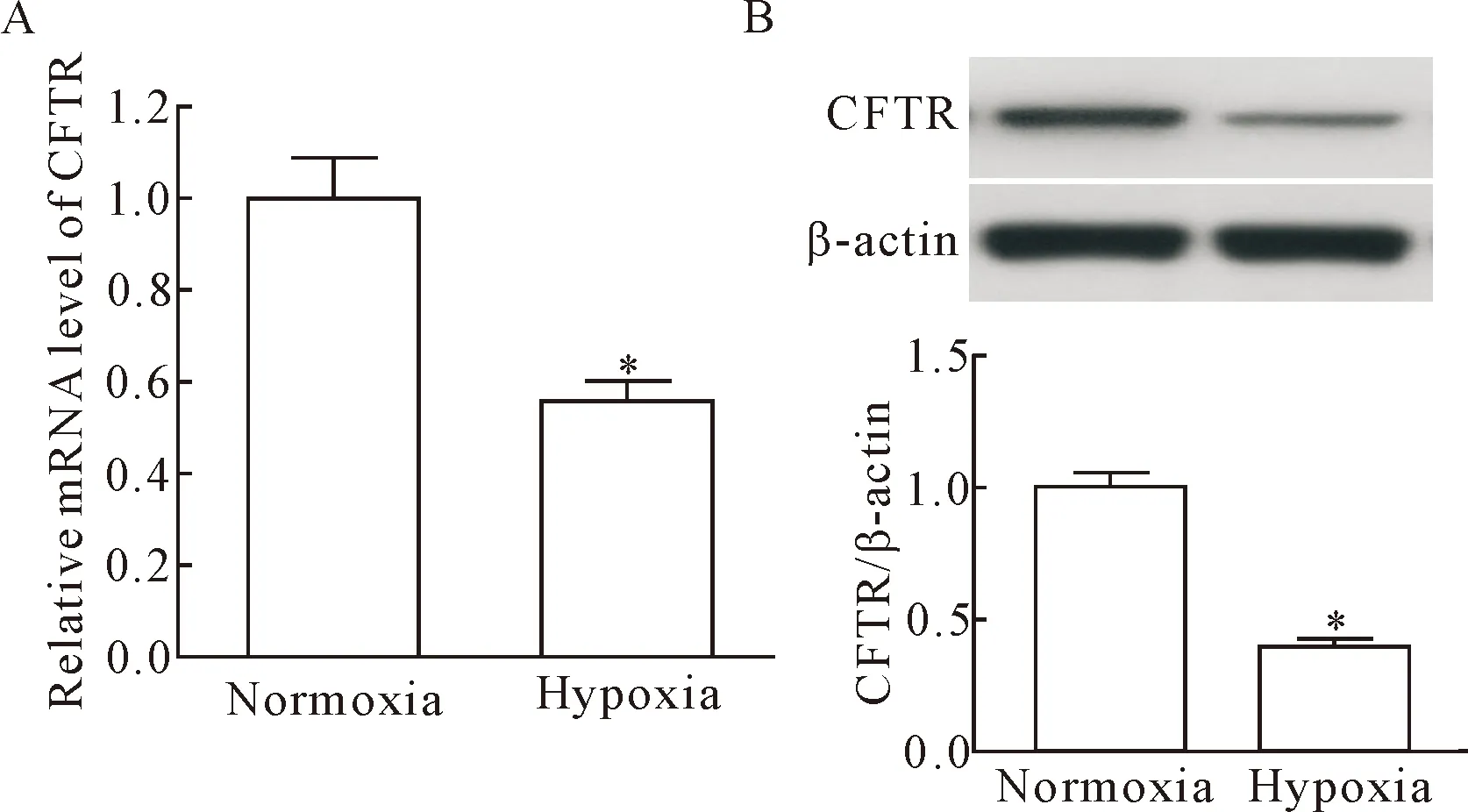
Figure 1.Hypoxia treatment induced significantly down-regulated mRNA and protein level of CFTR in H9c2 cardiomyocytes. A: the mRNA level of CFTR was examined by RT-qPCR; B: the protein level of CFTR was examined by Western blot. Mean±SD.n=3.*P<0.05vsnormoxia group.
图1 低氧处理促使心肌H9c2细胞CFTR的mRNA和蛋白水平显著下调
2 低氧处理抑制心肌H9c2细胞的活力并促使其凋亡
MTT结果显示,相对于正常氧培养组,心肌 H9c2细胞在给予低氧(1%氧气含量)处理12 h后,细胞活力显著下降(P<0.05),见图2A;Hoechst 33342染色结果显示:正常氧培养组细胞核着色后呈现为圆形,且为均一蓝色;低氧组细胞核DNA因固缩而被致密浓染呈现为亮蓝色(见箭头所示),且统计分析显示,低氧促使细胞凋亡(P<0.05),见图2B;同时,Annexin V-FITC/PI染色结果显示,低氧组早期凋亡细胞数和晚期凋亡细胞数均显著增加(P<0.05),见图2C。
3 过表达CFTR或CFTR inh-172刺激对CFTR表达的影响
进一步对心肌 H9c2细胞转染CFTR过表达质粒或给予CFTR特异性抑制剂CFTRinh-172刺激后构建低氧模型,观察CFTR mRNA和蛋白水平,结果显示,转染CFTR过表达质粒后,CFTR的mRNA和蛋白水平均显著增加(P<0.05);且过表达CFTR能逆转低氧诱导的CFTR的mRNA和蛋白水平的降低(P<0.05);在低氧环境下,CFTR-inh-172能降低过表达CFTR心肌H9c2细胞CFTR的mRNA和蛋白水平(P<0.05),见图3。
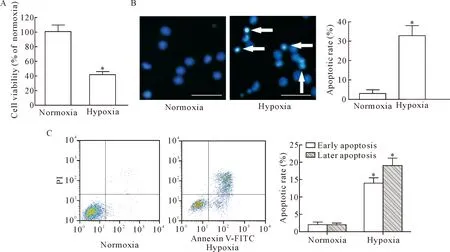
Figure 2.Hypoxia treatment inhibited the viability and promoted apoptosis of H9c2 cardiomyocytes. A: cell viability was measured by MTT assay; B and C: the apoptosis was were determined by Hoechst 33342 and Annexin V-FITC/PI staining. The scale bars=50 μm. Mean±SD.n=3.*P<0.05vsnormoxia group.
图2 低氧处理抑制心肌 H9c2细胞活力并促使其凋亡
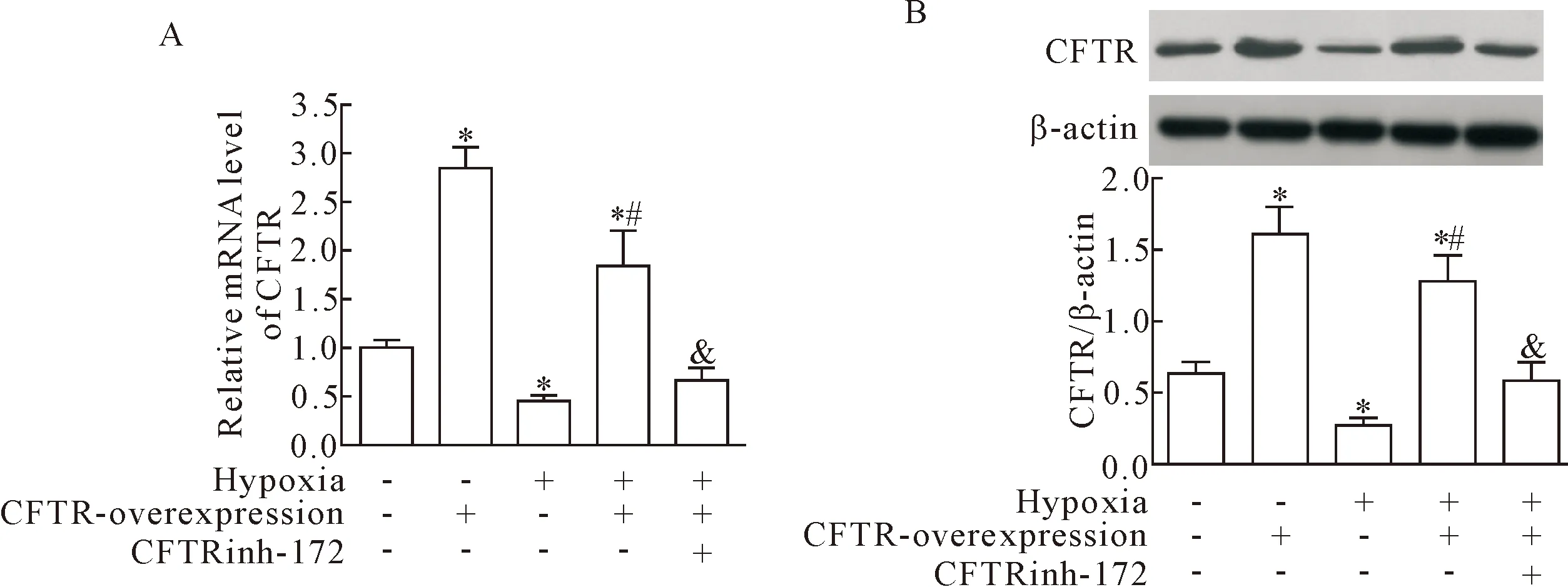
Figure 3.Effect of CFTR overexpression or CFTRinh-172(CFTR specific inhibitor) on the mRNA and protein level of CFTR in H9c2 cardiomyocytes treated with hypoxia. A: the mRNA level of CFTR was examined by RT-qPCR; B: the protein level of CFTR was examined by Western blot. Mean±SD.n=3.*P<0.05vsnormoxia group;#P<0.05vshypoxia group;&P<0.05vshypoxia +CFTR-overexpression group.
图3 过表达CFTR或CFTR特异性抑制剂CFTRinh-172对低氧处理的心肌H9c2细胞CFTR mRNA和蛋白水平的影响
4 CFTR拮抗低氧诱导的心肌 H9c2细胞损伤
在低氧环境下,进一步观察过表达CFTR或CFTR特异性抑制剂CFTRinh-172对心肌 H9c2细胞活力和凋亡的改变。MTT结果显示,CFTR过表达能升高低氧抑制的细胞活力(P<0.05),CFTRinh-172抑制CFTR过表达诱导的细胞活力增加(P<0.05),见图4A。同时Hoechst 33342染色结果显示,CFTR过表达能抑制低氧诱导的细胞凋亡(P<0.05),CFTRinh-172则能逆转CFTR过表达的作用(P<0.05),见图4B。进一步采用Annexin V-FITC/PI 检测细胞凋亡,结果显示在常氧环境下,各组细胞凋亡率差异无统计学意义(P>0.05);在低氧环境下,CFTR过表达能抑制低氧诱导的细胞凋亡(P<0.05),CFTRinh-172处理能进一步加剧低氧诱导的细胞凋亡(P<0.05),CFTR过表达与CFTRinh-172联合组细胞凋亡率较CFTR过表达组升高(P<0.05),见图5。
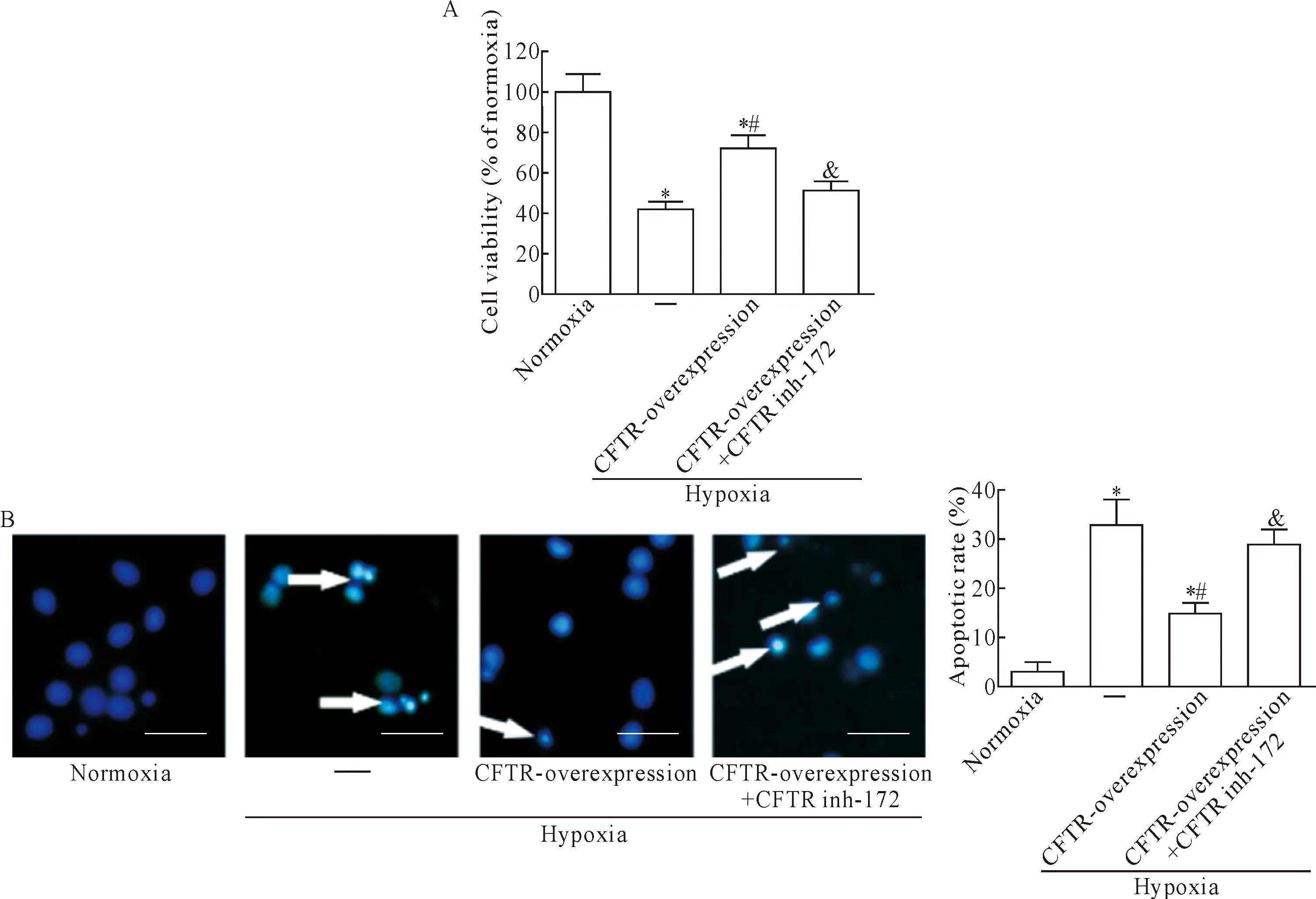
Figure 4.CFTR over-expression antagonizes the injury of H9c2 cardiomyocytes induced by hypoxia. A: cell viability was measured by MTT assay; B: the apoptotic rate was determined by Hoechst 33342 staining. The scale bar=50 μm. Mean±SD.n=4.*P<0.05vsnormoxia group;#P<0.05vshypoxia group;&P<0.05vshypoxia+CFTR-overexpression group.
图4 CFTR过表达拮抗低氧诱导的心肌H9c2细胞损伤
5 CFTR拮抗低氧诱导的心肌 H9c2细胞ROS的生成
DCF-DA探针检测细胞内活性氧(ROS)的结果显示,在常氧环境下,CFTR过表达或者CFTRinh-172并不影响ROS生成(P>0.05);但低氧能促使心肌 H9c2细胞ROS的生成(P<0.05);CFTR过表达可降低低氧诱导的心肌 H9c2细胞ROS的生成(P<0.05);CFTRinh-172可进一步升高低氧环境下ROS的生成(P<0.05),CFTR过表达与CFTRinh-172联合组ROS生成量较CFTR过表达组升高(P<0.05),见图6。以上结果提示CFTR拮抗低氧诱导的心肌 H9c2细胞损伤作用可能与抑制ROS生成相关。
讨 论
低氧及其内在调控机制在心血管疾病的生理过程中发挥着重要作用,比如:健康心脏以脂肪酸氧化为优先供能模式,但是功能异常的心肌细胞主要以葡萄糖代谢为主,这其中低氧是主要诱发因素[10],同时低氧也可以影响线粒体生成以及心肌细胞收缩性。因此,研究心肌细胞是如何应对低氧环境应激的对于解决心血管疾病具有重要意义。本研究使心肌 H9c2细胞直接暴露于1%氧气含量的低氧环境,观察CFTR对低氧损伤H9c2细胞的影响。本研究发现CFTR拮抗低氧诱导的心肌 H9c2细胞损伤,对细胞起保护作用。
接下来,我们对CFTR对心肌细胞的保护作用机制进行了探索。由于在脑血管平滑肌、肠道和肺部等细胞和神经元中发现CFTR的蛋白功能失常可引起线粒体氧化应激[11-14]。我们研究发现,CFTR过表达部分逆转低氧诱导心肌 H9c2细胞ROS的生成,因此我们推测CFTR拮抗低氧对心肌 H9c2细胞的损伤作用可能与抑制ROS生成相关。另外,我们还发现在低氧环境中即使恢复CFTR的表达也不能使细胞凋亡完全逆转,这说明缺氧诱导的细胞凋亡还存在其它非CFTR依赖的机制。比如有研究发现,低氧可以抑制miR-532-5p,miR-499-5p等微小RNA的表达从而使其靶基因程序性细胞凋亡因子-4上调,促进心肌细胞凋亡[15-17]。
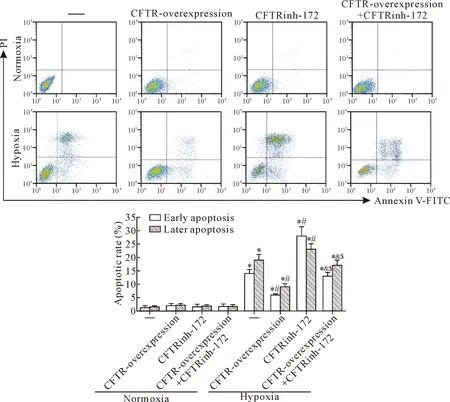
Figure 5.CFTR over-expression antagonizes the apoptosis of H9c2 cardiomyocytes induced by hypoxia. Mean±SD.n=3.*P<0.05vsnormoxia group;#P<0.05vshypoxia group;&P<0.05vshypoxia +CFTR-overexpression group;$P<0.05vshypoxia +CFTRinh-172 group.
图5 CFTR过表达拮抗低氧诱导的心肌 H9c2细胞凋亡
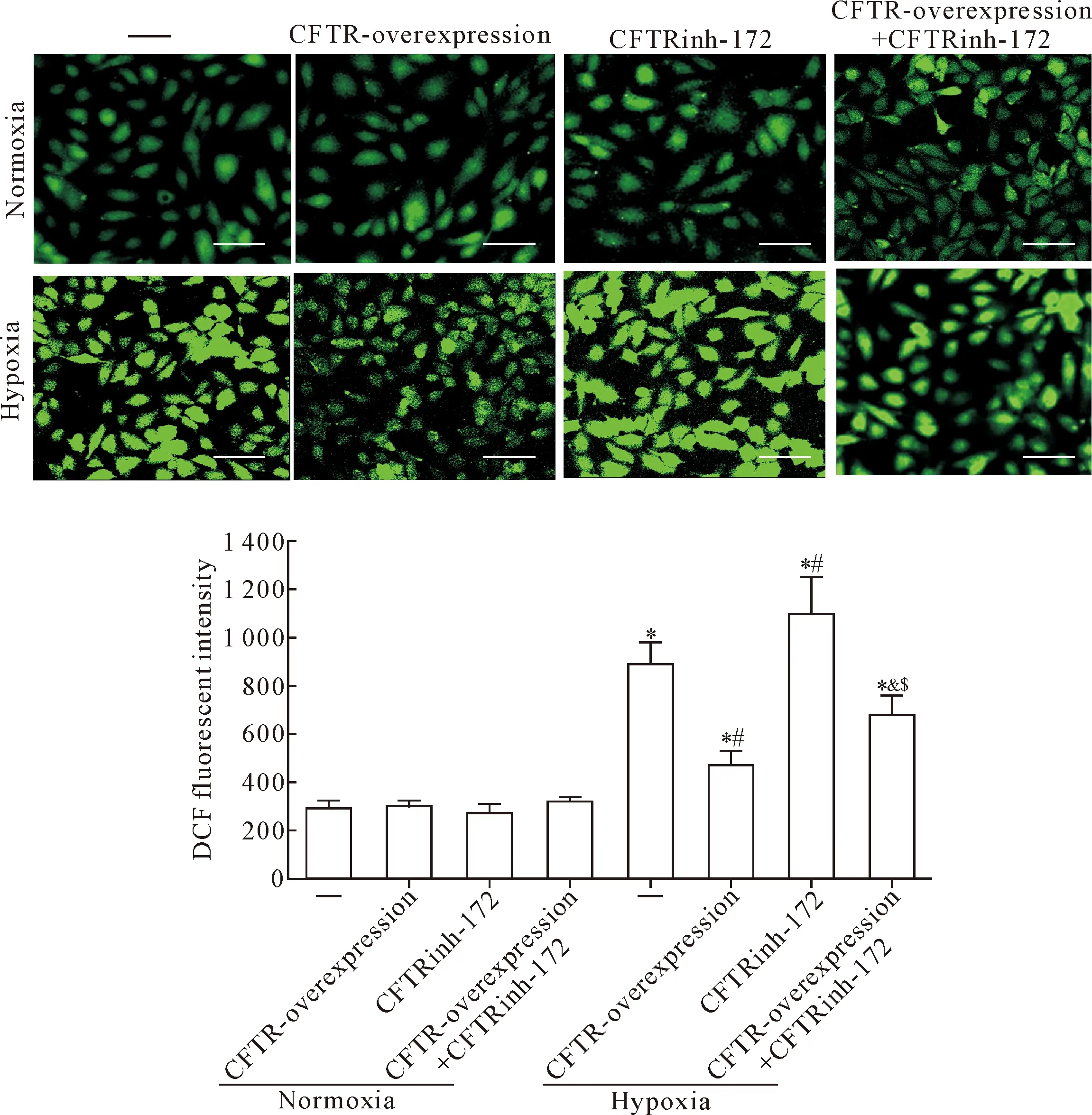
Figure 6.CFTR antagonizes the production of ROS of H9c2 cardiomyocytes induced by hypoxia. The scale bar=50 μm. Mean±SD.n=4.*P<0.05vsnormoxia group;#P<0.05vshypoxia group;&P<0.05vshypoxia+CFTR-overexpression group;$P<0.05vshypoxia +CFTRinh-172 group.
图6 CFTR拮抗低氧诱导的心肌 H9c2细胞ROS的生成
低氧如何诱导CFTR表达下调的机制研究还需要进一步完善。虽然已有研究暗示一些启动子和转录因子的结合在某些方面促进了CFTR的基因表达,但是这并不能充分解释CFTR的组织特异性表达调控过程[15]。另外,心肌原代细胞在特定功能和表型上还与心肌 H9c2细胞具有一定的差异;还有CFTR在心肌原代细胞和整体动物上是否也能表现相似的生物学功能,都将是我们下步研究的重点。
综上所述,目前我们的研究结果提示CFTR可作为心肌缺血等低氧相关性心血管疾病的潜在治疗靶标,但具体作用机制仍有待进一步阐明。
