肺炎支原体感染猪模型的建立及相关指标分析
2019-07-29倪黎纲王宵燕吴信生赵旭庭
倪黎纲,王宵燕,吴信生,赵旭庭,陶 勇
(1.扬州大学 动物科学与技术学院,江苏扬州 225009; 2. 江苏农牧科技职业学院,江苏泰州 225300)
猪支原体肺炎(Mycoplasmal pneumonia of Swine, MPS)又称为猪气喘病,该病以高度传染性、高发病率、慢性和低死亡率为特点[1],感染猪主要表现为咳嗽、气喘、食欲减退、呼吸困难、生长速度缓慢和饲料转化率降低等[2],该病广泛流行于世界养猪业,在养猪业发达的国家也普遍存在,对养猪业造成严重的经济损失。不同品种猪对猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)的感染率不同,中国高繁殖力的地方猪种易感性比外来品种强,如姜曲海猪和梅山猪[3]。目前,研究发现不同猪种对肺炎支原体的易感性在机体本身的分子基础方面存在差异,一些免疫相关分子基因的变异及其表达差异与肺炎支原体易感性相关,这些免疫相关分子基因包括 Toll 样受体2(Toll like receptor2,TLR 2)、Toll 样受体4(Toll like receptor4,TLR 4)、白细胞介素2(Interleukin2,IL-2)、白细胞介素4(Interleukin4,IL-4)、白细胞介素6(Interleukin6,IL-6)、白细胞介素1β(Interleukin1beta,IL-1β)、CXC 趋化因子配体6(C-X-C Motif Chemokine Ligand6,CXCL 6)和 CXC 趋化因子配体8(C-X-C Motif Chemokine Ligand8,CXCL 8)[4-6]。然而,免疫相关分子的作用机理还知之甚少,需要进一步研究和探索。
感染模型是研究致病机制的基础,邵国青等[7]采用不同剂量猪肺炎支原体强毒株人工感染小梅山二元杂交猪,根据典型气喘病临床症状和肺部病变特征,开展猪气喘病发病模型的研究,确定猪发病的人工感染剂量。其他有关猪气喘病发病模型研究未见报道。杂交猪有着亲本双方不同的遗传背景,是研究品种间遗传差异较好的试验动物。本试验以对猪肺炎支原体易感的姜曲海猪和相对耐受的杜洛克猪的杂交一代[F1(杜洛克×姜曲海)猪]为参试动物,通过人工感染肺炎支原体,研究试验猪的临床病理特征和免疫抗体变化,并探索猪肺炎支原体对免疫相关分子基因表达的影响,建立较为完整的肺炎支原体感染猪模型,为进一步探索中外猪种肺炎支原体致病机制的差异和筛选抗病育种分子标记奠定基础。
1 材料与方法
1.1 毒株与主要试剂
Mhp Js强毒株由江苏省农业科学院兽医研究所提供;猪IgG检测试剂盒购自上海岚派生物科技有限公司;爱德士 (IDEXX) 猪肺炎支原体抗体检测试剂盒购自扬州科能生物科技有限公司;RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒均购自天根生化科技(北京)有限 公司。
1.2 试验动物
健康F1(杜洛克×姜曲海)试验猪16头,由江苏姜曲海种猪场(江苏泰州)提供,所有试验猪均未注射肺炎支原体疫苗,RT-PCR(PCR)检测猪繁殖与呼吸综合征病毒(PRRSV)和猪肺炎支原体病原(Mhp)均为阴性。
1.3 致病性试验
试验猪50日龄时,随机分成感染组和阴性对照组。强毒株致病性试验毒株剂量参照文献[7](强毒株冻干物1∶100 稀释液),5 mL直接注入猪气管中,固定猪头部2~5 min,以免注射物被咳出,阴性对照试验猪气管注射5 mL无菌生理盐水。试验过程中所用饲料无抗生素添加。
1.4 称体质量、临床评价、血清抗体和 IgG 检测
试验猪接种肺炎支原体强毒株后,所有试验猪在第0、10、20、30、40天的清晨空腹称体质量,比较增量情况。称体质量的同时采集血液,分离血清,-20 ℃冷冻保存,采用 ELISA 方法参照试剂盒说明书检测猪肺炎支原体抗体和 IgG 水平。试验期间,每2 d观察1 次猪的临床症状,观察时间15 min,包括一般健康状况,食欲和咳嗽等。
1.5 肺组织病理检查
在试验结束(40 d)时屠宰所有试验猪,分离肺脏,进行病理检查并进行肺组织病变评分,评分标准和方法参照文献[8-9]。然后无菌采集脾、肺和气管组织样品,立即放入液氮中,转移到 -70 ℃冷冻保存。
1.6 脾、肺和气管组织免疫相关分子基因转录检测
取采集的脾、肺和气管组织样品,液氮研磨,按照 Trizol 试剂提取说明书提取总RNA,RNA 质量浓度和纯度通过分光光度计测定。按照反转录试剂盒说明书,采用两步法合成 cDNA 第一链,-20 ℃冷冻保存。根据 GenBank 中猪IL-1β、TLR 4、IL-4、IL-2的基因序列和GAPDH基因序列设计定量 PCR 引物(表1),采用荧光定量 PCR 检测免疫相关分子基因的转录水平,结果采用2-ΔΔCt法进行分析处理。

表1 荧光定量PCR引物序列Table 1 Real-Time PCR primer sequences
1.7 数据统计与分析
所有数据采用 SPSS 17.0 软件进行统计,采用t检验进行显著性分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 试验猪临床症状
试验猪接种肺炎支原体强毒株9 d后,感染组猪群中有1 头表现出间断性轻微咳嗽,随后感染组猪群中其他试验猪逐渐表现轻微的咳嗽病状;试验16 d后,有2头表现严重的腹式呼吸,咳嗽加剧,其他均只出现咳嗽、食欲下降等症状;试验22 d后,所有感染组猪均出现明显的支原体肺炎临床症状,表现为严重的腹式呼吸。整个试验期,对照组猪均未出现咳嗽、食欲减退、精神萎靡等支原体肺炎临床症状。
2.2 猪体质量和日增量变化
整个试验期,感染组猪群生长速度逐渐减慢(图1)。试验30 d后,感染组猪群的体质量极显著低于对照组猪群 (P<0.01)。在整个试验期,感染组猪群的平均日增量极显著低于对照组 (P<0.01)(表2),提示肺炎支原体感染对猪的生长影响较大。
2.3 肺组织病理检查
试验猪剖解后肉眼观察,肺炎支原体感染猪的肺脏心叶、尖叶、中间叶和隔叶边缘均出现不同程度的暗红色肉变(图2),支气管和纵膈淋巴结稍有肿大,其他内脏器官无明显变化。肺组织病变评分结果见表2,感染组的肺组织病变评分主要集中在16~22这个中间类群,表现出较为严重的肺组织病变;对照组的肺组织病变评分集中在0~15类群,未表现肺组织病变。

A. 感染组 Infection group;B.对照组 Control group; “**”表示在同一时间两组数据之间存在极显著差异 (P<0.01),图3和图4同 “**” difference between two sets of data at the same time at the level ofP<0.01, the same as in Fig.3 and Fig.4
图1 试验猪的平均体质量
Fig.1 Average body mass of experimental pigs

A. 对照健康猪肺脏 Lung tissue of the control healthy pig;B. 肺炎支原体感染猪肺脏 Lung tissue of Mhp infected pig;箭头指示为病变组织 Lung pathological tissues are indicated with arrows
图2 试验猪肺脏
Fig.2 Lungs of experimental pigs

表2 试验猪试验期间的平均日增量和肺组织病变评分Table 2 Average body mass gain and pulmonary lesion score of experimental pigs
注:同列中不同大写字母表示差异极显著(P<0.01)。
Note:Different uppercase letters in same columns indicate significant difference (P<0.01).
2.4 血清抗体和IgG检测
通过对试验猪血清肺炎支原体抗体水平检测发现,感染组猪群血清肺炎支原体抗体水平逐渐上升,在试验20 d时,感染组猪群血清中肺炎支原体抗体s/p值为0.40±0.13,呈现抗体滴度阳性,试验结束(40 d)时,肺炎支原体抗体s/p值高达0.82±0.10(图3)。整个试验期,感染组猪群血清IgG质量浓度呈现上升趋势(图4),试验 20 d后,感染组猪群血清IgG质量浓度均极显著高于对照组(P<0.01)。
2.5 免疫相关分子基因表达检测
采集感染组和对照组试验猪的脾、肺、气管组织,检测IL-1β、TLR4、IL-4、IL-2mRNA的表达变化,结果见图5。结果显示,从感染组猪群的脾、肺组织中均检测到IL-1β、TLR4、IL-4、IL-2的显著表达(P<0.05),其中,感染组猪群脾组织中IL-1β、IL-4、IL-2的表达极显著高于对照组 (P<0 .01),肺组织中IL-1β的表达极显著高于对照组(P<0.01)。感染组猪群的气管组织中这4个分子基因的表达情况与对照组差异不显著 (P>0.05)。
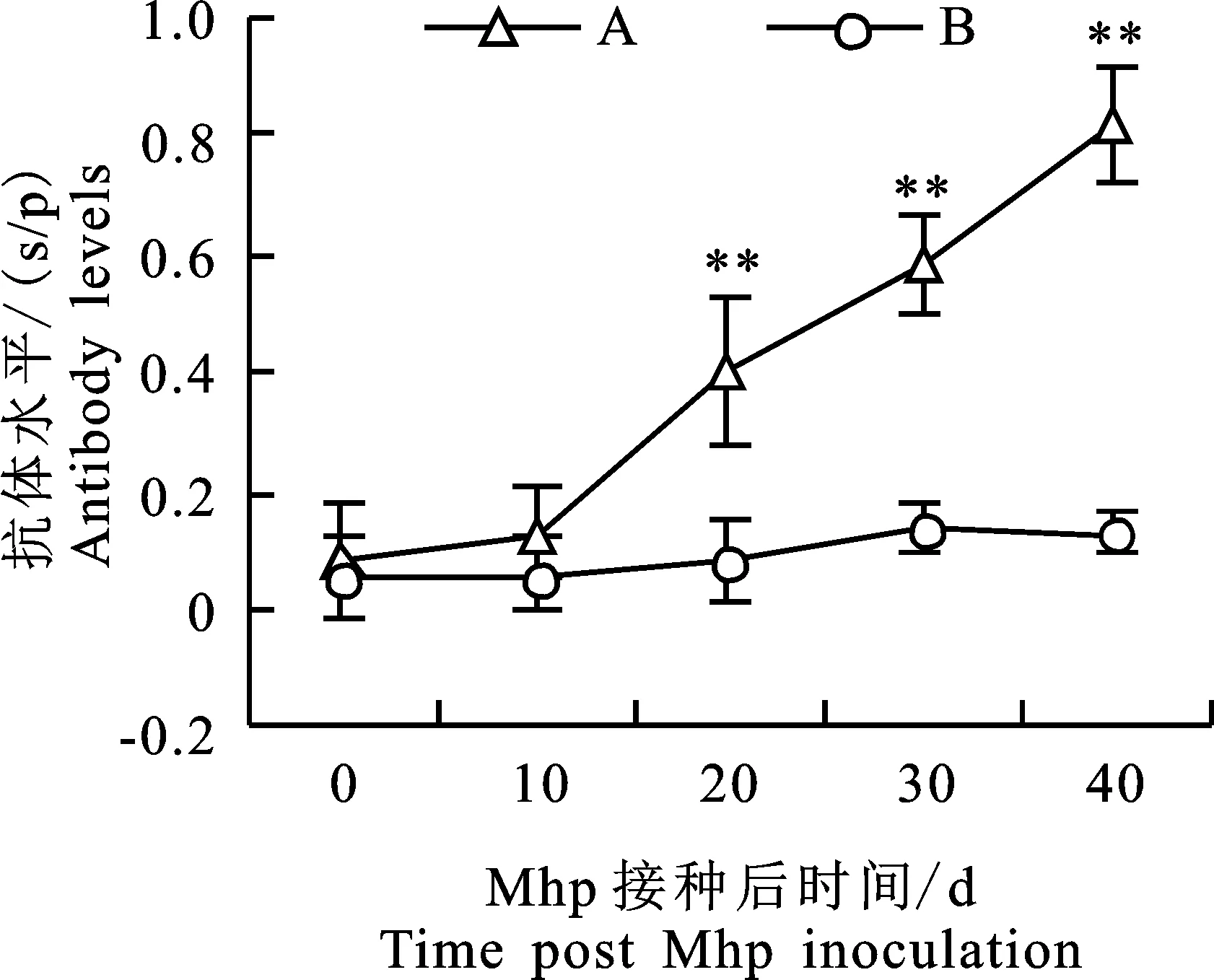
图3 试验猪血清肺炎支原体抗体水平变化Fig.3 Mhp antibody levels in serum of experimental pigs
3 讨 论
猪肺炎支原体以慢性、高发病率和低死亡率为特点[1],猪感染肺炎支原体后,主要表现为食欲减退、咳嗽、气喘、呼吸困难等症状[10]。邵国青等[7]将 Mhp Js 毒株(毒株冻干物 1∶100 稀释液)人工接种到 55~65 日龄气喘病检查阴性的小梅山二元杂交猪气管内,接种后 25 d,试验猪产生典型猪气喘病症状和肺组织病变。杜德燕等[11]给试验猪气管内接种肺炎支原体强毒株,接种 7 d 后试验猪出现咳嗽现象,接种 25 d 后观察到严重咳嗽、气喘、食欲下降等临床症状,在 25 d的攻毒观察期内,试验猪生长速度受到显著影响,肺部组织病变较为严重。在本研究中,试验猪在一定剂量肺炎支原体感染后,在试验 16 d 后出现支原体肺炎临床症状,试验 22 d 后表现出严重肺炎支原体感染的临床症状,肺炎支原体感染极显著影响猪的生长速度和肺组织病变。同时,本研究也检测到血清抗体和免疫相关分子基因表达的变化。试验结果表明成功建立F1(杜洛克×姜曲海)猪肺炎支原体感染模型。

图4 试验猪血清IgG的质量浓度Fig.4 IgG mass concentrations in serum of experimental pigs
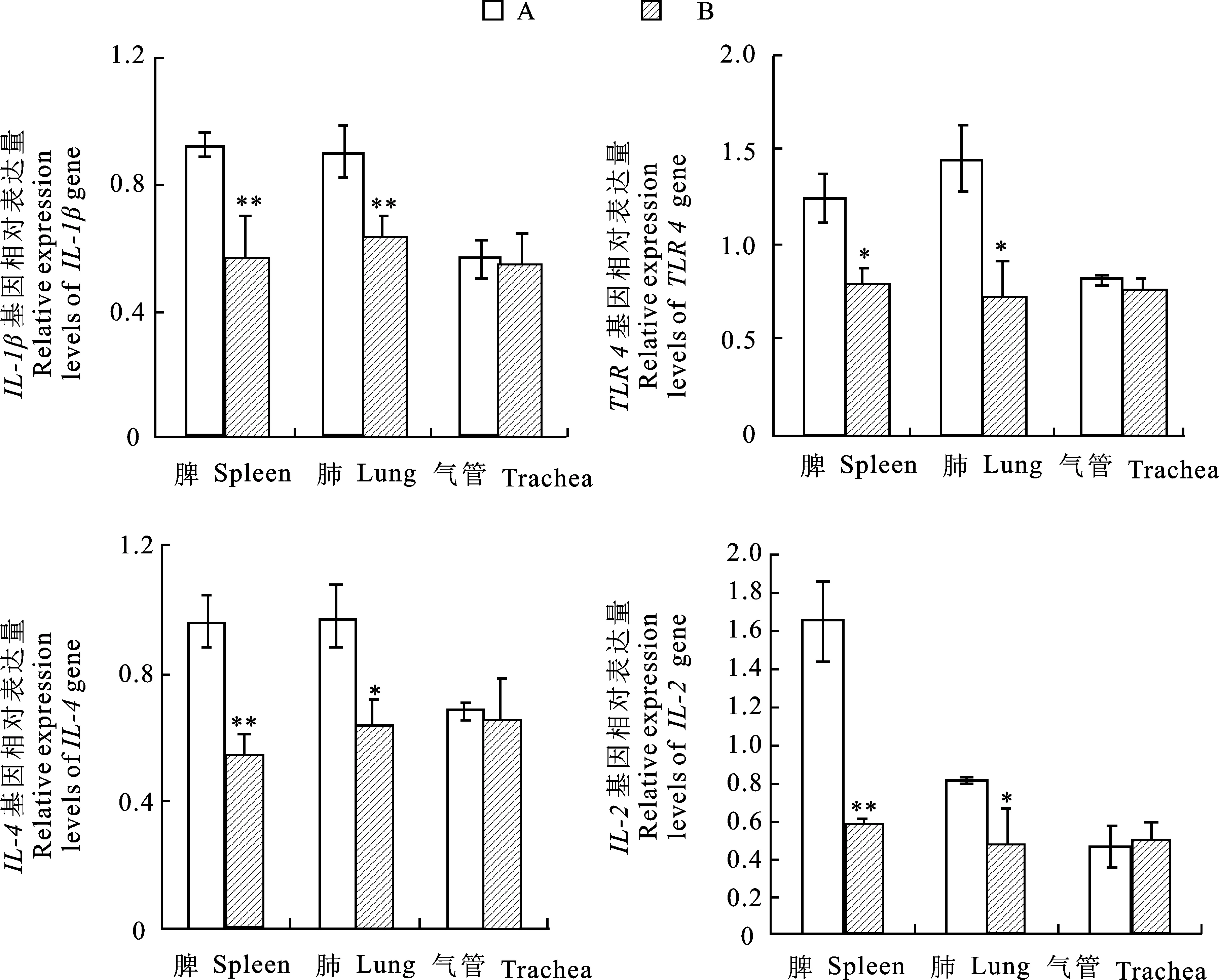
A. 感染组 Infection group;B. 对照组 Control group;“*”表示两组数据之间存在显著差异(P<0.05),“**”表示两组数据之间存在极显著差异(P<0.01) “*” the difference between two sets of data at the ofP<0.05 ,“**” difference between two sets of data at the level ofP<0.01
图5 试验猪不同组织中IL-1β、TLR4、IL-4、IL-2基因的表达量
Fig.5 Gene expression ofIL-1β,TLR4,IL-4,IL-4in different tissue samples from experimental pigs
猪肺炎支原体感染通过改变或调节宿主的免疫系统,造成病理变化,刺激宿主产生体液免疫和细胞免疫[12]。特异性抗体和 IgG 是体液免疫应答产生的主要抗体,主要由脾脏和淋巴结中的浆细胞产生,在体内广泛分布,具有重要的免疫效应,是机体抗感染的主力军[4]。Jacobs等[13]研究发现,豚鼠感染肺炎支原体后,IgG、IgA 质量浓度和特异性抗体水平会显著增加。邓均华等[14]用肺炎支原体全菌抗原肌肉注射免疫试验猪,2 周和 4 周后在试验猪血清中均检测到肺炎支原体抗体,并且肺炎支原体抗体水平与肺部感染严重程度相关。本试验检测到试验猪在感染肺炎支原体后逐渐产生抗体,并且随着持续感染,血清中肺炎支原体抗体和 IgG 质量浓度均呈现上升趋势。试验结果与已有报道基本一致,说明猪感染肺炎支原体后,机体通过免疫应答产生抗体来抵抗肺炎支原体的感染。
病原体感染动物后,感染组织及相关免疫器官和组织会通过表达相关免疫分子来调节机体免疫[15]。在免疫反应中,Toll 样受体和炎性细胞因子起到关键作用[16]。TLR 4 属于 TLR 家族,介导宿主对支原体脂蛋白的反应,并在病原体识别、信号传递和先天免疫激活中发挥作用,刺激炎症细胞因子和趋化因子的产生[5, 17]。IL-1β、IL-4、IL-2 是炎性细胞因子,在免疫器官和组织的炎症反应中发挥着重要作用[18-19]。相关文献报道,细胞因子表达与猪支原体肺炎感染相关,方晓敏等[6]研究发现,肺炎支原体强毒株刺激的猪肺部巨噬细胞TLR4、IL-1β均表现不同程度的表达上调;Borjigin 等[4]研究发现,大白猪IL-4、IL-4和IL-10基因在肺门淋巴结的表达差异与肺炎支原体肺部病变存在相关性。本研究结果表明,感染肺炎支原体试验猪的肺组织和脾组织中IL-1β、IL-4、IL-2和TLR 4表达均显著升高,表明这 4个免疫分子在抗肺炎支原体感染过程中发挥着作用,但其具体作用机制还需进一步研究与探索。
脾脏是动物最大的外周免疫器官,当动物受到病原体刺激后,成为产生免疫效应分子的重要场所[20- 21],本研究发现,感染组脾组织中检测到 4 个免疫相关基因均显著表达,其中IL-1β、IL-4和IL-2基因极显著表达,体现了脾脏在支原体感染中发挥重要免疫作用。肺脏是肺炎支原体感染的直接接触组织,猪感染肺炎支原体后,大量中性粒细胞会聚集在肺泡组织中,进行炎症反应。本研究在肺组织中检测发现IL-1β基因呈现极显著表达。IL-1β是炎症反应的一个重要介质,能够诱导其他炎症因子的释放,促进组织炎症反应[22]。在肺组织中,IL-1β显著激活巨噬细胞分泌炎症细胞因子、趋化因子[18]。在本研究中,感染猪肺组织IL-1β显著表达也体现IL-1β在猪感染肺炎支原体的炎症反应中的重要性。然而,在感染猪气管组织中,均未检测到4个免疫相关基因表达量的变化,这可能与气管的特性有关,气管并不是免疫器官,支原体感染未引起气管组织产生免疫反应。
综上所述,本研究通过对F1(杜洛克×姜曲海)试验猪接种感染肺炎支原体后的临床症状、生长速度、肺组织病变、血清抗体水平及免疫相关分子基因的表达等方面进行系统研究,成功构建猪肺炎支原体感染模型,为进一步研究对肺炎支原体耐受的杜洛克猪和易感的姜曲海猪的发病分子机理,并筛选支原体肺炎的抗病分子基因标记奠定基础。
