盐胁迫对线辣椒根系生长及基因表达的影响
2019-07-29洪茵恬王晨光张永香赵尊练郭建伟
洪茵恬 ,王晨光,张永香,赵尊练,任 苗,郭建伟
(1.西北农林科技大学 园艺学院,陕西杨凌 712100;2.陕西省农业技术推广总站,西安 710003;3. 泾阳县蔬菜产业服务中心,陕西泾阳 713700)
辣椒(CapsicumannuumL.)目前是中国的第一大蔬菜作物。线辣椒(Capsicumannuumvar.annuum)属长辣椒的一种,果实线形、细长,辣味浓且香,是中国重要的干制辣椒类型。
辣椒幼苗的显微结构研究结果[4]表明,盐胁迫加速了根系输导组织的分化,以适应水分运输。姚静等[5]研究表明,盐胁迫下,番茄幼苗的侧根数显著下降,根长也明显降低,根的平均直径、根表面积和根体积等形态指标也受到盐胁迫的抑制。谢德意等[6]研究发现,高浓度盐胁迫使棉花幼苗的主根变短、侧根数量变少。谷艳芳等[7]研究发现,随着盐分浓度的增加,冬小麦根长呈下降趋势。刘凤兰等[8]研究发现,在NaCl胁迫下,黄瓜幼苗总根数、总根长及根系鲜质量均呈下降趋势。
目前,关于盐胁迫对线辣椒根系形态及基因表达的研究尚未见报道。本试验通过种子发芽试验筛选出耐盐性不同的线辣椒品种,用不同浓度的盐溶液处理其幼苗,研究其根系的形态变化及根系基因表达,以期为线辣椒耐盐机理的研究及解决线辣椒盐胁迫问题提供理论支持。
1 材料与方法
1.1 试验材料
先选取在陕西省和华北地区主栽的线辣椒品种以及已有研究表明比较耐盐的线辣椒品种22个,通过预备试验,并参考已有的研究结果[9-10],从中选出具有代表性的品种‘强丰7301’(耐盐品种)和‘GX7’(盐敏感品种)进行试验。
1.2 试验方法
1.2.1 盐胁迫处理及根系形态学参数测定 试验在西北农林科技大学园艺学院实验室进行。将‘强丰7301’和‘GX7’的种子播于穴盘内,以草炭、珍珠岩、蛭石[1∶1∶1(体积比)]为基质,置于人工智能培养箱内,白天温度25~30 ℃,夜间 18 ℃,光照16 h(光照强度750 μmol·m-2·s-1),黑暗8 h。在幼苗展开3~4片真叶后开始进行NaCl胁迫处理,设置5个NaCl浓度水平,分别为50、100、150、200、250 mmol·L-1,以蒸馏水为对照。每天每株幼苗10 mL溶液处理。
盐胁迫处理20 d后,取出幼苗,用自来水冲洗根系,去除基质和其他表面杂物,再用蒸馏水洗净,吸干水分。用EPSON 10000XL扫描仪得到完整的根系扫描图像,用WinRHIZO PRO 2012 根系分析系统( Regent Instruments Inc8,Canada)分析总根长、平均根系直径、根尖数、分枝数等形态参数。最后将根系置于75 ℃下烘干称量。
1.2.2 根系基因表达检测 将‘强丰7301’和‘GX7’分别播种于穴盘,每天浇灌等量纯水。待幼苗3叶1心时,用250 mmol·L-1NaCl溶液进行盐胁迫处理[11-12],分别在处理0、3、6、12 h时取其根系,洗净、提取根尖,将样品放入液氮中浸泡后迅速置于-80 ℃超低温冰箱,备用。
RNA的提取和Illumina 测序:由北京百迈客公司使用Trizol试剂盒(Invitrogen,Carlsbad,420 CA,USA)提取线辣椒根系样品总RNA,并用NanoDrop 2000(Thermo)检测其浓度,用RNA Nano 6000试剂盒(Agilent Technologies,CA,USA)测定其完整性。用NEBNextUltraTM RNALibrary Prep Kit 试剂盒(NEB,USA)构建cDNA测序文库,用TruSeq PE Cluster Kit 试剂盒v4-cBot-HS(Illumia)生成测序Cluster,然后用基于边合成边测序技术(Sequencing by synthesis,SBS),在Illumina HiSeq高通量测序平台对cDNA文库进行测序。
测序质量检测和差异表达基因的筛选及注释:将测序原始数据Raw Data进行过滤得到Clean Data,与指定的参考基因组进行序列比对,得到Mapped Data,进行插入片段长度检验和随机性检验等文库质量评估。以比对软件Bowtie2[13]为基础,利用Tophat2[14]将Clean Reads与参考基因组进行序列比对。
在差异表达基因检测过程中,采取RPKM(Reads Per Kilo bases per Million reads,RPKM)法计算处理与对照每个基因的差异倍数,用Benjamini-Hochberg校正方法对原有假设检验得到的显著性P值(P-value)进行校正。若表达量变化倍数Fold Change≥2,且错检率FDR(False discovery rate)<0.05,则认为其为响应盐胁迫差异表达的基因。将差异表达基因分别在基因本体库(Gene ontology,GO)[15]和京都基因与基因组百科全书库(Kyoto encyclopedia of genes andgenomes,KEGG)[16]中进行比对和注释。
1.2.3 数据分析 用Excel 2003软件处理试验数据,采用SPSS 20.0对数据进行相关性和显著性分析。
2 结果与分析
2.1 盐胁迫对线辣椒幼苗根系形态的影响
从图1可以看出,随着NaCl溶液浓度的升高,耐盐品种‘强丰7301’的根系从乳白色逐渐变为褐色。同时可以看出,低浓度下(50 mmol·L-1)NaCl溶液对该品种根系的生长有一定的促进作用,下部的侧根明显增多;高浓度NaCl溶液处理下,该品种根系的生长量略有下降。
从图2可以看出,随着NaCl溶液浓度的升高,盐敏感品种‘GX7’的根系从乳白色逐渐变为褐色,但只有图2-f的颜色与对照差异比较明显。同时,低浓度(50和100 mmol·L-1)NaCl溶液对该品种根系的生长有一定的促进作用;高浓度NaCl溶液处理下,该品种根系的生长量下降比较明显。
2.2 NaCl胁迫对线辣椒幼苗根系参数的影响
从表1可以看出,对‘强丰7301’来说,在50 mmol·L-1NaCl溶液处理下,除平均根系直径与对照差异不显著外,其余根系参数均显著大于对照;在100 mmol·L-1NaCl溶液处理下,除平均根系直径与对照差异不显著、根系干质量显著低于对照外,其余根系参数仍然显著大于对照。NaCl溶液浓度达到150 mmol·L-1之后,总根长、总根表面积、根尖数、分枝数和根系干质量都有随着盐浓度的升高而降低的趋势,并且都显著低于对照。总体来看,低浓度盐胁迫可以促进‘强丰7301’幼苗根系的生长,而高浓度盐胁迫则对其幼苗根系的生长具有抑制作用。另外,在 150~250 mmol·L-1NaCl胁迫处理下平均根系直径都显著高于对照,胁迫处理之间呈先升高再降低的趋势;在50~200 mmol·L-1NaCl胁迫处理下总根体积都显著高于对照,到250 mmol·L-1NaCl胁迫处理下才又降到与对照相当的水平。

a为对照(即CK)的根系 a shows the rootsystem of control group(CK),b~f分别为50、100、150、200、250 mmol·L-1NaCl溶液处理的根系 b-f shows treatment with 50,100,150,200 and 250 mmol·L-1NaCl solution,respectively.图2同 The same as Fig.2
图1 NaCl胁迫下‘强丰7301’根系形态的变化
Fig.1 Changes of NaCl stress on root morphology of ‘Qiangfeng 7301’

图2 NaCl胁迫下‘GX7’根系形态的变化Fig.2 Changes of NaCl stress on root morphology in ‘GX7’
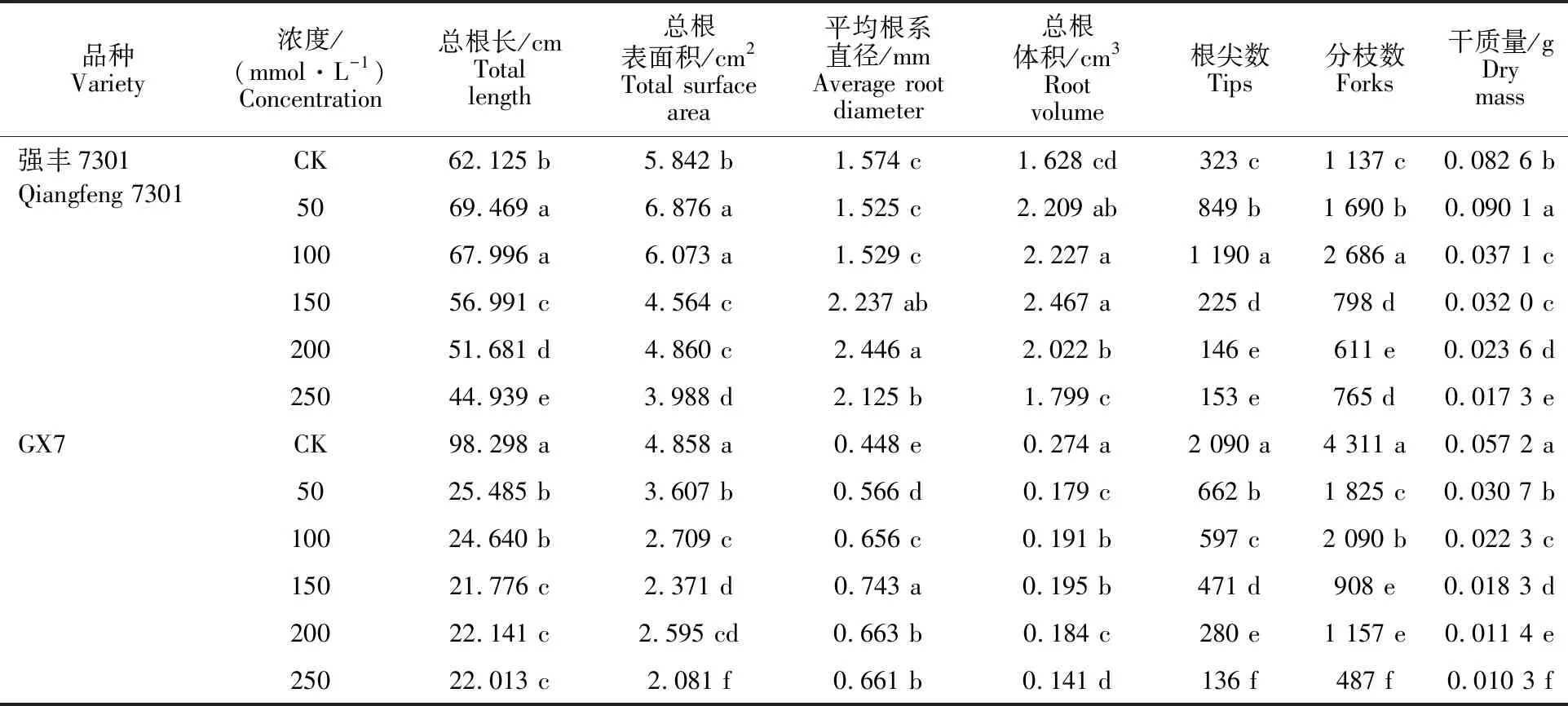
表1 NaCl胁迫下线辣椒根系参数的变化Table 1 Changes of NaCl stress on root morphology of different Xianlajiao chili pepper
注:不同小写字母表示品种内不同盐处理之间在0.05水平差异显著性(LSR法标记)。
Note: The different lowercase letters indicate significant difference at 0.05 levels under different salt treatments.
对‘GX7’来说,在50~250 mmol·L-1的5个NaCl胁迫处理下,除平均根系直径均显著高于对照外,其余根系参数均显著低于对照。总根长、总根表面积、根尖数和根系干质量都随着盐浓度的升高而显著降低;总根体积和分枝数随着盐浓度的升高先显著升高,随后又显著降低。总体来看,盐胁迫对‘GX7’根系的生长具有很明显的抑制作用,而盐胁迫对‘强丰7301’的影响明显小于‘GX7’。这也进一步证明‘强丰7301’比‘GX7’的耐盐性强。
2.3 NaCl胁迫对线辣椒幼苗根系基因表达的影响
2.3.1 测序质量检测结果 盐胁迫下线辣椒根系转录组测序原始数据(Raw Data)大部分碱基质量打分能达到或超过Q30,经过测序质量控制,各样品Q30碱基百分比均不小于94.60%。从比对结果统计来看,各样品的Clean Reads与参考基因组的比对效率为86.45%~88.64%,能够满足后续分析的需求。
2.3.2 差异表达基因的筛选 从表2可以看出,2个品种在盐胁迫处理后的不同时间点都有大量的基因达到了差异表达的标准,2个品种之间在不同时间节点的差异表达也有较大的区别。‘GX7’和‘强丰7301’在盐胁迫后差异表达基因的数量随时间的延长而增加,在12 h达到了最大,‘GX7’为4 102,‘强丰7301’为4 713;从0~ 3 h、0~6 h和0~12 h这3个时间段内的差异表数看,大部分差异表达在3 h之内完成。在统计出的差异表达基因中,上调基因和下调基因几乎各占一半。
2.3.3 差异表达基因的GO注释分析 以‘GX7’(盐敏感品种)为基础,筛选出‘强丰7301’与根系生长发育有关的194个差异表达基因,注释到56个GO条目,注释统计结果见图3。
从图3可以看出,与根系生长发育有关的差异表达基因在细胞成分、分子功能和生物学过程3个GO分支中均有分布,涉及到根形态发生、渗透胁迫反应、细胞生长、细胞内膜结合细胞器和谷胱甘肽转移酶活性等过程。上调和下调基因的数量大致相似,但也有一些基因只有上调或下调。
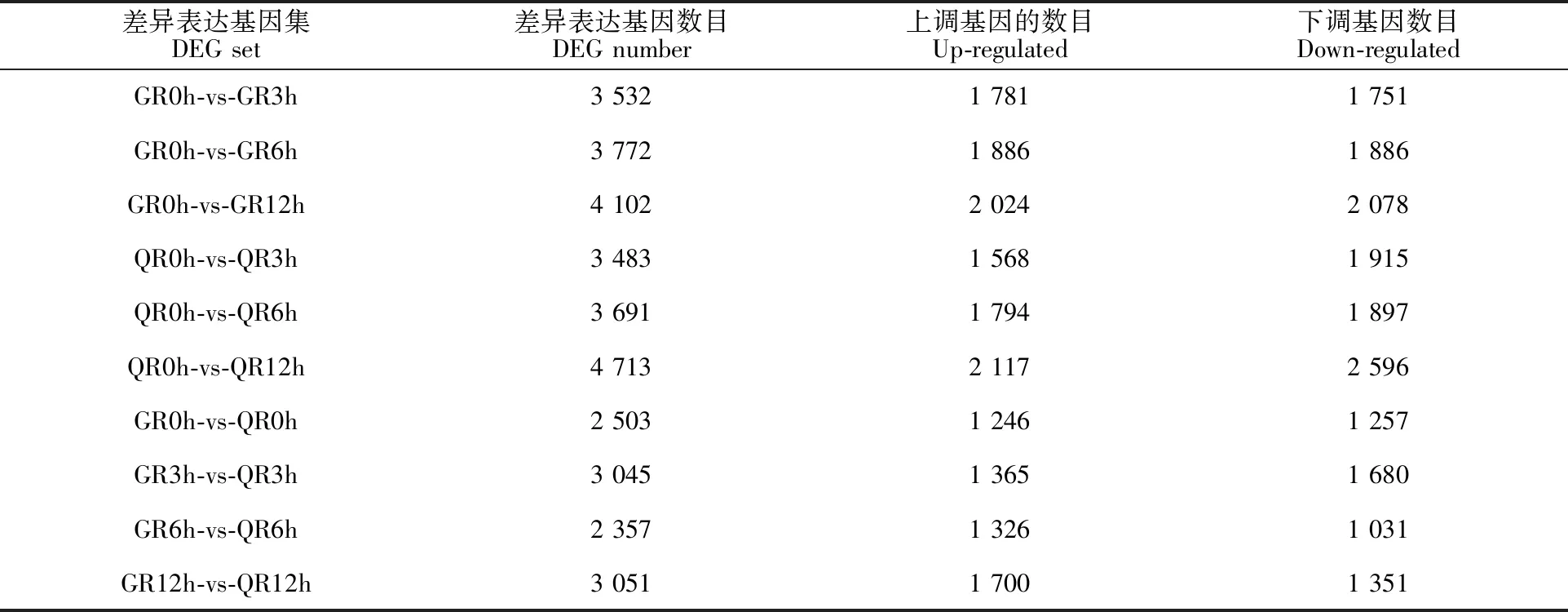
表2 NaCl胁迫下线辣椒根系基因的表达Table 2 Gene expression of different Xianlajiao chili pepper in NaCl stress
注:G为线辣椒品种‘GX7’;Q为线辣椒品种‘强丰7301’;R表示材料为根系;0、3、6、12 h为盐胁迫处理的时间,0 h为对照组。
Note: G is Xianlajiao chili pepper ‘GX7’; Q is Xianlajiao chili pepper ‘Qiangfeng 7301’; R indicats that the material is rootsystem. 0,3,6,12 h is the time to extract the sample after treatment,0 h is CK.

此图中的差异表达以盐敏感品种‘GX7’为基础,图4同 Differential expression in this figure is based on the salt-sensitive variety ‘GX7’,The same as figure 4
图3 ‘强丰7301’与根系相关的差异表达基因注释到GO的功能分类
Fig.3 ‘Qiangfeng 7301’ root-related differentially expressed genes annotated to GO functional classification
在生物学过程分支中,根形态发生差异表达基因最多,说明此类基因在‘强丰7301’应对盐胁迫时最为活跃;渗透胁迫反应的差异表达次之,下调基因明显多于上调基因,说明此类基因的下调有利于提高‘强丰7301’的耐盐性;而在细胞生长的差异表达基因中,上调基因明显超过下调基因,说明细胞生长类基因的上调表达与耐盐性有关。在分子功能分支中,谷胱甘肽转移酶活性、离子结合的差异表达基因较多,且差异表达以上调为主;同时还有ATP酶活性、UDP-木糖基转移酶活性和蛋白磷酸酶结合等差异表达基因全部为上调表达;说明此类基因的上调表达与‘强丰7301’的耐盐性有关。在细胞成分分支中,细胞内膜结合细胞器差异表达基因较多,且以上调为主;细胞外区域、叶绿体差异表达基因次之,上调数和下调数基本相当,说明上述基因的差异表达与‘强丰7301’的耐盐性有关。
2.3.4 差异表达基因的KEGG注释分析 以‘GX7’(盐敏感品种)为基础,在盐胁迫处理3 h、 6 h和12 h这3个采样点,分别筛选出‘强丰7301’与根系生长发育有关的差异表达基因并注释到KEGG数据库,注释统计结果见图4。
由图4可以看出,3个采样点共有141个差异表达基因注释到KEGG数据库,有11个基因在3个采样点均发生了差异表达,说明这11个基因始终在‘强丰7301’应对盐胁迫中发挥作用,这些基因可能与其根系的耐盐性关系密切。
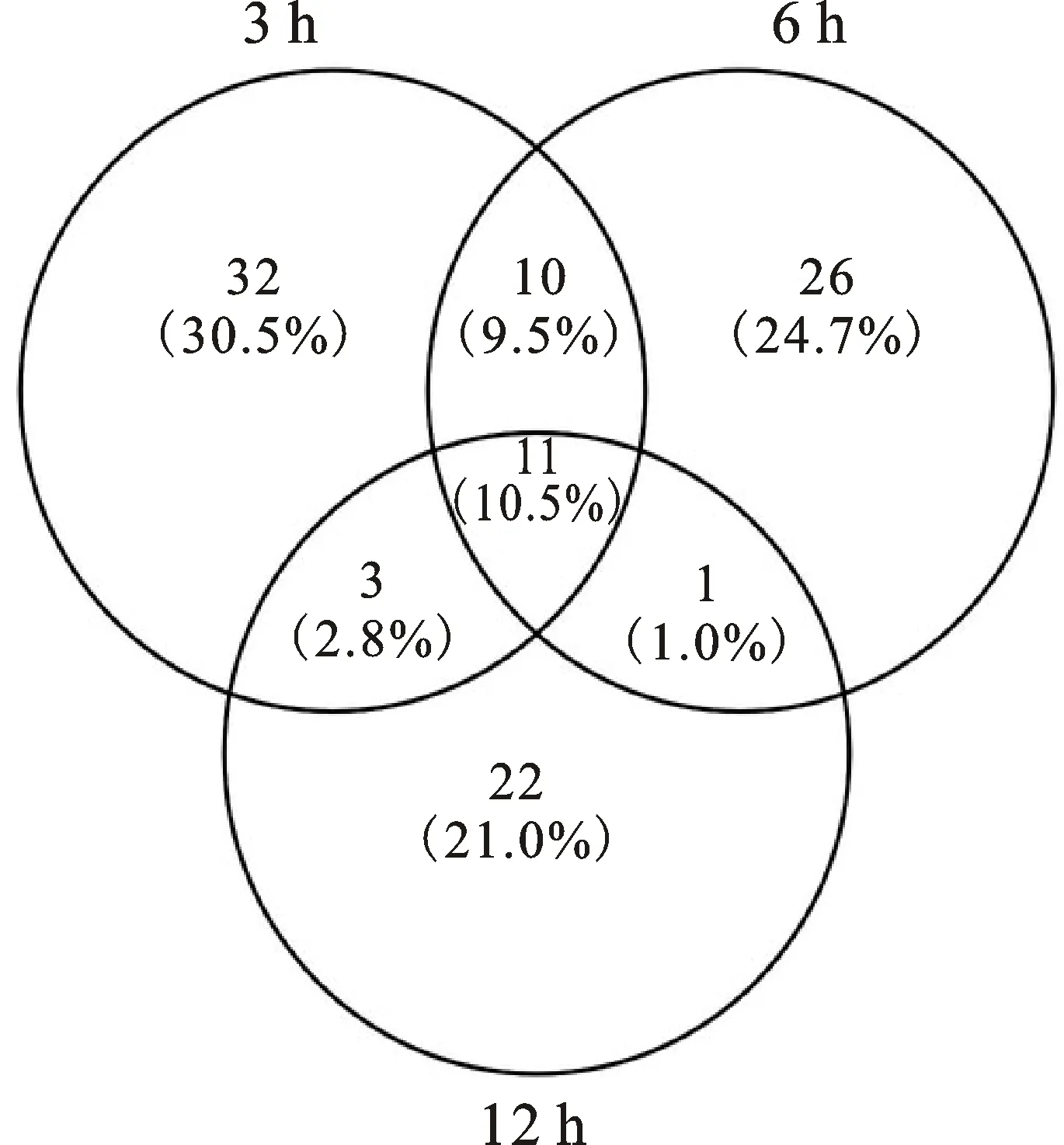
3 h、6 h和12 h分别表示在NaCl溶液胁迫处理3 h、6 h和12 h后取样 3 h,6 h and 12 h show respectively that samples were taken after NaCl solution stress treatment for 3 h,6 h and 12 h
图4 ‘GX7’与‘强丰7301’在3个时间点与根系相
关的差异表达基因注释到KEGG的数量
Fig.4 Number of differentially expressedroot-related genes annotated to KEGGin ‘GX7’ and ‘Qiangfeng 7301’
由表3可知,这11个基因注释到KEGG的通路集中在胞吞作用、谷胱甘肽代谢、真核生物中的核糖体生物合成、吞噬体、苯丙氨酸代谢、苯丙素生物合成和植物激素信号转导等方面,并且多为上调表达,其中吞噬体(ko04145)通路和谷胱甘肽代谢(ko00480)通路出现次数较多。
在11个基因中,Capana00g004468和Capana08g0020142个表现为下调,其余9个基因表现为上调,且2个品种在表达量上差异十分明显。同时,‘GX7’有3个基因(Capana11g001528、Capana06g001415和Capana00g000561)在3个时间点上的表达量均为0,这3个基因分别与谷胱甘肽代谢、脂肪酸代谢和吞噬体有关,说明这3个基因可能与‘GX7’的盐敏感性关系密切。
3 讨 论
3.1 盐胁迫对线辣椒根系形态的影响
根系是植物接受盐胁迫的第一感受器官。本研究结果表明,盐胁迫对耐盐线辣椒品种‘强丰7301’的总根长、根表面积、根体积、根尖数等根系生长参数的影响有限,而且低浓度盐分还有促进作用;而对品种‘GX7’的影响则比较显著,上述指标的下降程度与盐分浓度呈正比。
在本研究中,虽然盐胁迫对‘强丰7301’根系的总体生长量影响不大,但是盐胁迫处理的根系颜色明显变深,原因有待进一步研究。另外,盐胁迫处理使线辣椒的根系增粗,其机理也有待进一步研究。
3.2 盐胁迫下线辣椒根系基因的差异表达
关于盐胁迫下辣椒根系基因的表达尚未见研究报道。本试验参考海滨锦葵[11]及紫花苜蓿[12]上的研究,将取样时间定于盐胁迫处理3、6、 12 h,这些取样时间点是否为最佳,有待进一步研究验证。
本研究结果表明,2个线辣椒品种在盐胁迫后的差异表达基因分布在细胞成分、分子功能和生物学过程等3个GO分支中,涉及的功能有系统获得性抗性、渗透胁迫反应、生长、肌醇磷酸代谢途径等22个方面,其中以根形态发生、渗透胁迫反应和细胞生长最多,说明这些基因的表达与品种的耐盐性关系密切。这一结果与马进等[12]对南方型紫花苜蓿叶片和高彩婷等[17]对燕麦的研究结果部分相似。马进等[12]的研究结果表明,南方型紫花苜蓿叶片在盐胁迫下(以未胁迫为对照)差异表达基因主要集中在结合、催化活性、细胞过程、代谢过程和刺激相应。高彩婷等[17]的研究表明,燕麦在盐胁迫下(以未胁迫为对照)差异表达基因主要集中在植物激素信号转导途径、ABC转运蛋白途径、肌醇磷酸代谢途径和渗透调节途径上。
3.3 不同耐盐性线辣椒品种在盐胁迫后的基因差异表达
本研究结果表明,以‘GX7’(盐敏感品种)为基础,耐盐品种‘强丰7301’在盐胁迫后均有大量基因上调表达或下调表达。在盐胁迫3、6、12 h均发生差异表达的11个基因中,‘强丰7301’以上调表达为主,下调表达仅涉及2个基因;有3个基因在‘GX7’中的表达量为0,这3个基因分别与谷胱甘肽代谢、脂肪酸代谢和吞噬体有关,这3个基因可能与‘GX7’的盐敏感性密切相关。谷胱甘肽代谢中,谷胱甘肽还原酶(GR)及其同工酶已经证实会参与植物抵抗非生物逆境过程[18-19],而且GSH/GSSG的比率在细胞的抗氧化系统中有重要作用[20],‘强丰7301’谷胱甘肽代谢基因的上调表达可能与其耐盐性有关。吞噬体的主要作用是可以在细胞内正常的蛋白质被活性氧损伤后,降解不正常的氧化蛋白[21],是一种不依赖蛋白酶体的水解系统,‘强丰7301’吞噬体基因的上调表达说明其除了有较高的抗氧化系统外,同时存在修复系统。
4 结 论
随着盐浓度的升高,线辣椒根系颜色从乳白色逐渐变为褐色,在颜色变化方面,‘强丰7301’比‘GX7’更为明显。
盐胁迫对线辣椒总根长、总根表面积、平均根系直径、总根体积、根尖数、分枝数、根系干质量都有显著的影响。‘强丰7301’的多项指标表现为低浓度促进和高浓度抑制趋势,‘GX7’在所有盐胁迫处理下总体表现下降。
以‘GX7’为基础,盐胁迫下‘强丰7301’根系大量基因出现差异表达,通过GO分析,与根系耐盐有关的差异表达基因在细胞成分、分子功能和生物学过程等3个GO分支均有分布。
通过KEGG注释分析,‘强丰7301’有11个基因在所有取样点均发生差异表达,其中2个表现为下调,9个表现为上调。
