双价猪流行性腹泻病毒特异性双峰驼源单域抗体的重组表达和特征分析
2019-07-29杨顺利张辛铭蔡建平薛慧文尹双辉
李 丽,杨顺利,张辛铭,蔡建平,薛慧文,尹双辉
(1.甘肃农业大学 动物医学院,兰州 730070;2.中国农业科学院 兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046)
猪流行性腹泻病毒(Poreine epidemic diarrhea virus,PEDV) 属于尼多病毒目(Nidovirales),冠状病毒科(Coronaviridae),冠状病毒属(Coronavirus)成员,是引起猪流行性腹泻(PED)的病原。PED是一种急性接触性传染病,可通过粪便、污染的饮水、饲料和环境迅速散播,病猪的主要特征为腹泻、呕吐和脱水,不同年龄阶段的猪均可感染发病,但对哺乳仔猪具有较高致死率。目前的流行病学调查研究表明,PEDV已经遍及全球[1-2],亚洲的爆发频率也不断增加,尤其是在养猪业较为发达的中国[3-5],给养猪业带来巨大损失。目前,灭活和弱毒疫苗已经在临床广泛使用,但由于PEDV感染的免疫学特征以及病毒的不断变异,临床不断有PED发病和流行的报道。因此,对PED的快速、准确检测,及时切断其传播环节,仍是PED防控的重要举措。
抗体是常见血清学和病原学检测方法中的重要组成部分,抗体的特性很大程度上决定了检测方法的准确性和敏感性。重链抗体(HCAbs)是发现于驼科和软骨鱼等动物体内的一种天然缺失轻链,仅有重链的抗体[6]。这类抗体的抗原结合结构域仅由重链可变区构成,称此可变区片段为单域抗体(Single domain antibody,sdAb),由于其分子质量仅15 ku,是单克隆抗体的1/3,因此也称其为纳米抗体(Nanobody)。sdAb是目前可以得到的具有完整功能的最小抗体分子,sdAb具有比普通抗体更大的重链可变区(VH)抗原结合环结构,更长的第三互补决定区(CDR3),能够形成更多的新结构,因而补偿了轻链可变区(VL)抗原结合位点的缺失,仅靠3个CDR就具备特异的抗原结合能力及高亲和力。此外,已有研究证实sdAb还具有容易在大肠杆菌表达系统表达、具有高水溶性、耐高温和极端pH等独特性质[7-8]。鉴于此,sdAb在医学、生物技术、诊断和治疗领域得到广泛应用[9-12]。
成本低廉、获得容易、具有高亲和性和特异性的抗体是检测方法研发所追求的理想材料。本研究对已经获得的4株PEDV 膜蛋白特异性sdAb(sdAb-Mcs)进行结构分析并构建双价抗体。分析双价抗体的温度耐受性、pH耐受性、竞争活性和M蛋白捕获特性,获得具有很好病原捕获活性和竞争活性的双价sdAb-Mcs。为建立高度敏感和特异的PEDV检测方法提供廉价的材料基础,同时也为sdAb的有效应用提供更多思路。
1 材料与方法
1.1 材 料
试验涉及的限制性内切酶均购自TaKaRa公司;质粒提取试剂盒和大肠杆菌感受态细胞购自北京全式金生物公司;异丙基-β-d-硫代半乳糖苷(IPTG)购自上海生工;胶回收试剂盒购自美国OMEGA公司;His-tag纯化树脂购自德国Qiagen公司;96孔酶标板购自美国Coster公司; 0.45 μm滤膜和PVDF膜购自德国millipore公司;牛血清白蛋白(BSA),碳酸盐包被缓冲液和TMB底物显色液购自美国Sigma公司;HRP酶标记抗His-tag抗体购自北京博奥龙免疫技术有限公司;HRP酶标记抗兔抗体购自美国Abcom公司;ECL显色液购自美国Thermo公司;pET-32a表达载体、带有His和GST标签的重组PEDV膜蛋白、膜蛋白高免兔血清以及膜蛋白特异性sdAb为中国农业科学院兰州兽医研究所猪禽消化道感染和黏膜免疫研究创新团队实验室保存;其他常规试剂为国产分析纯。
1.2 方 法
1.2.1 PEDV特异性单域抗体结构模拟分析及双价抗体的构建 利用SWISS-MODEL (https://swissmodel.expasy.org/) 在线软件,对PEDV特异性单域抗体sdAb-Mc19(Genbank access NO.: MH550664)、sdAb-Mc29(MH550665)、sdAb-Mc30(MH550666)和sdAb-Mc37(MH550 667)[13],进行结构模拟分析。用已公布的双峰驼源sdAb晶体结构(5lz0)为模板[14],利用SPDBV 4.0 软件绘结构图。
利用BamHⅠ,HindⅢ和XholⅠ酶切位点,将双拷贝的sdAb-Mc19/29/30/37基因分别克隆到 pET-32a(+) 载体,同时两个拷贝sdAb之间引入15个氨基酸的柔性氨基酸序列[15]。连接产物转化到大肠杆菌(DH5α)感受态细胞,挑选阳性克隆并进行测序分析。
1.2.2 双价sdAb的表达、纯化与鉴定 将阳性质粒转化到大肠杆菌BL21(DE3),将含有重组质粒PET-32a-sdAb-Mc19-19 /29-29 /30-30 /37-37的单菌落分别接种到新鲜Lysogeny broth(LB)培养基(含100 μg/mL Ampicillin),37 ℃振荡培养过夜,次日按照体积比1∶100的接种量,将菌转接至3 mL 新鲜LB培养基(含100 μg/mL Ampicillin)中,振摇至OD600约为0.6~0.8,加入IPTG至终浓度 0.001 mol/L,25 ℃诱导10 h后,8 000 r/min离心收集菌体。用12%聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
确定表达后,大量诱导表达重组菌,收集菌体。用Tris-HCL缓冲液(pH 8.0)重悬,置冰上用超声仪进行细胞裂解,然后12 000 r/min,4 ℃离心10 min,收集上清。上清液用0.45 μm滤膜过滤并加入到His标签蛋白亲和层析柱,按操作说明进行目的蛋白纯化。获得的蛋白样品进行SDS-PAGE电泳分析。用Nanodrop2000超微量分光光度计测浓度后,分装,-80 ℃保存。
Western blot验证,将表达菌液上清用φ=12% SDS-PAGE分离并转到PVDF膜。用BSA-PBS 封闭液 (1×PBS,含50 g/L的BSA,pH 7.4) , 4 ℃,过夜封闭;次日,用PBST (1×PBS,含φ=0.1% Tween-20,pH 7.4) 洗3次;然后,与HRP标记的抗His标签蛋白单克隆抗体室温孵育1 h,PBST洗5次后,用ECL底物显色液,暗盒曝光显色。
1.2.3 重组双价sdAb-Mcs与M蛋白结合活性分析 用间接ELISA方法,检测重组双价sdAb-Mcs与M蛋白的结合活性[13]。用碳酸盐缓冲液(pH9.6)稀释带有GST标签的重组M蛋白(M-GST)至终质量浓度为10 μg/mL,过夜包被酶标板;次日,用PBST洗板3次,用BSA-PBS封闭缓冲液室温封闭1 h;PBST再次洗板3次,加入系列稀释的sdAb-Mc19-19/29-29/30-30/37-37至终质量浓度分别为10、5、2.5、1.25、0.63、0.32、0.16 和 0 μg/mL,50 μL/孔,37 ℃孵育1 h;随后,PBST洗板5次,加入HRP标记的抗His标签蛋白抗体,37 ℃孵育1 h;再次洗板,加入四甲基联苯胺(TMB)底物显色液,室温避光孵育15 min;读取OD450值。设置GST标签蛋白包被孔为对照。
同时,通过Western blot 方法验证双价sdAb-Mcs与M-GST蛋白的结合活性。用12% SDS-PAGE分离M-GST蛋白后,转到PVDF膜;用BSA-PBS封闭缓冲液,室温封闭PVDF膜 2 h;然后将PVDF膜与sdAb-Mc19-19 /29-29 /30-30 /37-37,4 ℃过夜孵育;随后,PBST洗膜5次,并与HRP标记抗His抗体,37 ℃孵育1 h;再次洗膜5次,用ECL底物显色液,暗盒曝光显色。
1.2.4 温度耐受性分析 将重组的单价和双价sdAb-Mcs分别置于30~90 ℃水浴1 h,然后,通过ELISA方法检测不同温度处理后的抗体M蛋白结合活性。过程如下:用碳酸盐缓冲液(pH 9.6)稀释M-GST蛋白至10 μg/mL,过夜包被酶标板;然后,用BSA-PBS封闭缓冲液室温封闭 2 h;PBST洗板3次,加入不同温度条件下处理的sdAb,质量浓度为5 μg/mL,每孔50 μL,37 ℃孵育1 h;再次洗板5次,加入HRP标记的抗His抗体, 37 ℃ 孵育1 h;洗板5次,加入TMB底物显色液,室温避光15 min;读取OD450值。
1.2.5 pH耐受性分析 将重组的单价和双价sdAb-Mcs分别置pH为2~11的Tris-HCl中,重组抗体质量浓度为5 μg/mL。然后,将不同pH的重组抗体加入到M-GST蛋白(10 μg/mL)包被的酶标板,37 ℃孵育1 h;随后,PBST洗板5次,加入HRP标记的抗His抗体,37 ℃孵育1 h;再次洗板,加入TMB底物显色液,室温避光 15 min;读取OD450值。
1.2.6 竞争活性分析 分别将2.5 μg、5 μg、10 μg和20 μg的单价和双价sdAb-Mcs与1∶200稀释的M蛋白免疫兔血清(PBS为稀释液)混合,混匀后加入M-GST蛋白(10 μg/mL)包被的酶标版,每孔50 μL,室温,放置于微孔板震荡器(QB-9001),震速200,作用2 h;之后,PBST洗板5次,加入1∶4 000稀释的HRP标记抗兔第二抗体,每孔50 μL,室温孵育1 h;再次洗板,加入TMB底物显色液,室温避光15 min;读取OD450值。同时,设置未混合sdAb-Mcs的兔血清对照组。竞争率计算公式为:竞争率=(兔血清孔OD450值-兔血清与sdAb-Mcs混合孔OD450值)/兔血清孔OD450值× 100%。
1.2.7 对M蛋白捕获特性分析 用碳酸盐包被缓冲液稀释重组单价和双价sdAb-Mcs至20 μg/mL,每孔50 μL,4 ℃,过夜包被酶标版;然后,用PBST洗板5次,用BSA-PBS封闭缓冲液室温封闭1 h;再次洗板5次,拍干孔内残留液体,加入质量浓度为0.1 g/L的重组M蛋白,每孔50 μL,室温,震荡孵育2 h,吸出孔内液体,用Nanodrop 2000 测蛋白质量浓度,计算质量浓度变化值,比较分析不同sdAb-Mcs结合M蛋白的差异。用t-test 统计学方法分析单价与双价抗体捕获M蛋白的差异显著性。
2 结果与分析
2.1 PEDV特异性sdAb结构模拟及双价抗体表达质粒构建
结构模拟分析结果显示,sdAb-Mc19、sdAb-Mc29、sdAb-Mc30和sdAb-Mc37与已报道的双峰驼源sdAb 5lz0具有相似的空间结构,仅在CDR3结构域存在一些差异(图1-a)。
利用这些sdAb-Mcs按照图1-b所示的方式,构建含双拷贝sdAb-Mcs基因的原核表达质粒PET-32a-sdAb-Mc19-19 /29-29 /30-30 /37-37,测序分析连接目的基因片段正确后,提取质粒,备用。
2.2 双价sdAb的表达、纯化与鉴定
将表达质粒转化到大肠杆菌感受态细胞(DE3),用0.001 mol/L的IPTG 诱导,SDS-PAGE结果,IPTG诱导组出现大小约为40 ku的表达条带,与目标蛋白大小相符;大量诱导收获菌体,利用His标签蛋白纯化树脂进行纯化,可以得到预期大小的蛋白,进一步通过Western blot方法验证,结果同样出现预期大小的条带(图1-c)。
2.3 重组双价sdAb-Mcs与M蛋白结合活性 分析
通过ELISA和Western blot 检测重组双价sdAb-Mcs与M蛋白的结合活性。ELISA结果显示,M蛋白包被孔的OD450值随着双价sdAb-Mcs加入量增加而变大,而GST标签蛋白包被孔的OD450值与空白对照孔值相近,并且随着双价sdAb-Mcs加入量增加OD450值没有规律性变化(图2-A);Western blot 结果出现大小与M-GST相符的单一条带,这些结果一致表明重组双价sdAb-Mcs具有M蛋白结合活性。
2.4 温度耐受性分析
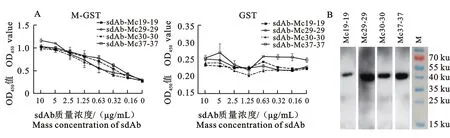
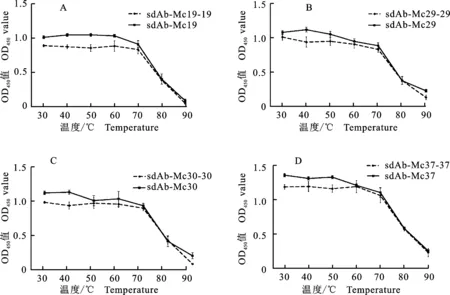
将重组sdAb-Mcs置于30~90 ℃温度梯度下1 h,用ELISA方法检测在不同温度条件处理,是否会影响这些sdAb-Mcs的M蛋白结合活性。结果显示在30~70 ℃条件下,并没有明显影响这些抗体的结合活性,而在80 ℃处理后结合活性明显下降,90 ℃处理后,基本失去M蛋白的结合活性(图3)。此外,单价和双价sdAb-Mcs展示了相似的温度耐受性,表明构建双价抗体并没有影响sdAb-Mcs的温度耐受性。
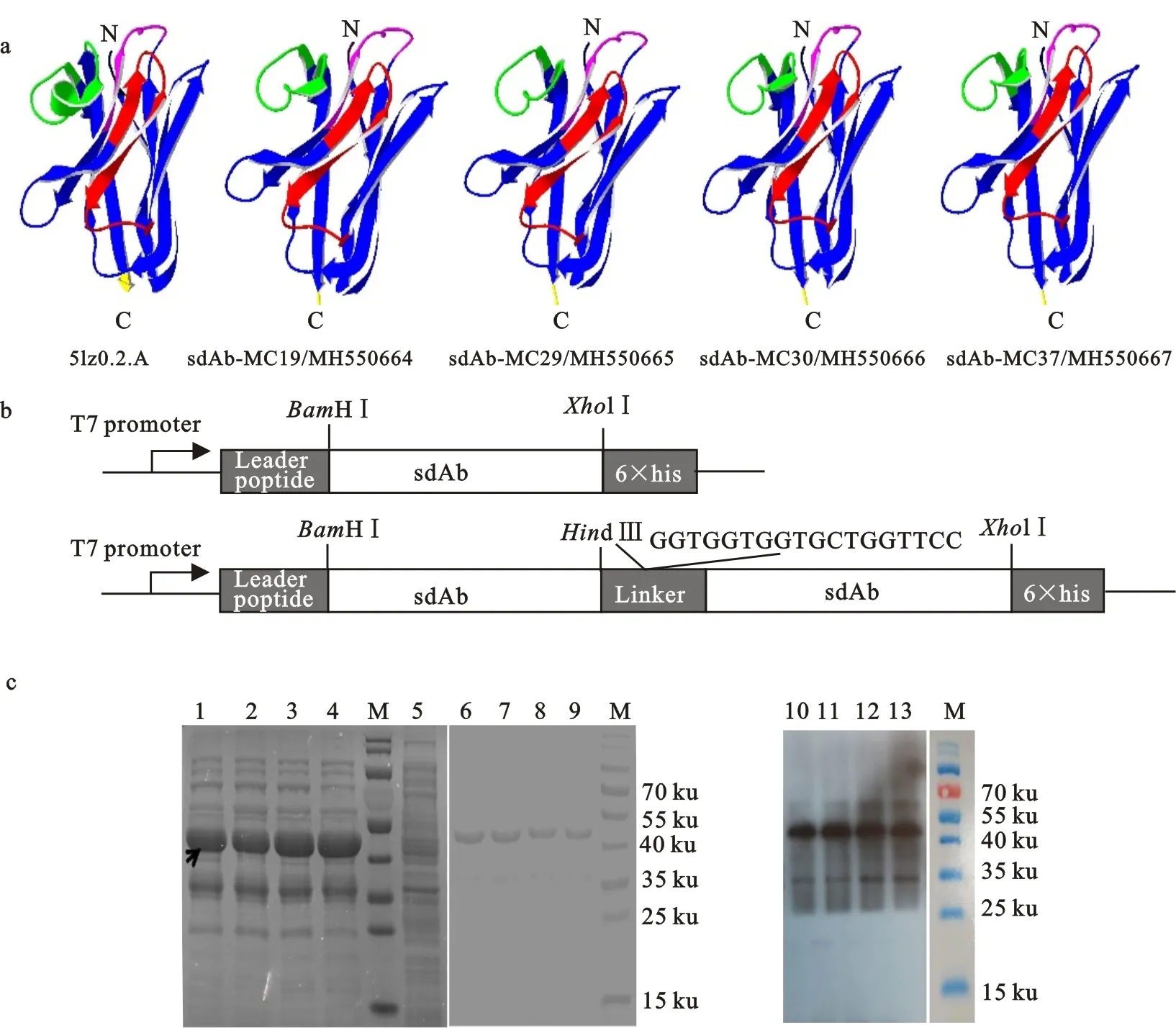
a. sdAb-Mcs的模拟结构,粉色、红色和绿色分别表示CDR1、CDR2 和 CDR3,字母N 和C分别表示N端和C端 Homology modeling of sdAb-Mcs.CDR1, CDR2 and CDR3 are represented in purple, red and green,respectively,the N- and C-terminal extremities are labelled N and C, respectively; b. 双价抗体的构建模式图,利用BamHⅠ/HindⅢ和XholⅠ酶切位点,将双拷贝的sdAb基因克隆到 pET-32a(+) 载体 Expression cassettes of bivalent sdAb-Mcs in pET-32a (+) vector,the sdAb-Mcs encoding gene is sub-cloned at theBamHⅠ/Hind Ⅲsite and theXhoⅠ Isite;c. 双价抗体的表达、纯化和Western blot 鉴定 Expression, purification, and verification of divalent sdAb-Mcs;1-4.分别为双价抗体sdAb-Mc19-19、sdAb-Mc29-29、sdAb-Mc30-30和sdAb-Mc37-37的表达 Expression of sdAb-Mc19-19, sdAb-Mc29-29, sdAb-Mc30-30 and sdAb-Mc37-37;5.为空白质粒对照 Blank vector control;6-9.为sdAb-Mc19-19、sdAb-Mc29-29、sdAb-Mc30-30和sdAb-Mc37-37的纯化 Purification of sdAb-Mc19-19, sdAb-Mc29-29, sdAb-Mc30-30 and sdAb-Mc37-37;10-13.分别为sdAb-Mc19-19、sdAb-Mc29-29、sdAb-Mc30-30和sdAb-Mc37-37表达的Western blot 鉴定 Verification by Western blot based on sdAb-Mc19-19, sdAb-Mc29-29 and sdAb-Mc30-30;M.为蛋白分子量标准 Protein molecular weight marker
图1 sdAb-Mcs结构分析及双价抗体的构建和表达
Fig.1 Structure of sdAb-Mcs cloning, expression and purification of bivalent sdAb-Mcs
2.5 pH耐受性分析
将这些重组sdAb-Mcs分别置于pH 2~11下,用ELISA方法,检测不同pH对这些sdAb-Mcs的M蛋白结合活性的影响。结果显示,在pH 2~10时,这些sdAb-Mcs均具备较好的M蛋白结合活性,而在pH为11时,结合活性明显下降,在pH为2时表现出最佳的结合活性(图4)。此外,单价和双价sdAb-Mcs展示相似的pH耐受性,表明构建双价抗体并没有影响sdAb-Mcs的pH耐受性。
2.6 竞争活性分析
将不同量的单价和双价sdAb-Mcs分别与M蛋白免疫的兔血清混合,通过ELISA方法,检测这些sdAb-Mcs与血清中M蛋白抗体的竞争结合活性。结果显示这些sdAb-Mcs均具备一定的竞争活性,并且与单价sdAb-Mcs相比,双价sdAb-Mcs展示更高的竞争活性(图5)。
A. 双价sdAb-Mcs与重组 M蛋白及GST标签蛋白的结合活性 The binding activity of bivalent sdAb-Mcs to recombinant M protein and GST-tag proteinwas analyzed; B. 验证构建抗体与M蛋白的结合活性 The binding activity of bivalent sdAb-Mcs to recombinant M protein were verified by western blotbased on anti-His tag antibody
图2 双价sdAb的结合活性分析
Fig.2 Binding activity analysis of bivalent sdAb-Mcs to M protein
A.单价sdAb-Mc19和双价sdAb-Mc19-19 在不同温度条件处理后与M蛋白结合活性分析 The binding activity analysis of univalent sdAb-Mc19 and bivalent sdAb-Mc19-19 with M protein in different temperature condition by ELISA;B. sdAb-Mc29和sdAb-Mc29-29 Same analysis on sdAb-Mc29 and sdAb-Mc29-29 ;C. sdAb-Mc30和sdAb-Mc30-30 sdAb-Mc30 and sdAb-Mc30-30;D.sdAb-Mc37和sdAb-Mc37-37 sdAb-Mc37 and sdAb-Mc37-37
图3 sdAb-Mcs温度耐受性分析
Fig.3 Analysis of thermal tolerance of sdAb-Mcs
2.7 对M蛋白捕获特性分析
将相同量的sdAb-Mcs包被酶标板,加入适量M蛋白,通过检测M蛋白的质量浓度变化来分析这些sdAb-Mcs的抗原捕获特性。结果在相同质量浓度的条件下,双价sdAb-Mcs展示更好的M蛋白捕获特性(图6)。
3 讨 论
抗体分子通过其稳定的构象结构来实现对抗原分子的特异识别与结合。常规抗体通过重链和轻链可变区的6个CDR形成构象来特异性识别抗原,而sdAb仅靠3个CDR就具备特异的抗原结合能力及高亲和力,这可能与sdAb独特的空间构象有关。sdAb展现出比普通抗体更长的CDR区,能形成更大的VH抗原结合环结构,并且具更长的CDR3,能够形成更多的新结构,使抗体构象更为稳定[16],从而补偿VL缺失导致的抗原结合位点的缺乏。本研究以公布的双峰驼源sdAb(5lz0)晶体结构为模板,对前期筛选的4株sdAb-Mcs进行结构模拟,分析发现4株sdAb-Mcs均与5lz0具有相似的空间结构,只是在CDR3区存在一些差别,表明这几株抗体均具有结合抗原的sdAb特征性构象结构,是进行sdAb特性分析和应用研究的可靠材料。

A. 单价sdAb-Mc19和双价sdAb-Mc19-19 在不同pH条件下与M蛋白结合活性分析 The binding activity analysis of univalent sdAb-Mc19 and bivalent sdAb-Mc19-19 with M protein in different pH condition by ELISA;B.sdAb-Mc29和sdAb-Mc29-29 Same analysis on sdAb-Mc29 and sdAb-Mc29-29;C.sdAb-Mc30和sdAb-Mc30-30 sdAb-Mc30 and sdAb-Mc30-30;D.sdAb-Mc37和sdAb-Mc37-37 sdAb-Mc37 and sdAb-Mc37-37
图4 sdAb-Mcs pH耐受性分析
Fig.4 Analysis of pH condition tolerance of sdAb-Mcs

A. 单价sdAb-Mc19和双价sdAb-Mc19-19 与M蛋白高免兔血清的M蛋白竞争结合活性分析 The competition capacity of univalent sdAb-Mc19 and bivalent sdAb-Mc19-19 to anti-M protein polyclonal antibody was analyzed by a competitive ELISA;B. sdAb-Mc29和sdAb-Mc29-29 Same analysis on sdAb-Mc29 and sdAb-Mc29-29;C. sdAb-Mc30和sdAb-Mc30-30 sdAb-Mc30 and sdAb-Mc30-30;D. sdAb-Mc37和sdAb-Mc37-37 sdAb-Mc37 and sdAb-Mc37-37
图5 多克隆抗体竞争特性分析
Fig.5 Analysis of competition capacity to anti-M protein polyclonal antibody
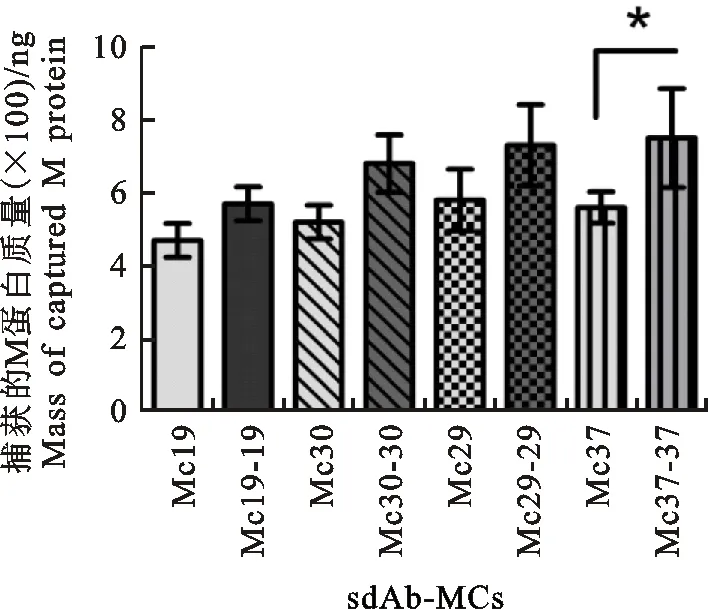
* 表示P<0.05 * represent P<0.05
PEDV是威胁养猪业的重大病原,其传播的广泛性和对新生仔猪近100%的致死率,给养猪业带来巨大损失。对PEDV的早期、快速、准确诊断对PED的防控和疫苗免疫具有重要指导意义。已有研究证实,通过构建多价抗体的方式能够提高抗体的病原中和活性[17]。本研究已经利用筛选到的sdAb-Mcs建立PEDV检测和分离的方法,并证实其适用于临床样品的病原检测和分离[13]。为了建立更为高效的病原检测和分离方法,本研究尝试构建二价sdAb,旨在进一步提高这些抗体的病原亲和特性,从而提高其应用潜力。
sdAb具有十分稳定抗原结合活性,即使经过盐酸胍和尿素等蛋白变性剂处理后,仍然保持抗原结合活性,甚至有些sdAb还能耐受高达90 ℃的高温变性处理,而常规抗体在70 ℃处理后就完全失去抗原结合活性[7, 18]。本研究将重组的单价与双价sdAb-Mcs在30~90 ℃下处理,发现这些sdAb-Mcs在温度高达80 ℃时仍能够保持部分抗原结合活性,表明sdAb-Mcs具备sdAb所固有的温度耐受特性。然而不同的是,sdAb-Mcs在90 ℃处理后,则完全丧失抗原结合活性,这可能与sdAb本身CDR3区域的氨基酸组成有关,由于CDR3较长,其内部的氨基酸,尤其是半胱氨酸,通过形成二硫键形成更为稳定的空间结构来增加sdAb的稳定性[16]。同时,比较单价和双价sdAb的温度耐受性发现,二者并没有明显的差异,表明构建二价抗体并没有影响sdAb的温度耐受特性。
随着研究的不断深入,sdAb在医学领域得到广泛关注。在作为口服治疗性抗体药物研发过程中发现,sdAb在空肠和胃液的条件下仍保持一定的结合活性[19]。在空肠和胃液条件下,sdAb除抵抗蛋白酶降解外,还要面临极低的pH条件。本研究将重组sdAb-Mcs置于pH 2~11下,检测其抗原结合活性,发现sdAb-Mcs在pH 2~10时均具备较好的结合活性,在pH 11时仍保持部分结合活性,而在pH 2时显示出最佳的结合活性。这些结果表明,sdAb-Mcs具有较宽泛的pH耐受范围,sdAb-Mcs能够在极低pH下保持最佳的抗原结合活性,而在极碱性条件(pH 11)开始失去抗原结合活性。同时,比较单价和双价sdAb-Mcs的pH耐受性发现,二者没有明显的差异,表明构建二价抗体没有影响sdAb-Mcs的pH耐受特性。
为了比较分析单价与双价sdAb-Mcs的抗原亲和特性,本研究进行竞争ELISA和病原捕获分析试验。竞争ELISA结果显示,二价sdAb-Mcs具有更高的M蛋白多克隆抗体竞争活性,表明二价sdAb-Mcs比单价sdAb-Mcs具有更高的抗原亲和活性。病原捕获试验也证实二价sdAb-Mcs比单价sdAb-Mcs具有更高的病原捕获活性。这些结果表明可以通过构建二价抗体的方式来提高sdAb的抗原亲和性。
本研究发现构建二价抗体并没有影响sdAb-Mcs的温度和pH耐受性,并证实 sdAb-Mcs在30~70 ℃和pH 2~10 条件下,均具备较好的抗原结合活性;进一步分析证实,构建的双价抗体具备更好的多克隆抗体竞争活性和抗原捕获活性,这些结果表明构建二价抗体可以提高sdAb的抗原亲和性;本研究为建立高度敏感和特异的PEDV检测方法提供廉价的材料基础,同时也为sdAb的有效应用提供更多思路。
