慈菇消脂丸对非酒精性脂肪性肝病大鼠NF-κB和iNOS表达的影响*
2019-07-19马燕花杨少军白洲霞邱晓青
马燕花,杨少军,师 霞,白洲霞,邱晓青
(1.甘肃中医药大学,甘肃 兰州 730101; 2.北海市中医医院,广西 北海 536000;3.甘肃中医药大学附属医院,甘肃 兰州 730000)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病机制复杂,涉及脂代谢紊乱、胰岛素抵抗、肝脂质过氧化增加、细胞因子异常等多个相互关联的病理生理环节,但均可纳入Day和Tames于1998年提出的“二次打击”学说[1]。第一次打击以胰岛素抵抗为主;第二次打击以氧化应激及炎性反应为主,在NAFLD的疾病进展中起到重要作用[2-3]。过度蓄积的游离脂肪酸(free fatty acid, FFA)发生脂质过氧化,产生大量的活性氧,导致肝组织核转录因子kappa B(nuclear factor-κB, NF-κB)的活化和表达增强,最终引发肝细胞氧化应激损伤和脂性凋亡[4-5]。本研究通过高脂饮食建立NAFLD大鼠模型,用慈姑消脂丸进行干预,检测肝组织NF-κB和NF-κB诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达,探讨慈姑消脂丸对NAFLD的作用及机制。
1 材料与方法
1.1 动 物
SPF级雄性Wistar大鼠60只,体质量(200±20)g,由甘肃中医药大学动物实验中心提供,动物许可证号:SCXK(甘)2015-0002。适应性喂养1周,饲养于甘肃中医药大学实验动物中心,室内温度(22±2)℃,湿度50%~ 60%,12 h光照维持,昼夜循环,自由摄食饮水,普通饲料喂养。本实验遵循甘肃中医药大学实验动物中心实验动物使用管理规定,并通过甘肃中医药大学动物伦理委员会批准,伦理编号:2015-0361。
1.2 药品、试剂与仪器
慈菇消脂丸处方组成:山慈菇、法半夏、茯苓、柴胡、丹参、土鳖虫、薏苡仁、黄芩、泽泻、枸杞、生山楂等14味中药。中药材由甘肃中医药大学附属医院制剂中心提供,委托甘肃中医药大学附属医院制剂室的王晓莉主任药师鉴定为正品。制剂以水为溶媒提取(正交实验)再浓缩,将不适合提取的药物进行粉碎,加入到浓缩液中,制成半浓缩型水丸,规格60 g/瓶,每丸质量0.135 g,相当于生药材0.252 g。盐酸吡格列酮片,规格15 mg,7片/盒,北京太洋药业股份有限公司产品,批次号161101。高脂饲料(普通饲料+15%猪板油+2%胆固醇+5%蛋黄粉+0.5%胆酸钠)、普通饲料(总热量15.335 J/g,其中碳水化合物热卡占53%,脂肪热卡占9%,蛋白质热卡占20%),均由北京科澳协力饲料有限公司提供,真空包装成10 kg/袋。丙氨酸氨基转移酶(ALT)试剂盒(批号13352801)、天冬氨酸氨基转移酶(AST)试剂盒(批号14640501)、总胆固醇(TC)试剂盒(批号13585401)、三酰甘油(TG)试剂盒(批号14854801),均购自于德国罗氏(Roche)诊断公司;焦碳酸二乙酯 (diethyl pyrocarbonate,DEPC), 购自Amresco公司,批号E174;Trizol(批号9109)、qPCR反应试剂盒(批号RR420A)、反转录试剂盒(批号RR047A),均购自日本Takara公司;兔抗大鼠β-actin抗体(批号ab8227)、兔抗大鼠NF-κB抗体(批号ab32360)、兔抗大鼠iNOS抗体(批号ab15323),均购自Abcam公司;大范围蛋白定量试剂盒,购自Sigma公司,批号93736;蛋白Marker,购自Thermo公司,批号26634。Alcyon 300型全自动生化分析仪,美国雅培公司产品;AlphaImager 2200型凝胶成像分析系统,美国Alpha公司产品;Mx3005P型实时定量PCR扩增仪,美国Agilent公司产品;PowerPac Universal型电泳仪、Mini Protean 3 Cell型电泳槽,伯乐小型Trans-Blot转印槽,均为美国Bio-Rad公司产品;VANOXAHB-LB型OLYMPUS万能显微镜,日本OLYWPUS公司产品;HITACHI-HS500透射电镜,日本HITACHI公司产品。
1.3 模型的建立与分组
参照文献[6]方法,采用高脂饲料喂养制备NAFLD模型。取Wistar大鼠60只,以基础饲料适应性喂养1周后,按体质量编号,以随机数字表法随机分为正常对照组(10只)和造模组(50只)2组。正常对照组给予普通饲料喂养,造模组给予高脂饲料喂养,至第12周末造模结束,通过肝脏的病理变化确定造模成功与否。模型复制成功的标准如下。肉眼观察:造模组大鼠肝脏明显肿大,呈黄色缺血状。HE染色、镜下观察:造模组大鼠肝小叶结构破坏;肝细胞弥漫性脂肪变性,脂滴大小不等,部分融合为大脂滴,界限不清;肝索紊乱,少数可见点状坏死,碎屑状坏死和炎性细胞浸润。将造模成功大鼠随机分为模型对照组,慈菇消脂丸高、中、低剂量组,盐酸吡格列酮片组,每组10只,开始灌胃给药。慈菇消脂丸高、中、低剂量组依次灌胃慈菇消脂丸水煎剂6.48,3.24,1.62g/kg体质量,盐酸吡格列酮片组灌胃盐酸吡格列酮片1.35g/g体质量,正常对照组和模型对照组每日灌胃等容量的生理盐水。灌胃体积为10 μL/g体质量,1 d 1次。连续灌胃给药6周。
1.4 检测指标
灌胃结束后,动物禁食24 h,次日用质量分数30 g/L的戊巴比妥钠行腹腔注射麻醉,下腔静脉取血,分离血清用于测定生化指标;收集肝脏标本,经冷生理盐水清洗后铝箔包裹置于液氮内速冻,保存于-80 ℃冰箱。采用逆转录-聚合酶链反应(RT-PCR)法测定iNOS mRNA表达,Western-Blot法测定NF-κB、iNOS蛋白表达水平。
1.4.1 肝功能与血脂
使用全自动生化分析仪测定血清ALT、AST、TC、TG、低密度脂蛋白胆固醇(LDL-C)活性。
1.4.2 iNOS mRNA表达
采用Real-time PCR。取约100 μg肝组织,用Trizol法提取总 RNA,经超微量分光光度计测定样品的质量分数(μg/L)。检测 A260/A280的比值在1.8~2.1,提示RNA质量较好。取1 μg RNA样品用于合成cDNA。按照Real-time PCR试剂盒说明对iNOS进行PCR扩增,iNOS mRNA检测所需引物根据标准Real-time PCR引物设计原则,由大连宝生物工程有限公司设计并合成,见表1。反应条件:95 ℃预变性30 s后,开始40个循环的PCR反应(95 ℃,10 s;60 ℃,20 s;72 ℃,20 s),溶解曲线制备60 ℃-95 ℃,0.5 ℃/s。靶基因相对表达量用 2-ΔΔct计算。

表1 iNOS基因Real-time PCR检测引物序列
1.4.3 NF-κB、iNOS蛋白表达
采用Western-Blot法检测。取20 mg左右冷冻的肝脏组织样本,剪碎,加入RIPA组织裂解液提取各组肝组织总蛋白,每个样本取出20 μL蛋白液进行蛋白定量,定量后每个泳道上样20 μL于SDS-PAGE,电泳后转至PVDF膜,取出PVDF膜,封闭结束后,将膜置于按1∶1 000稀释的一抗溶液中,4 ℃摇床轻摇孵育12 h,然后转入按1∶5 000稀释的二抗溶液中,室温摇床孵育120 min。等比例混合ECL化学发光液,均匀滴加在清洗完毕的PVDF膜表面,以保鲜膜包覆封装后放置于暗盒中,在暗室中显影曝光。
1.4.4 肝组织形态学
取部分肝组织用40 g/L多聚甲醛固定,常规制备组织石蜡切片,HE染色,光镜观察。
1.5 统计学方法

2 结 果
2.1 各组大鼠肝功能和血脂对比
与正常对照组对比,模型对照组大鼠血清ALT、AST、TC、TG、LDL-C水平明显升高,差别有统计学意义(P<0.01)。与模型对照组对比,慈菇消脂丸高、中剂量组大鼠血清ALT、AST、TC、TG、LDL-C水平降低 (P<0.01);慈菇消脂丸低剂量组大鼠血清ALT、AST、TC、TG均明显降低(P<0.01),LDL-C活性无显著变化(P﹥0.05);盐酸吡格列酮片组大鼠血清ALT、AST、TC、TG、LDL-C活性明显降低(P<0.05)。见表2。
表2各组大鼠肝功能和血脂对比
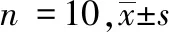
组 别剂量/(g·kg-1)ALT/(U·L-1)AST/(U·L-1)TC/(mmol·L-1)TG/(mmol·L-1)LDL-C/(mmol·L-1)正常对照组11.92±0.9760.50±10.331.36±0.230.62±0.380.29±0.15模型对照组98.63±64.15∗∗130.63±54.99∗∗1.87±0.32∗∗1.44±0.75∗∗0.67±0.15∗∗盐酸吡格列酮片组0.001 3547.13±10.21##74.20±25.13##1.47±0.36#0.86±0.38##0.43±0.23#慈菇消脂丸高剂量组6.4836.80±10.27##59.00±5.66##1.18±0.42##0.75±0.46##0.30±0.14##慈菇消脂丸中剂量组3.2445.43±18.30##71.67±29.79##1.39±0.51##0.65±0.31##0.12±0.24##慈菇消脂丸低剂量组1.6234.62±8.00##80.00±25.67##1.09±0.32##0.76±0.42##0.51±0.26
注:与正常对照组对比,** P<0.01;与模型对照组对比, # P<0.05, ## P<0.01
2.2 各组大鼠肝组织iNOS mRNA表达对比
模型对照组大鼠肝组织中iNOSmRNA的水平明显高于正常对照组,差别有统计学意义(P<0.01)。与模型对照组对比,慈菇消脂丸低、中、高剂量组及盐酸吡格列酮片组中iNOSmRNA的水平均显著下降(P<0.01)。慈茹消脂丸各剂量组与盐酸吡格列酮片组对比,差别无统计学意义(P>0.05)。见表3。
2.3 各组大鼠肝组织NF-κB、iNOS蛋白表达对比
与正常对照组对比,模型对照组大鼠肝组织NF-κB、iNOS蛋白表达增加,差别有统计学意义(P<0.01)。与模型对照组对比 ,慈菇消脂丸高、中剂量组和盐酸吡格列酮片组大鼠肝组织NF-κB、iNOS蛋白表达均显著降低(P<0.01);慈菇消脂丸低剂量组大鼠肝组织NF-κB蛋白表达显著降低(P<0.01),但iNOS蛋白表达无显著变化(P﹥0.05)。慈菇消脂丸高剂量组在下调NF-κB蛋白表达方面作用优于盐酸吡格列酮片组,差别有统计学意义(P<0.01)。见表4、图1。
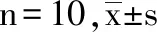
组 别剂量/(g·kg-1)iNOS mRNA 正常对照组0.14±0.03模型对照组1.00±0.00∗∗盐酸吡格列酮片组0.001350.32±0.11##慈菇消脂丸高剂量组6.480.44±0.38##慈菇消脂丸中剂量组3.240.30±0.18##慈菇消脂丸低剂量组1.620.27±0.03##
注:与正常对照组对比,** P<0.01;与模型对照组对比,## P<0.01
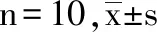

组 别剂量/(g·kg-1)NF-κB/β-actin/蛋白相对表达量iNOS/β-actin/蛋白相对表达量正常对照组0.30±0.080.05±0.02模型对照组0.94±0.09∗∗0.48±0.02∗∗盐酸吡格列酮片组0.001350.21±0.01##0.07±0.03##慈菇消脂丸高剂量组6.480.01±0.00##△△0.13±0.07##慈菇消脂丸中剂量组3.240.33±0.04##0.34±0.02##慈菇消脂丸低剂量组1.620.39±0.10##0.38±0.06
注:与正常对照组对比,**P<0.01;与模型对照组对比,##P<0.01;与 盐酸吡格列酮片组对比,△△P<0.01
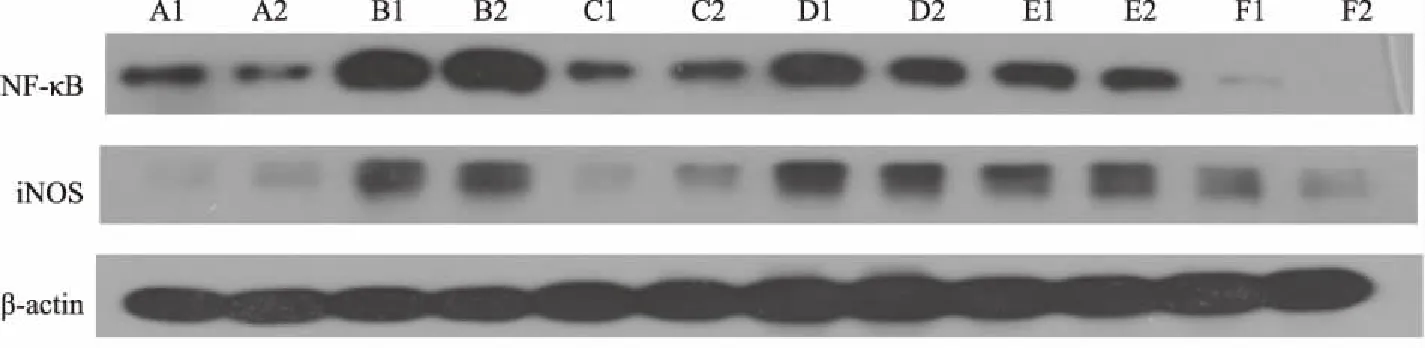
A.正常对照组;B.模型对照组;C.盐酸吡格列酮片组;D.慈菇消脂丸低剂量组;E.慈菇消脂丸中剂量组;F.慈菇消脂丸高剂量组图1 各组大鼠肝组织NF-κB、iNOS蛋白表达
2.4 各组大鼠肝脏病理组织学对比
正常对照组大鼠肝小叶结构完整,肝索、肝窦分布正常,肝细胞形态一致。模型对照组大鼠肝被膜增厚,肝细胞弥漫性水肿和脂肪变性,间质少量纤维组织增生。慈菇消脂丸各剂量组大鼠肝小叶结构基本正常,高、中剂量组肝小叶内肝细胞散在脂肪变性;低剂量组局灶性肝细胞水肿、变性,少量炎性细胞浸润。盐酸吡格列酮片组大鼠肝小叶结构基本正常,肝细胞散在脂肪变性,少量炎性细胞浸润。见图2。

A.正常对照组;B.模型对照组;C慈菇消脂丸高剂量组;D.慈菇消脂丸中剂量组;E. 慈菇消脂丸低剂量组;F.盐酸吡格列酮片组图2 各组大鼠肝脏病理组织学对比(HE,×200)
3 讨 论
研究[7-8]表明,脂肪酸及其代谢产物过度沉积在肝脏及血管内皮细胞等非脂肪组织可以造成NAFLD和血管功能障碍等疾病。其中FFA是引起脂毒性的重要介质,FFA诱导的脂毒性在NAFLD发病机制中发挥着中枢性作用[9]。NAFLD中存在高游离脂肪酸血症,可促进胰岛素抵抗、脂质过氧化反应,进而使活性氧水平上升,导致NF-κB的活化和表达增强,最终引发炎症反应[10]。同时,NF-κB还可激活肝脏枯否细胞,释放大量活性氧,并增强氧化应激,加重肝脏的炎症反应和损伤[11]。
NF-κB是一种转录调控因子,1986年由Sen和Baltimore 首先发现广泛存在于真核细胞中,通过调节免疫、炎症递质的表达和炎症相关因子,在氧化应激、免疫反应、肝组织的炎性反应、肝细胞凋亡中起重要作用[12-13]。NF-κB最常见的形式是由p50与p65亚基组成的异二聚体。生理状态下,NF-κB与抑制因子IκB单体偶联,以无活性的形式存在于细胞质中。在炎症、缺血缺氧、肿瘤、毒素等多种刺激下,IκB磷酸化后降解,NF-κB二聚体与 IκB 分离,NF-κB得以由胞质转移到核内与靶基因序列上特定的结合位点结合,启动或调节基因转录,诱导iNOS的过量表达[14]。高表达的iNOS产生高浓度的NO,NO可通过多种机制导致DNA损伤。
NAFLD属中医学“肥气”“癥积”“痰浊”范畴。长期嗜食肥甘厚味,饮酒过度;或久卧久坐,体丰痰盈;或七情内伤,调摄失当;或因不慎感受湿热疫毒,使脾失运化,肝失疏泄,以致水谷不能化为精微,聚而为湿为痰,化为湿浊脂毒,阻于肝络,客于肝脏而形成本病。此符合中医学“浊毒致病”学说[15]。慈菇消脂丸是课题组自拟的中药处方。方中山慈菇起化痰解毒、消脂散结的作用,泽泻、山楂祛脂化浊,丹参、土鳖虫逐瘀通络,柴胡、黄芩、法半夏疏肝理脾,决明子清肝降脂。整个组方立法以解毒化痰、消降浊脂为主。课题组前期的研究[16]表明:NAFLD大鼠肝组织中iNOS和NO的表达量显著增加;采用慈菇消脂丸干预后,模型大鼠肝组织脂肪变性程度明显减轻,iNOS和NO表达量显著下降。同时,课题组另一项研究表明,NAFLD大鼠肝组织中NF-κB表达显著增加,且通过线粒体细胞凋亡途径介导肝细胞凋亡,慈菇消脂丸对其有干预效应,但慈菇消脂丸是否通过NF-κB信号通路活化iNOS从而干预NAFLD肝细胞脂性凋亡尚不清楚。
本实验通过高脂饮食建立NAFLD大鼠模型,给予不同剂量慈菇消脂丸干预,以盐酸吡格列酮片作为阳性对照。结果显示:大鼠造模12周出现严重的肝脂肪变性,少量纤维化及肝细胞凋亡。模型对照组大鼠血清ALT、AST、TC、TG、LDL-C均显著高于正常对照组(P<0.01),除慈菇消脂丸低剂量组对LDL-C表达无影响外,慈菇消脂丸中、高剂量组及吡格列酮片组大鼠血清ALT、AST、TC、TG、LDL-C均显著低于模型对照组(P<0.05)。结果表明:造模后NAFLD大鼠血清中的脂质水平显著增高,给予慈菇消脂丸灌胃能显著改善肝功能、降低血脂,具有治疗脂肪肝的作用。同时,模型对照组大鼠比正常对照组NF-κB、iNOS水平均明显升高(P<0.01);慈菇消脂丸高、中剂量组及吡格列酮片组均能显著降低NF-κB、iNOS蛋白表达(P<0.01),且慈菇消脂丸高剂量组在降低NF-κB蛋白方面作用明显优于盐酸吡格列酮组(P<0.01)。上述结果说明,慈菇消脂丸具有改善肝功能、降低血脂作用,其作用机制与调控NF-κB/iNOS信号通路相关蛋白表达有关。
