内生枯草芽孢杆菌265ZY4对温度和紫外光胁迫下紫花针茅生化特征的影响
2019-07-17杨成德崔月贞冯中红薛莉金梦军
杨成德,崔月贞,冯中红,薛莉,金梦军
(1.甘肃农业大学植物保护学院,甘肃 兰州730070;2.甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州730070)
植物内生细菌(Endophytic bacteria)不仅将植物作为其栖息场所,也能通过合成或促使植物合成如生长素和细胞分裂素等多种植物生长激素促进根系吸收水分和养分从而促进植物生长[1],如秦娟娟等[2]报道,经内生细菌处理的辣椒(Capsicum annuum)株高、根长、鲜重和干重均显著高于对照,其中干重增加率为109.03%~140.63%,张芳芳等[3]报道内生细菌对植物株高和根长有显著促进作用;另外,内生细菌主要通过影响宿主植物的物质代谢,形成生理活性物质来改变植株的生理特性,从而提高植物的抗逆性,如Bin等[4]报道在禾本科植物芒草(Miscanthus sinensis)上接种内生固氮菌能减少盐胁迫的伤害,提高芒草的耐盐性;罗达等[5]报道接种内生固氮菌的植株叶内酶活性明显高于未接菌植株,提高了多枝柽柳(Tamarix ramosissima)植株在水盐胁迫条件下的适应能力和根系活力。因此,内生细菌可以有效改善植物对营养物质的吸收和利用效率,并可以通过影响植物的生理生化特性来增加植物的抗胁迫能力。
紫花针茅(Stipa capillata)是高寒草甸类草地的优势牧草之一,为多年生旱生草本植物,分布于我国华北、西北、青藏高原等地,特别是高寒草地的主要建群种[6],其可以在高寒草地低温和强紫外线等逆境条件下生存,这种抗逆能力是否与其内生细菌有关?内生细菌265ZY4菌株分离自东祁连山紫花针茅叶片,为枯草芽孢杆菌(Bacillus subtilis),在离体条件下具有溶解无机磷和产吲哚乙酸(indole acetic acid,IAA)能力,且对多种植物病原真菌有较好的拮抗效果[7],但这些生物功能对宿主紫花针茅的抗逆能力有怎样的影响并不明确。因此,本研究建立不带内生细菌的紫花针茅种群,并回接265ZY4菌株,选择与高寒草地生境相似的低温(4℃)和紫外线等胁迫,测定叶绿素、可溶性蛋白、可溶性糖的含量及超氧化物歧化酶(superoxide dismutase,SOD)和苯丙氨酸解氨酶(phenylalanine ammonia-iyase,PAL)的活性,以期明确内生细菌265ZY4对逆境胁迫下紫花针茅生化特征的影响,为揭示内生细菌的生物学功能及机制提供依据。
1 材料与方法
1.1 材料
供试内生细菌:内生枯草芽孢杆菌265ZY4由本课题组分离自高寒草地优势牧草紫花针茅叶片,保存于甘肃农业大学植物保护学院植物病原细菌及细菌多样性实验室。
1.2 方法
1.2.1 不带内生细菌紫花针茅种群培育和胁迫方法 2016年6月挑选籽粒饱满、均一的紫花针茅种子,用0.1%升汞处理10 min,后用20%次氯酸钠处理30 min,再温汤浸种30 min,后置于水琼脂培养基上催芽,选取萌芽一致并不带菌的种子,播种于装有营养一致的无菌营养土的50孔塑料育苗盘内,置于控温光照智能培养箱内,光照强度为5000 lx,周期为12 h/12 h(昼/夜),根据土壤湿度浇水,除高、低温胁迫时间外均为25℃,待幼苗株高10 cm左右时,每孔灌根接种108cfu·g-1的内生细菌菌液(将内生细菌发酵液5000 r·min-1离心10 min后收集菌体并用无菌水配制)2 m L,以接等量清水为对照;15 d后对紫花针茅进行低温(4℃)、高温(40℃)和紫外线胁迫,每天4 h,在10:00-14:00进行;3次重复;紫外线胁迫为将幼苗置于紫外光光照智能培养箱内,紫外灯灯管距离幼苗50 cm,于254 nm紫外光下4 h,其他时间正常管理;对照为不接种内生细菌,其他同处理。
1.2.2 测定指标及方法 接菌处理后25 d随机选择30株紫花针茅测定株高和叶宽并计算平均值。
于第0、2、4、6和8天下午胁迫后1 h(下午3点)分别采集15株紫花针茅地上部分为样品进行生理生化指标测定,3次重复。叶绿素含量采用SPAD-502叶绿素测定仪测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[8];可溶性糖含量采用蒽酮比色法测定[9];超氧化物歧化酶活性采用四唑氮蓝NBT光化还原法测定[9];苯丙氨酸解氨酶活性参照高峻凤[10]的方法测定。
1.3 数据处理
采用Excel 2007和SPSS 19.0统计软件分析数据,作图时以对照为纵坐标0,相对对照增加在横坐标轴上方区域,降低在横坐标轴下方区域;采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 内生细菌对紫花针茅株高和叶宽的影响
带菌紫花针茅株高和叶宽分别为14.15和1.32 cm,较对照分别增加35.02%和34.69%(表1),说明内生细菌265ZY4对紫花针茅具有明显的促生作用。

表1 内生细菌265ZY4对紫花针茅株高和叶宽的影响Table 1 Effects of endophytic bacterium 265ZY4 on plant height and leaf width of S.purpurea(cm)
2.2 内生细菌对紫花针茅叶绿素含量的影响
在低温胁迫下第2和4天时带菌紫花针茅叶绿素含量比处理前分别增加了7.4%和1.5%,而对照第2和4天比胁迫前分别下降了4%和11%,但第8天时带菌与对照均下降了43.7%和44.8%,差异不显著(图1A);在高温胁迫下第2、4和6天时带菌紫花针茅叶绿素含量比处理前分别增加了36.6%、11.1%和10.2%,而对照第2、4和6天时分别比胁迫前下降了5.6%、11.3%和38.1%,但第8天时带菌与对照分别下降17.0%和44.0%,处理和对照差异显著(P<0.05)(图1B);在紫外线胁迫下,带菌和对照均下降,第2天时分别下降10.0%和24.0%,差异显著(P<0.05),之后带菌处理与对照差异不显著(图1C)。该结果表明紫花针茅在胁迫期间叶绿量含量均下降,但除紫外线胁迫外带菌紫花针茅叶绿素含量胁迫前期增长,后期下降,但下降率低于对照。

图1 在低温(A)、高温(B)和紫外线(C)胁迫下紫花针茅叶绿素含量的变化率Fig.1 Change ratio of chlorophyll contents of S.purpurea after low temperature(A),high temperature(B)and ultraviolet stress(C)
2.3 内生细菌对紫花针茅可溶性蛋白的影响
紫花针茅可溶性蛋白受低温、高温和紫外光胁迫后均上升,除带菌紫外线胁迫外均在第6天达到最高,之后迅速下降;第2天时带菌与对照变化率差异显著(P<0.05),但之后除紫外线胁迫第6天变化率差异变小外,第8天时基本一致(图2)。

图2 低温(A)、高温(B)和紫外线(C)胁迫下紫花针茅可溶性蛋白的变化率Fig.2 Change ratio of soluble protein contents of S.purpurea after low temperature(A),high temperature(B)and ultraviolet stress(C)
2.4 内生细菌对紫花针茅可溶性糖的影响
在低温胁迫下带菌紫花针茅可溶性糖呈先上升后下降趋势,第4天达最大值,为5.20μg·g-1FW,对照呈下降趋势,第2天为最大值,为4.81μg·g-1FW,对照和带菌间差异显著(P<0.05);高温胁迫下处理和对照均为第2天达最大值,分别为9.38和10.65μg·g-1FW,之后下降,第2、4和6天差异显著(P<0.05);在紫外线胁迫下,对照可溶性糖呈现先上升后下降趋势,第6天时最高,为5.10μg·g-1FW,比处理前上升了46.2%,第8天时明显下降,仅比处理前增长3.0%;带菌紫花针茅可溶性糖在第2天时下降了7.3%,之后上升,第6天时达到最大值6.21μg·g-1FW,比处理前增加了74.9%,第8天时开始下降,但比处理前增加33.5%(图3)。

图3 低温(A)、高温(B)和紫外线(C)胁迫下紫花针茅可溶性糖的变化率Fig.3 Change ratio of soluble sugar contents of S.purpurea after low temperature(A),high temperature(B)and ultraviolet stress(C)
对照在低温、高温和紫外线胁迫下第2天均显著高于带菌处理(P<0.05),之后除紫外线胁迫外均下降;带菌紫花针茅在低温和紫外线胁迫下第2天后继续上升,分别在第4和6天达到最大值。该结果说明紫花针茅内生细菌265ZY4在第2天后对宿主紫花针茅可溶性糖有促进作用。
2.5 内生细菌对紫花针茅超氧化物歧化酶(SOD)的影响
在低温和高温胁迫下,带菌紫花针茅和对照超氧化物歧化酶活性均呈现为胁迫后快速下降,第2天后酶活性又上升,至第6天达到最高,分别为298.56和299.22 U·g-1FW,第8天下降到最小值;在低温胁迫下除第6天外,带菌紫花针茅变化率显著小于对照(P<0.05);高温胁迫下除第8天外,带菌紫花针茅和对照变化率差异不显著,但第6天酶活性高于处理前,且带菌紫花针茅高于对照;在紫外线胁迫下,带菌紫花针茅呈先下降后上升趋势,第8天时酶活性最高,为302.5 U·g-1FW,而对照第6天后开始下降,且带菌紫花针茅SOD活性变化率除第8天外均显著低于对照(P<0.05)(图4)。总体看,对照和带菌紫花针茅(除带菌紫外线胁迫外)均为第6天变化率位于相对较高位置,且带菌紫花针茅变化率小于对照;但是,带菌紫花针茅在紫外线胁迫下呈持续上升趋势,且第6天酶活性低于胁迫前,第8天达最大值,而对照第2天低于胁迫前,第6天达到最大值,之后下降。

图4 低温(A)、高温(B)和紫外线(C)胁迫下紫花针茅SOD活性的变化率Fig.4 Change ratio of SOD activity of S.purpurea after low temperature(A),high temperature(B)and ultraviolet stress(C)
2.6 内生细菌对紫花针茅苯丙氨酸解氨酶(PAL)的影响
在低温、高温和紫外线胁迫下,带菌紫花针茅和对照苯丙氨酸解氨酶活性变化率均呈先上升后下降的趋势(图5);带菌紫花针茅和对照受低温胁迫后PAL活性升高,第4天时PAL活性分别达到最高值368.9和302.4 U·g-1·min-1,胁迫第8天时带菌紫花针茅和对照PAL活性均下降,但对照下降率高于带菌植株(图5A);紫花针茅PAL活性受高温和紫外线胁迫后呈先降低后升高,再下降的趋势,高温胁迫第6天时PAL活性达到最高,对照和处理分别为295.3和290.2 U·g-1·min-1,而紫外线胁迫下对照第4天达到最大值,为277.1 U·g-1·min-1,处理第6天达到最大值,为294.1 U·g-1·min-1,第8天最低(图5C)。
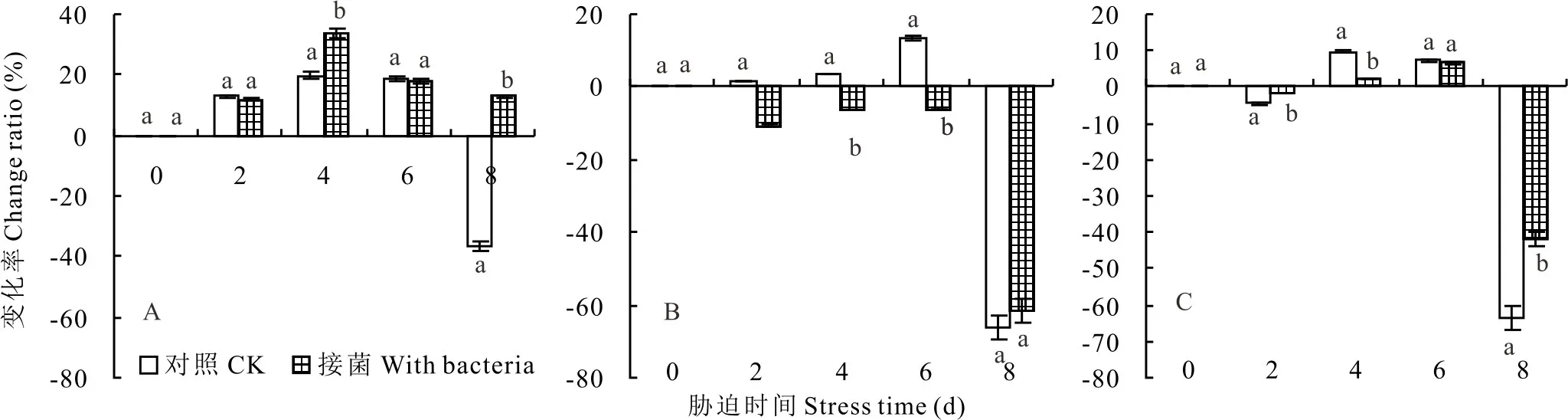
图5 低温(A)、高温(B)和紫外线(C)胁迫下紫花针茅PAL活性的变化率Fig.5 Change ratio of PAL activity of S.purpurea after low temperature(A),high temperature(B)and ultraviolet stress(C)
3 讨论与结论
植物内生细菌通过其固氮、抑菌及产生生物活性物质等生物功能,增强宿主植物的抗病性、抗虫性、抗旱性和提高生长竞争能力等[11]。本研究中,紫花针茅接种内生枯草芽孢杆菌265ZY4后株高和叶宽比对照分别增加35.02%和34.69%,这可能与该菌株在离体条件下具有溶磷、产IAA和抑菌等生物学功能[7]有关;该结果也与Narendra等[12]报道的番茄(Lycopersicon esculentum)内生细菌研究结果相一致。在低温胁迫下,植物叶片的叶绿素降解是一个普遍现象[13],而干旱抑制叶绿素生物合成酶的活性从而阻碍叶绿素的合成[14],紫外线破坏植物叶绿体前体的形成和叶绿体整体结构,降低叶绿素含量[15];本试验结果表明,在低温和高温胁迫下带菌紫花针茅叶绿素含量先上升后下降,而对照呈持续下降趋势,紫外线胁迫下带菌和对照均呈下降趋势,但接种内生细菌的紫花针茅叶绿素含量高于对照,下降率低于对照,表明高、低温和紫外线胁迫对紫花针茅叶绿素含量有明显的破坏作用,但内生细菌可能通过代谢产物保护宿主叶绿素或促进了宿主叶绿素的合成,进而使带菌植株叶绿素含量高于对照,提高了抗逆能力,具体是何机制还需进一步研究。
可溶性蛋白和可溶性糖作为植物体内重要的渗透调节物质,在植物抗逆性中起到调节作用[16]。本试验中,可溶性蛋白和可溶性糖随着胁迫时间呈先上升再下降的趋势,与孙富等[17]和杨盛等[18]的报道一致,但杨玉珍等[19]报道,低温胁迫下香椿(Toona sinensis)可溶性蛋白质含量呈现“升高-降低-再升高”趋势,本试验中可能在于胁迫时间不够长未能观察到蛋白含量上升的趋势;在温度胁迫下带菌紫花针茅可溶性糖含量在第4天后显著高于对照,特别是在紫外线胁迫下第6天后显著高于对照,说明内生细菌处理提高了宿主体内的可溶性糖含量,但在逆境胁迫下可溶性蛋白含量与对照差异不明显,说明内生细菌在温度胁迫中期和紫外线胁迫后期保持了可溶性糖的含量,提高了细胞的渗透压,从而缓解逆境条件对植物的伤害,起到增强紫花针茅抗逆性的作用。低温下可溶性糖较高温下稳定,且紫外线胁迫下最高峰出现较晚,这可能与宿主本身为高寒草地牧草,对低温和紫外线胁迫本身有较高耐性有关,但具体机制需进一步研究。
SOD等抗氧化酶可以清除逆境胁迫下植物细胞内积累的活性氧,减缓细胞膜脂质的过氧化[20]。本试验中,紫花针茅SOD活性随着胁迫时间的延长,呈降低-升高-降低的规律,但波动不大,表明温度和紫外线胁迫对紫花针茅SOD活性的影响小;接种内生细菌265ZY4的紫花针茅在温度胁迫下SOD活性始终高于对照,但紫外光胁迫下SOD活性初期下降明显,显著低于对照,后上升,第8天时显著高于对照,表明内生细菌可以提高宿主SOD活性,提高其抗逆能力。
苯丙氨酸解氨酶(PAL)是类黄酮合成代谢与苯丙烷类代谢途径过程中的限速酶和关键酶,类黄酮在减轻和消除由干旱、紫外线等胁迫引起的活性氧伤害方面,发挥直接或间接的作用[21]。本试验结果表明紫花针茅PAL活性随着低温胁迫时间的延长呈先上升再下降的趋势,这与陈雷等[22]研究结果一致,但在高温和紫外线胁迫下呈下降-上升-下降的规律,低温胁迫第4天达最大值,高温和紫外线胁迫第6天时PAL活性达到最高;在低温和紫外线胁迫下接种内生细菌的紫花针茅PAL活性高于对照,且在低温胁迫后期PAL活性下降的速度比对照减小1.3倍;该结果表明内生细菌可有效地保持或提高PAL活性,增加次生化合物类黄酮等的合成,增强宿主对逆境胁迫的忍耐力。
从各种生化指标看,第2天时除可溶性蛋白质在高温胁迫、SOD在低温胁迫及PAL在紫外线胁迫外,对照与处理一致或高于处理,第2天之后带菌紫花针茅生化指标上升,第8天时带菌处理变化率除SOD紫外线胁迫外均大幅下降,且叶绿素和可溶性蛋白变化率与对照基本一致。该结果说明带菌紫花针茅生化指标对外界环境的变化反应滞后,且随胁迫时间增长生化指标上升,但较长时间胁迫后与对照没有区别,即内生细菌通过自身基因或影响植物体内酶活性[23]可以提高宿主的抗逆能力,但这种保护作用有一定限度。
