Sn2+掺杂硫化铜的制备及其性能
2019-07-16
(贵州师范大学 化学与材料科学学院,贵州省功能材料化学重点实验室,贵州 贵阳 550001)
1 引 言
CuS作为一种硫属半导体材料,具有光致发光、可见光吸收等特殊性能,使其在传感器、催化剂、太阳能转化等方面备受关注[1]。特别地,由于CuS在近红外区具有较强的吸收可将近红外光转换为热能呈表现光热转换效应,使其在太阳能转化上有潜在的应用前景而成为研究的热点[2]。Liu等[3]对CuS的研究表明:硫化铜具有良好的光致发光性能和光热转换性能,但目前较低的光热转化效率是制约其在光热方面应用的重要因素之一,与DK Roper等[4]的研究结果相一致。CuS具有相对较低的光热转换效率是由于其具有相对较窄的带隙,容易形成空穴-电子对复合,导致其吸收的近红外光以光、热等形式消耗掉从而降低其光热转化效率[5]。为了降低CuS材料中空穴-电子对复合的机会,研究人员一方面试图通过改进制备技术获得具有特定微结构的CuS晶体从而提高其光热转换效率[6-7],另一方面试图通过离子掺杂进入CuS晶格而提高其性能[8],其中,金属离子掺杂硫化铜的研究吸引了研究人员的目光[9]。由于通过金属离子掺杂CuS,容易使其晶格发生畸变形成晶格缺陷,增加空穴-电子对的数量,降低晶格中空穴-电子对复合的相对几率从而提高其性能[10]。盛备备等[5]通过Cd2+掺杂CuS薄膜来提高其光催化能力。耿小红[9]通过Ag+掺杂CuS材料来提高其抑菌活性。上述研究证实适当的金属离子掺杂进入CuS晶格中有利于增加其光催化性能和抑菌活性。而目前关于金属离子掺杂CuS在光热转化性能方面的研究尚鲜有报道,同时由于Sn2+的电负性、荷电数和离子半径与Cu2+相近[11],使其容易掺杂进入CuS晶格而有望提高CuS晶格中空穴-电子对的数量进而提高CuS的光热转换性能。且比较常见的制备多层镀膜对太阳光选择性光热转换的技术[12],通过直接制备近红外光吸收材料进行光热转换具有工艺简单、成本更低等技术优点。为此,本研究开展了Sn2+掺杂CuS材料的制备并对其光热转化性能进行了研究。
2 实验部分
2.1 样品的制备
实验所使用的氯化铜(CuCl2·5H2O)、硫脲[(NH2)2CS,Tu]、氯化亚锡(SnCl2)、聚乙烯吡咯烷酮(PVP-K30)、氢氧化钠(NaOH)和无水肼(N2H4)均为分析纯试剂。
以制备Sn2+掺杂量为5%(摩尔分数)的CuS样品为例:按实验设计Cu2+与S2-的物质量之比为1∶17,准确量取5mL 0.5mol/L CuCl2溶液和0.0297g SnCl2粉末放入500mL三颈烧瓶中搅拌均匀,加入25mL去离子水和0.2430g PVP-k30继续搅拌;随后将6.4μL无水肼加入到混合液中,室温搅拌5min,再将37.6mL硫脲(1.1895mol/L)和0.008mol NaOH加入该混合液,继续搅拌均匀;然后将三颈烧瓶在60℃水浴下持续加热并搅拌4h;最后将混合液转入烧杯中在80℃水浴中静止3h。反应结束后,取出烧杯自然冷却至室温,在4000r/min的转速下离心分离收集黑色沉淀,分别用适量去离子水和无水乙醇洗涤样品3次后,在80℃下干燥4h得黑色待测样品。
为了考察NaOH的加入量、Cu2+与S2-的物质量之比、Sn2+的掺杂量及反应时间等合成条件对产物的光吸收性能的影响,采用单因素实验分别调节NaOH的加入量为0.006mol、0.007mol、0.008mol、0.009mol;将Cu2+与S2-的物质的量比设计为1∶1、1∶5、1∶9、1∶13、1∶17、1∶21;将Sn2+的掺杂量设计为1%、3%、5%、7%、9%;以及调节反应时间为2 h、4 h、6 h、8 h,对获得的不同产物进行检测分析。
2.2 样品的表征方法
采用D8 Advance型X射线衍射仪(XRD)对产品进行物相与结构检测;采用Nicolet iS5型傅里叶变换红外光谱仪(FITR)检测样品的化学键合分布情况;采用UV-2450型紫外-可见分光光度计(UV-Vis)测试样品的光吸收性质。
2.3 样品的光热转化实验
以60 W钨丝灯作为光源于室温下进行实验。具体实验过程如下:准确称取一定量的样品,加入到装有20mL去离子水的50mL烧杯中,置于暗箱中充分搅拌均匀。随后打开钨灯并计时,在磁力搅拌下进行光热转换实验,每隔5min测量烧杯中溶液的温度,并以去离子水作为空白样品进行对比实验。
3 结果与讨论
3.1 产品的X射线粉末衍射(XRD)分析
图1是在铜与硫的物质的量比为1∶17、Sn2+掺杂量为5%、NaOH的加入量为0.008 mol和反应时间为4 h的条件下所制备的硫化铜样品的XRD图谱。从图1中可以看出在2θ分别为27.7°、29.3°、31.8°、47.9°、59.3°等处呈现样品的衍射峰,分别属于六方晶系CuS的(101)、(102)、(103)、(110)、(116)晶面的衍射峰,与标准卡片(JCPDS NO.06-0464)的六方晶系CuS相吻合,另外没有观察到源于其他晶相的杂质衍射峰,说明所制备的是纯相六方晶系CuS晶体,少量的Sn2+掺杂并未对样品的晶体结构产生显著的影响。经过XRD图谱拟合,计算其晶胞参数a和c分别为3.792Å和16.344Å。
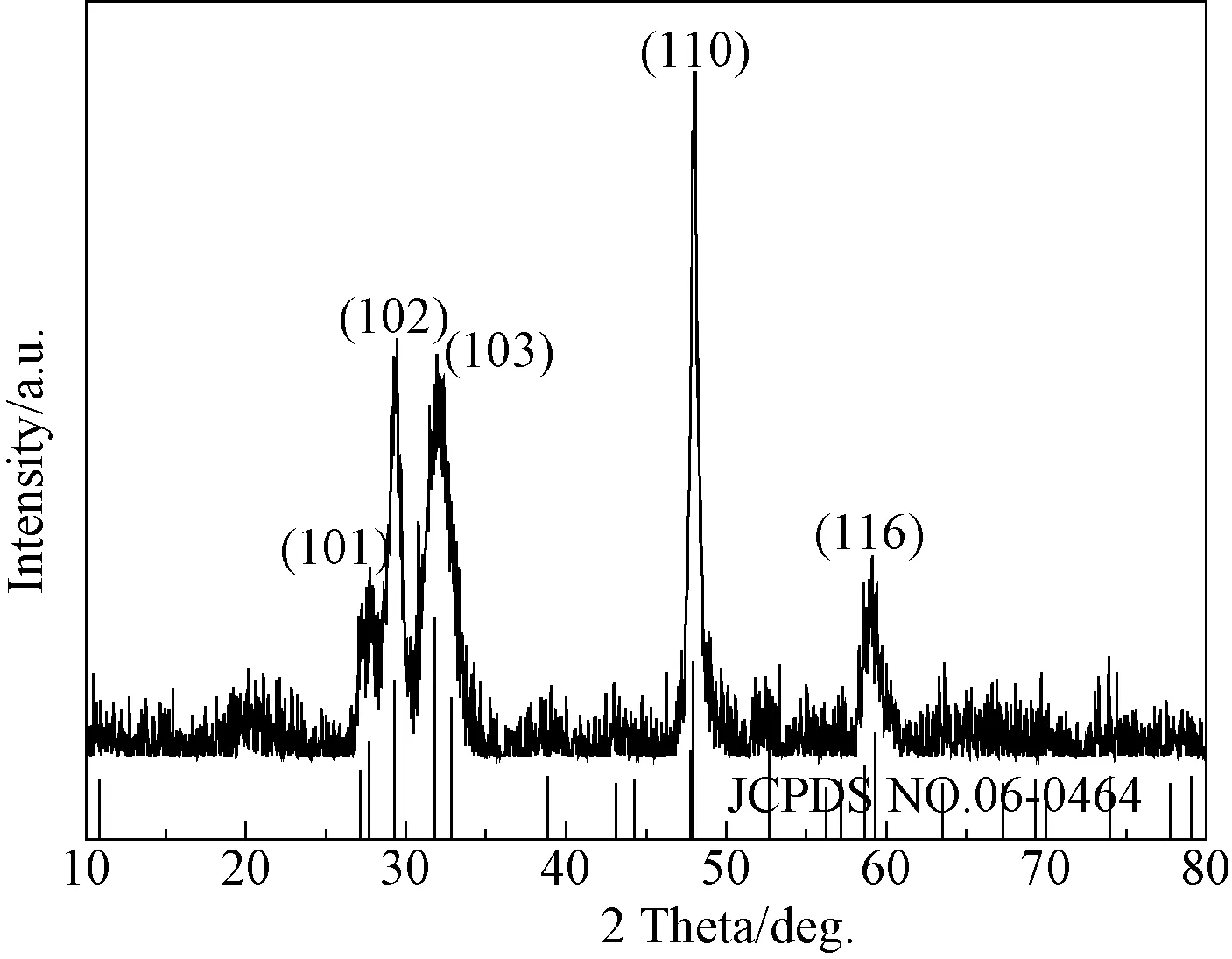
图1 制备CuS样品的XRD图谱Fig.1 XRD pattern of CuS sample
3.2 产品的傅里叶变换红外光谱(FTIR)分析

图2 制备CuS样品的FTIR图谱Fig.2 FTIR spectrum of the CuS sample
图2是在铜与硫的物质的量比为1∶17、Sn2+掺杂量为5%、NaOH的加入量为0.008 mol和反应时间为4 h的条件下所制备的硫化铜样品的红外光谱图。从图2中能明显地看到几个主要的吸收峰,其波数分别位于3445.55cm-1、3144.93cm-1、2349.11cm-1、1634.48cm-1、1383.59、1145.87cm-1和534.08cm-1处,其中1145.87cm-1对应Cu-S键的特征振动吸收峰[13],3445.55cm-1对应-OH键的弯曲振动吸收峰,这是由于样品吸附了水分子造成的[13]。3144.93cm-1对应NH2的特征振动吸收峰,这是由于未反应完的硫脲造成的[14]。在2349.11cm-1、1634.48cm-1和1383.59cm-1处出现的吸收峰为样品表面吸附CO2的C=O键的振动吸收峰[15]。此外,在534.08cm-1处出现的吸收峰可能是CuO的Cu-O键的拉伸振动吸收峰[16],由此可知有少部分样品已经被氧化,其稳定性不太理想。
3.3 紫外可见漫反射光谱分析
3.3.1铜和硫物质的量比对CuS光吸收性能的影响 图3为在物质的量比(n(Cu2+)∶n(S2-))不同的条件下所制备样品的紫外可见漫反射光谱图。从图3中可以看出,随着硫物质量比例的增加,其光吸收性能先增强后减弱,当铜与硫物质的量比为1∶17时,光吸收性能达到最强。不同铜和硫物质的量比对制备样品的光吸收性能具有明显的影响,其原因可能是在不同铜和硫物质的量比条件下形成CuS晶体的机制不同而导致制备样品的尺寸与形貌存在差异,从而影响样品的光吸收性能[17]。当铜与硫物质的量比为1∶1时,在强还原剂肼的作用下,反应体系中首先形成Tu-Cu(I)配合物,但该配合物在碱性条件下稳定性较差且反应体系中Tu浓度较低而易离解为Cu+,随后被氧化为Cu2+,而Cu2+则和Tu形成Tu-Cu(II)配合物作为先驱物[17],随后在反应过程中形成CuS晶体[18]。但当增加反应体系中硫脲的比例,即铜和硫物质的量比为1∶9、1∶13、1∶17和1∶21时,反应体系中Tu相对过量,而Tu具有一定还原性,使得反应体系中形成较稳定的Tu-Cu(I)配合物作为先驱物,在随后反应中发生氧化反应形成CuS晶体,与文献报道相一致[17-18]。在制备过程中也观察到,高硫比例的反应体系中随着硫脲(Tu)加入,反应体系先转变为白色混浊而后转变为无色透明溶液;而铜和硫物质的量比为1∶1条件下反应体系最终转变为白色混浊,制备实验现象的差异也从侧面证实在高硫比例的反应体系中所生成的配合物由Tu-Cu(II)转化为Tu-Cu(I)配合物[19-20]。

图3 铜与硫的不同物质的量比(n(Cu2+):n(S2-))条件下制备样品的紫外可见漫反射光谱图Fig.3 UV-Vis diffuse reflection spectra of the samples synthesized under different mole ratio of copper chloride to thiourea
3.3.2Sn2+的掺杂量对CuS光吸收性能的影响 图4为在Sn2+掺杂量不同的条件下合成样品的紫外可见漫反射光谱图。从图 4 可以看出,当Sn2+掺杂量从1% 增加9%时,所合成样品的最强吸收峰的相对强度先增加后减小,当Sn2+掺杂量为5% 时达到最强。此外,由图4还可以看出,样品的最强吸收峰峰位随着Sn2+掺杂量的变化先发生红移并在掺杂量为5%时具有最大红移值,随后则又相对于掺杂量为5%的样品发生蓝移现象。其原因可能是当掺杂的Sn2+以替代Cu2+方式进入CuS晶格中,由于Sn2+与Cu2+离子半径及电负性等的不同导致晶格发生变化产生晶格缺陷,增加电子-空穴对的数量,从而使吸收峰的相对强度变强[10]。同时,随Sn2+掺杂浓度的提高,导致晶格中硫空穴-电子对的浓度增加,而硫空穴浓度的增加使其吸收光子跃迁至激发态的几率也随之增加,同时对选择性吸收光线的能量也随之降低,从而使其在增加光吸收强度的同时还发生了红移现象;与此同时,硫空穴-电子对的浓度增加也使得空穴与电子对间的距离减小,提高空穴-电子对复合的几率,降低了有效的硫空穴浓度,从而在高Sn2+掺杂浓度的样品的光吸收强度下降的同时吸收带发生蓝移[5,9,10]。因此在Sn2+的掺杂量为5%时有望获得光热转换性能较好的样品。
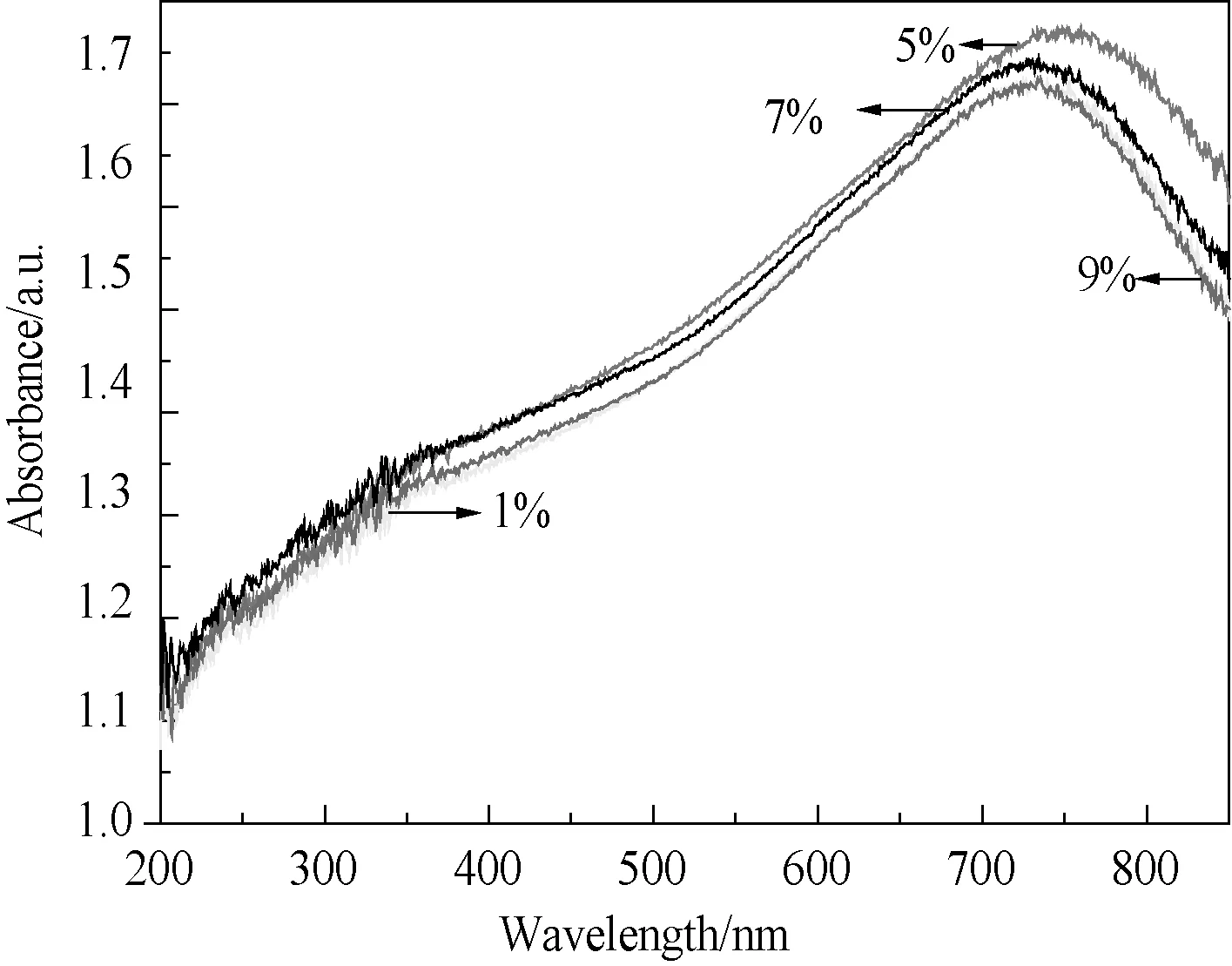
图4 不同Sn2+掺杂量条件下制备样品的紫外可见漫反射光谱图Fig.4 UV-Vis diffuse reflection spectra of the samples obtained with different Sn2+ doping contents
为了验证Sn2+掺杂量对晶体中空穴-电子对浓度的影响,对不同Sn2+掺杂量样品在252nm光激发下的发射光谱进行了检测,结果如图5所示。由图5可以看出,在252nm光激发下,不同Sn2+掺杂量样品在394nm附近均存在一明显的发射峰。从图5还可以观察到,随着掺杂量由1%增加到5%,该发射峰的峰位随之发生红移,继续增大Sn2+掺杂量则该发射峰峰位相对于掺杂5%样品的峰位又发生了略微蓝移现象,部分研究人员在Sn2+掺杂ZnO中观察到了类似的现象[21-22]。虽然目前对于CuS本征发光的机制尚未明晰,但一般认为纳米半导体的本征发光取决于晶体的尺寸、形貌与缺陷[21-24]。而在相似制备条件下样品的尺寸与形貌变化并不大,为此不同Sn2+掺杂量样品的发射光谱的变化则主要归因于样品的缺陷。其原因可能是在低浓度(不高于5%)Sn2+掺杂下,由于Sn2+与Cu2+的差异使得晶格中硫空穴Vs的浓度增加导致发射峰发生了红移,而当Sn2+掺杂浓度较高时(不低于5%),晶格中过高的硫空穴Vs的浓度使空穴-电子对间距离下降而提高其复合机率,降低了作用于有效发射的浓度,从而使得样品的发射峰发生了部分蓝移[21-22]。

图6 不同NaOH加入量条件下制备样品的紫外可见漫反射光谱图Fig.6 UV-Vis diffuse reflection spectra of the samples obtained with different NaOH addition amount
3.3.3氢氧化钠的加入量对CuS光吸收性能的影响 图6为在NaOH加入量不同的条件下合成样品的紫外可见漫反射光谱图。从图6可以明显地看出,随着NaOH加入量的增加,样品的吸收峰的相对强度先增大后减小,并在加入量为0.008 mol时达到最大值。有意思的是,当加入量在0.006~0.007mol时,最强吸收峰在630nm附近,然而在700~800nm处并未观察到吸收;随着加入量增加到0.008~0.009 mol时,吸收峰发生了明显的红移且最强吸收峰位于745nm附近。这可能是由于在生成CuS晶体时,Tu与Cu2+在肼的存在下直接还原生成了Tu-Cu(I)配合物,当在pH值比较低的条件下,所生成的Tu-Cu(I)配合物很稳定而成为水热反应的前驱体。但当NaOH加入量增加后,较高的pH将会破坏Tu-Cu(I)配合物的稳定性[17],促使其离解成Cu+,而Cu+在空气中会被迅速氧化成Cu2+并和Tu复合成Tu-Cu(II)配合物[19]作为水热反应的前驱体。水热反应前驱体的不同导致在水热条件下形成CuS晶体的机理不同而具有不同的微结构,从而使得样品具有不同的光吸收性能[17]。通过实验确定在NaOH的加入量为0.008mol时,能获得光热转换性能较好的样品。
3.3.4反应时间对CuS光吸收性能的影响 图7为在不同反应时间下制得样品的紫外-可见漫反射光谱图。由图7可知,增加反应时间,样品的光吸收性能先增强后减弱,当时间为4h时,达到最大值,且有较好的光吸收性能。其原因可能是反应时间较短(2h)时,形成的CuS晶体尺寸较小并且晶体生长不完全导致其光吸收性能较差;延长反应的时间(4h),晶体尺寸增大同时晶体生长较完好使其光吸收性能增强;继续延长反应时间(6h和8h),则又由于所生长的晶体发生团聚而降低其光吸收性能[23,25],这与文献报道相一致[6,26]。因此在反应时间为4 h下能获得较佳性能的样品。

图7 不同反应时间制备样品的紫外可见漫反射光谱图Fig.7 UV-Vis diffuse reflection spectra of the samples synthesized with different reaction time
3.4 CuS晶体的光热转化性能
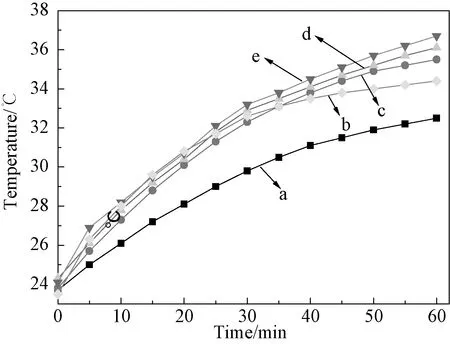
图8 不同Sn2+掺杂量的样品溶液模拟太阳光照射下温度随时间的变化曲线 (a:H2O;b:CuS;c:掺杂1% Sn2+的CuS;d:掺杂7% Sn2+的CuS;e:掺杂5% Sn2+的CuS)Fig.8 Temperature-time curves for the samples with different Sn2+ doping contents (a:H2O;b:CuS;c:1% Sn2+ doped CuS;d:7% Sn2+ doped CuS;e:5% Sn2+ doped CuS)
图8为模拟太阳光照射下,水、未掺杂的CuS和掺杂不同浓度Sn2+的CuS样品的溶液的温度随时间的变化曲线图。从图8 可以看出,经过模拟太阳光照射60min后,所制备的掺杂5% Sn2+的CuS样品的水溶液分散体系温度升高了12.6℃,未掺杂的CuS样品的水溶液分散体系温度升高了10.9℃,纯水溶液分散体系温度升高了8.8℃。实验结果证实,掺杂5% Sn2+的CuS样品的溶液比其他两种溶液升温幅度明显增加,表明掺杂5% Sn2+的CuS样品具有更强的光热转化能力。

图9 不同样品溶液的降温曲线 (a:掺杂5% Sn2+的CuS;b:未经掺杂的CuS)Fig.9 Cooling curves of the different sample (a:5% Sn2+ doped CuS;b:CuS)
图9是未掺杂的CuS和掺杂5% Sn2+的CuS样品的溶液降温曲线。根据文献[4]可知,由式(1)可计算出样品的光热转换效率:
η=hs(Tmax-Tsurr)-Q0/I(1-10-Aλ)
(1)
其中,η为光热转换效率;h为换热系数;s为容器的表面积;Tmax为体系温度升高到达的最大值;Tsurr为环境温度;Q0为纯水样品在同样的条件下所吸收的热量:由图8可得在实验条件下纯水样品的温度增加了8.8℃,根据公式Q0=cm△T可计算水吸收的热量为1478.4J;I为模拟太阳光的功率(60W);Aλ为近红外区最大吸光度,由图7可得Aλ约为1.78。
由文献[4]可知:
(2)
其中:QI为吸收波长为λ的光产生的热量;Qext为体系周围环境吸收的热量;mi为样品的质量;Cp,i为样品的比热容。
对于体系的时间常数τs有:
(3)
将τs代入式(2)整理得:
(4)
其中,θ为无量纲驱动温度,其值为:
(5)
光照停止时QI+Q0=0,代入式(4)得:
(6)
体系降温最初θ=1,t=0,代入式(5)有:
(7)
将式(3)代入式(6),整理得:
(8)
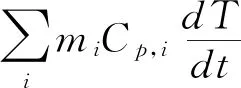
图10为掺杂5% Sn2+的CuS样品的降温段的Time-(-lnθ)曲线。由图10中的拟合方程可知hs的值为3.8154。将各个参数待入公式(1)可计算得到在本实验条件下所制备掺杂5% Sn2+的CuS样品的光热转换效率为23.02%,同理可计算得到纯CuS样品的光热转换效率为12.72%。计算结果证实,相比较于未掺杂的CuS样品,掺杂5% Sn2+的CuS样品的光热转换效率提高了80.97%。

图10 掺杂5% Sn2+的CuS样品的降温段的Time-(-lnθ)曲线Fig.10 Time vs (-lnθ)curve for the 5% Sn2+ doped CuS sample
4 结 论
以CuCl2铜源、硫脲为硫源采用直接沉淀法成功合成了纯相Sn2+掺杂属于六方晶系的CuS近红外光吸收材料。所制备样品在近红外光区具有显著的吸收,并且不同的制备条件直接影响着制备产物的光吸收性能。在反应体系中氢氧化钠的加入量为0.008 mol、Cu2+与S2-的物质量之比为1∶17、Sn2+的掺杂量为5% 及反应时间为4 h的条件下可合成光吸收性能较好的产物。所合成掺杂5% Sn2+的CuS样品经模拟太阳光照射实验检测计算得到其光热转换效率为23.02%,与纯相未掺杂CuS样品相比较,光热转换效率提高了80.97%。
