诱导型神经干细胞移植对颅脑创伤后神经营养因子分泌的影响
2019-07-11高谋徐如祥王文佳董勤丁柏匀姚慧杨志军
高谋 徐如祥 王文佳 董勤 丁柏匀 姚慧 杨志军
颅脑创伤(traumatic brain injury,TBI)是中枢神经系统(central nervous system,CNS)损伤性疾病,其流行病学特点呈现为高发病率和高致死致残率,严重危害人类生命健康[1]。研究发现神经营养因子可发挥保护受损伤的神经细胞,促进神经细胞修复与再生,减轻TBI后继发性脑损伤等多种作用[2,3]。此外,TBI后脑组织内神经营养因子的表达可受多种因素影响,例如,TBI既可激活内源性神经营养因子的表达,也可因破坏组织细胞而减少神经营养因子的合成与分泌[3,4]。由此可见,有效提高TBI后脑组织内神经营养因子的表达水平仍是促进神经功能恢复的研究重点[3,4]。笔者曾报道诱导型神经干细胞(induced neural stem cells,iNSCs) 移植可促进 TBI动物神经功能恢复,并在iNSCs体外培养过程中发现其可表达多种神经营养因子,如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和胶质细胞源性神经营养因子(glial cell-line derived neurotrophic factor,GDNF)[5,6]。然而,iNSCs移植物能否在 TBI动物脑组织中表达神经营养因子,发挥神经营养作用目前尚不明确。为此,本研究用自由落体脑打击装置制备C57BL/6小鼠TBI模型,并将C57BL/6小鼠iNSCs经立体定向注射到TBI小鼠脑内,于移植后7 d处死动物。取脑组织mRNA行逆转录定量实时聚合酶链反应(reverse transcription quantitative realtime polymerase chain reaction,RT-qPCR) 检测 Bdnf和Gdnf基因转录水平。随后,取脑组织蛋白行酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)检测BDNF和GDNF蛋白表达量。在明确各组TBI动物脑组织中BDNF和GDNF表达量的基础上,选取iNSCs移植组动物脑组织行免疫荧光染色,并用激光共聚焦显微镜观察iNSCs移植物分泌BDNF和GDNF等情况,以探讨经脑立体定向移植iNSCs对TBI后神经营养因子分泌的影响,现报道如下。
材料与方法
一、实验动物
健康成年雄性C57BL/6小鼠30只,8~10周龄,体质量24~30 g,所有实验动物(无特定病原体级)均购自北京维通利华公司。
二、主要实验仪器和试剂
仪器:CO2细胞培养箱和MultiskanTMMK3酶标仪(Thermo公司,美国),超净工作台(ESCO公司,美国),ABI ViiA7TM实时荧光定量 PCR仪(Applied Biosystems公司,美国),倒置相差显微镜、CM1950冰冻切片机、TCS SP5Ⅱ激光共聚焦显微镜和DM3000荧光显微镜(Leica公司,德国)。
试剂:DMEM/F12培养基、Neurobasal培养基、B27、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)、Accutase酶、左旋谷酰胺和磷酸盐缓冲液(phosphate buffered solution,PBS)(Invitrogen 公司,美国),牛血清白蛋白(bovine serum albumin,BSA)和RIPA试剂(Sigma公司,美国),QuantScript RT试剂盒[天根生化科技(北京)有限公司],SYBR Green Master Mix试剂盒[宝日医生物技术(北京)有限公司],小鼠 BDNF ELISA 试剂盒(Promega公司,美国),小鼠GDNF ELISA试剂盒(Santa Cruz Biotechnology公司,美国),BDNF 抗体(工作浓度:5 μL/mL)、GDNF 抗体 (工作浓度:5 μg/mL)(Abcam 公司,美国),Alexa Fluor®555标记驴抗兔IgG抗体(工作浓度:2 μg/mL)(Life Tech 公司,美国),4’,6-二脒基-2-苯 基 吲 哚 (4’,6-Diamidino-2-phenylindole,DAPI)(SouthernBiotech 公司,美国)。
三、C57BL/6小鼠iNSCs体外培养
C57BL/6小鼠 iNSCs用含 2%B27、20 ng/mL bFGF、20 ng/mL EGF、0.05%BSA 和 2 mmol/L 左旋谷酰胺的DMEM/F12与Neurobasal等体积混合培养基培养。
四、C57BL/6小鼠TBI模型制备和iNSCs移植
用异氟烷气体麻醉剂麻醉小鼠,并将其固定于脑立体定向仪上,备皮消毒,铺无菌洞巾,切开皮肤,暴露前囟,以lambda缝向喙侧2.0 mm、中线偏右侧2.0 mm为撞击点。用自由落体脑打击装置,撞针直径3.0 mm,制备TBI模型。设置假手术(sham)组(9只),仅切开头皮,不实施撞击。于伤后1 h对TBI小鼠进行神经功能缺损评分(neurological severity scores,NSS),将 NSS 为 4~8 分者(21 只)纳入 TBI组,按照随机数字表法分为:iNSCs移植组(12只)和PBS处理组(9只)。于TBI后12 h,再次麻醉小鼠,并将其固定于脑立体定向仪上,消毒铺巾,暴露前囟,以lambda缝向喙侧5.0 mm,中线偏右侧1.0 mm,硬膜下2.0 mm为注射位点,用25 μL 22 s微量进样器以0.5 μL/min的速度注射5 μL细胞悬液,细胞总量为1×106个,结束后留针5 min,缝合头皮。PBS处理组以同样方式注射等体积PBS。
五、RT-qPCR
细胞移植后7 d采用随机数字表法从各组中选取3只动物进行处死,取新鲜脑组织,称量后,用液氮研磨法提取总RNA。用QuantScript RT试剂盒,按照说明书步骤合成cDNA,并保存于-80℃冰箱内。用SYBR Green Master Mix试剂盒,按照说明书步骤以cDNA作为模板,用ABI ViiA7TM实时荧光定量PCR仪检测各组动物脑组织中Bdnf和Gdnf基因转录水平,以PBS处理组为对照计算各组间mRNA的表达倍数。
六、ELISA
细胞移植后7 d采用随机数字表法从各组中选取6只动物进行处死,取新鲜脑组织,称质量后,用RIPA试剂提取总蛋白,分装后保存于-80℃冰箱。用小鼠BDNF ELISA试剂盒和小鼠GDNF ELISA试剂盒,按照说明书步骤操作,用MultiskanTMMK3酶标仪测量蛋白样品的光密度,用ELISA Calc V软件计算各组动物脑组织中BDNF和GDNF蛋白表达水平。
七、脑组织冰冻切片、病理染色和免疫荧光染色
细胞移植后7 d采用随机数字表法从iNSCs移植组中选取3只动物进行处死,灌注固定后取出大脑,并作大脑冠状面连续冰冻切片,切片厚度为10 μm。用苏木素-伊红染色观察脑组织病理形态学特征。根据病理染色结果挑选脑组织切片进行免疫荧光染色,用10%BSA/0.3%TritonX-100封闭1 h后,分别加入BDNF抗体(工作浓度:5 μL/mL)和GDNF抗体(工作浓度:5 μg/mL)在4℃孵育过夜。 用 PBS漂洗后,分别加入Alexa Fluor®555标记驴抗兔IgG抗体(工作浓度:2 μg/mL),室温避光孵育 2 h。 用DAPI染细胞核,封片后,用激光共聚焦显微镜观察iNSCs移植物表达BDNF和GDNF等情况。
八、统计学分析
采用SPSS17.0软件进行统计学分析。各组小鼠脑组织中Bdnf和Gdnf基因转录水平以及BDNF和GDNF蛋白表达水平以均数±标准差(Mean±SD)表示,进行正态性检验和方差齐性检验,多组间比较采用单因素方差分析,各组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
一、INSCs移植物上调TBI小鼠脑组织中Bdnf和Gdnf基因转录水平
在TBI后7 d,相比sham组,TBI小鼠脑组织中Bdnf和Gdnf基因转录水平明显降低,差异具有统计学意义(P<0.05)。此外,与 PBS 处理组相比,iNSCs移植组TBI小鼠脑组织中Bdnf和Gdnf基因转录水平明显升高,2组差异具有统计学意义(P<0.05)。具体信息见表1。

表1 颅脑创伤7 d后的各组小鼠脑组织中Bdnf和Gdnf mRNA 表达倍数(Mean±SD)
二、INSCs移植物增加TBI小鼠脑组织中BDNF和GDNF蛋白表达水平
在TBI后7 d,相比sham组,TBI小鼠脑组织中BDNF和GDNF蛋白表达水平明显降低,差异具有统计学意义(P<0.05)。此外,与PBS处理组相比,iNSCs移植组TBI小鼠脑组织中BDNF和GDNF蛋白表达水平明显升高,2组差异具有统计学意义(P<0.05)。具体信息见表2。

表2 颅脑创伤7 d后的各组小鼠脑组织中BDNF和GDNF 蛋白表达水平(Mean±SD,pg/mg)
三、INSCs移植物在 TBI小鼠脑组织中表达BDNF和GDNF
在TBI后7 d,iNSCs移植组TBI小鼠脑组织中可见绿色荧光蛋白(green fluorescent protein,GFP)标记的iNSCs移植物从细胞注射位点迁移到达脑损伤区。此外,在激光共聚焦显微镜下可见这些到达脑损伤区呈GFP阳性的iNSCs移植物表达BDNF和 GDNF(图 1)。
讨 论
TBI后神经功能的恢复程度与患者预后密切相关,由于影响CNS损伤后神经功能恢复的因素较多,且涉及复杂的病理生理过程,目前尚缺乏综合有效的治疗手段,因而探索促进神经功能恢复的疗法仍是临床与基础研究的重要课题[7-9]。既往认为干细胞移植在CNS损伤性疾病的治疗中可发挥细胞替代作用,从而促进神经功能恢复[10,11]。近年来随着研究深入,越来越多的学者发现干细胞不仅可发挥细胞替代作用,也可通过合成分泌多种物质影响和改善微环境,为组织细胞的修复与再生创造有利条件[12-15]。笔者曾报道iNSCs移植物可促进TBI动物神经功能恢复,行免疫荧光染色可见iNSCs移植物从细胞注射位点逐渐向脑损伤区迁移,然而由iNSCs分化为成熟的神经细胞数量较少,由此推测iNSCs发挥细胞替代作用并不能完全解释TBI后神经功能恢复[5,16]。笔者进一步研究发现,iNSCs移植物可调控TBI后小胶质细胞的活化状态,使其由促进炎症反应类型向促进组织细胞修复类型转变;此外iNSCs移植物可抑制TBI后反应性星形胶质细胞增生,这些均为神经细胞的存活创造了良好的条件[5,16]。除此之外,笔者曾报道iNSCs在体外培养过程中可表达多种神经营养因子,如BDNF和GDNF[6]。前已述及,神经营养因子可通过多种途径发挥保护受损伤的神经细胞,促进神经细胞修复与再生,减轻TBI后继发性脑损伤等多种作用,由此可见神经营养因子在促进TBI后神经功能恢复中具有良好的治疗效果[3,4]。然而,iNSCs移植物是否可在TBI后脑组织中合成分泌神经营养因子,发挥神经营养作用有待阐明。为此,本课题组探讨了iNSCs移植对TBI后神经营养因子分泌的影响,结果发现:CNS损伤后,即在TBI小鼠脑组织中,Bdnf和 Gdnf基因转录水平以及BDNF和GDNF蛋白表达水平均明显降低。这与既往文献报道,TBI破坏组织细胞可减少神经营养因子的合成与分泌相符合[3,4]。此外,本研究发现经立体定向移植iNSCs可上调TBI后脑组织中Bdnf和Gdnf基因转录水平以及BDNF和GDNF蛋白表达水平。然而,与sham组相比,iNSCs移植组Bdnf和Gdnf基因转录水平以及BDNF和GDNF蛋白表达水平仍明显降低。说明iNSCs移植物可在一定程度上弥补TBI后神经营养因子分泌的不足,然而其是通过自身合成分泌,还是促进内源性神经营养因子表达有待进一步阐明。
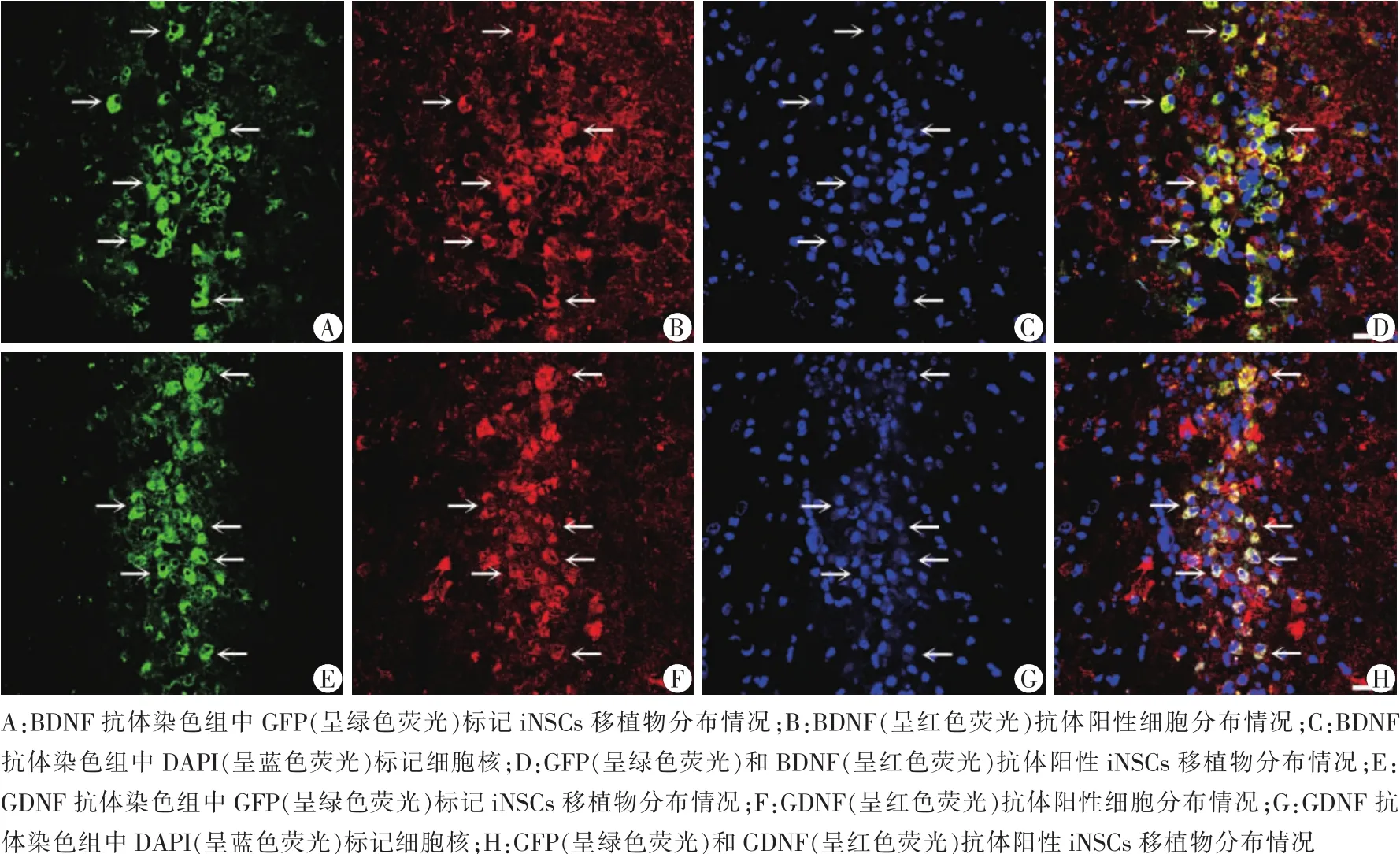
图1 颅脑创伤7 d后的iNSCs移植组小鼠脑组织免疫荧光染色检测(×400)
为探讨经立体定向移植iNSCs上调TBI后脑组织中Bdnf和Gdnf基因转录水平以及BDNF和GDNF蛋白表达水平的作用机制,本研究行免疫荧光染色,在激光共聚焦显微镜下观察发现:GFP标记的iNSCs移植物从细胞注射位点向脑损伤区迁移聚集,这与之前研究报道相符。此外,脑组织中BDNF和GDNF蛋白在iNSCs移植物分布区呈局部聚集现象,并且BDNF和GDNF蛋白在移植的GFP阳性iNSCs内具有共定位的关系。说明iNSCs移植物可通过合成BDNF和GDNF在一定程度上弥补TBI后神经营养因子分泌的不足。结合iNSCs移植组BDNF和GDNF表达水平介于PBS处理组和sham组之间,以及脑组织中iNSCs移植物与BDNF和GDNF蛋白的分布特点,可推测iNSCs移植物主要是通过自身合成分泌BDNF和GDNF为主,目前尚缺乏证据显示iNSCs移植物可促进内源性BDNF和GDNF表达。
综上所述,经脑立体定向移植iNSCs可在TBI后脑组织中合成分泌神经营养因子BDNF和GDNF,发挥神经营养作用。本研究是基于前期实验发现iNSCs在体外培养时可分泌多种神经营养因子,进而在TBI动物脑组织中探讨iNSCs移植物发挥神经营养作用及相关机制。通过分子生物学及形态学等实验研究,笔者发现iNSCs移植物主要以自身合成分泌神经营养因子BDNF和GDNF增加TBI后神经营养因子表达量,这为分析iNSCs移植疗法促进CNS损伤后神经功能恢复提供了新的参考依据。后续研究笔者将重点关注iNSCs移植物自身合成分泌神经营养因子是否受移植微环境影响以及iNSCs移植物能否影响内源性神经营养因子表达,期望通过这一系列研究为体外重编程来源的iNSCs移植治疗CNS损伤性疾病打下坚实基础。
