龙牙百合腐败菌的分离鉴定、生物学特性及抑制剂筛选
2019-07-09尹乐斌李立才孟庆霞赵良忠
尹乐斌 李立才 孟庆霞 周 娟 邓 鹏 赵良忠
(1. 邵阳学院食品与化学工程学院,湖南 邵阳 422000;2. 豆制品加工技术湖南省应用基础研究基地,湖南 邵阳 422000)
百合是百合科百合属的多年生鳞茎类草本植物,又名野百合、白花百合等,龙牙百合为百合属野百合的变种[1]。百合是中国传统的药食同源植物,富含蛋白质、碳水化合物、膳食纤维、VB1、VB2、尼克酸等营养物质,及钾、铁、锌、硒、铜、锰等微量元素,还含有秋水仙碱、总皂苷、黄酮等活性成分[2]。常食用百合还可降血糖、抗氧化、抗疲劳、抗癌、增强机体免疫力等保健作用[3]。
百合鳞茎贮藏期间易发生腐败变质现象,严重影响了百合的实际生产,成为制约百合发展的重要因素之一。已有学者对百合病原菌分离、鉴定及防治措施做了一定研究,Sara等[4]研究发现尖孢镰刀菌、层生镰刀菌等菌是引起以色列地区百合鳞茎腐烂的主要腐败菌;王艳等[5]对吉林、甘肃等6省的百合鳞茎样品进行病原菌分离鉴定,研究发现青霉菌、镰刀菌、木霉、黑根霉、毛霉属是其中的优势腐败菌;也有众多学者[6-7]对不同地区百合腐败菌进行分离鉴定,得到不同的优势腐败菌。可见,地区不同百合腐败的优势菌也不尽相同。目前,鲜有学者[8]对湖南隆回地区的龙牙百合腐败菌进行研究。本试验拟对该地区龙牙百合腐败菌进行分离鉴定和生物学特性研究,并探究常用的9种食品级防腐剂对优势腐败菌的抑制效果,旨为湖南隆回地区的龙牙百合的防腐贮藏提供理论及实践支持。
1 材料与方法
1.1 材料与试剂
1.1.1 供试材料
供试龙牙百合鳞茎:采自湖南省邵阳市隆回县,收集后用自封袋密封带回实验室,4 ℃冰箱保留备用。
1.1.2 供试培养基
马铃薯葡萄糖琼脂培养基(PDA):去皮土豆200 g,蔗糖20 g,琼脂18 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
查氏培养基:硝酸钠3 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
1.1.3 主要试剂
DNA抽提试剂盒:生工生物工程(上海)股份有限公司;
丙酸钙、茶多酚、山梨酸钾:分析纯,郑州康源化工产品有限公司;
丙酸钠、EDTA-2Na:分析纯,南通奥凯生物技术开发有限公司;
壳聚糖、纳他霉素:分析纯,洛阳奇泓生物科技有限公司;
焦亚硫酸钠:分析纯,嘉兴久旭化工有限公司;
脱氢乙酸钠:分析纯,安心生物制品有限公司;
其他试剂均为分析纯。
1.2 仪器与设备
全自动灭菌锅:GI54DWS型,长沙艾迪生物科技有限公司;
超净工作台:SWP-2型,广州市康恒仪器有限公司;
电热恒温培养箱:DHP-500型,常州市万合仪器制造有限公司。
1.3 方法
1.3.1 龙牙百合腐败菌的分离及纯化 分离过程参照巩慧玲等[9]的方法并稍作修改,以明显腐败的百合组织为分离菌株材料,用接种环挑取形态各异的菌落进行纯培养,将单个纯化菌株进行PDA斜面试管接种,4 ℃冰箱保存。
1.3.2 科赫法则证病 参考文献[10]并稍作修改,用灭菌解剖针在健康鳞茎上刺孔,将直径4 mm菌饼贴于孔上,以刺孔但不贴菌饼的鳞茎为对照,28 ℃恒温培养,观察发病情况,再从病变鳞茎中分离纯化菌株判定是否为百合腐败菌。
1.3.3 龙牙百合腐败菌的形态特征观察、鉴定 挑取少许分离纯化的菌丝置于PDA培养基上28 ℃恒温培养,在显微镜下观察菌丝和孢子形态,并测量孢子大小,参考《真菌鉴定手册》[11]记录的菌落特征描述进行形态学分类鉴定。
1.3.4 龙牙百合腐败菌的现代分子生物学鉴定 菌株DNA的提取采用Ezup柱式真菌基因组DNA抽提试剂盒,引物设计参考尹乐斌等[12]的方法进行,聚合酶链反应(PCR)体系和反应程序参考White等[13]的方法进行。PCR产物回收、纯化后送往生工生物工程(上海)股份有限公司测序后,进行BLAST对比分析。
1.3.5 龙牙百合腐败菌的生物学特性研究
(1) 温度对龙牙百合腐败菌菌丝生长和产孢量的影响:设置10,15,20,25,30,35,40,45 ℃共8个不同温度处理,用点植法接种,每个处理重复3次,5 d后用十字交叉法测量菌落直径,7 d后用血球计数板测定产孢量[14]。
(2) pH对龙牙百合腐败菌菌丝和产孢量的影响:用盐酸—氢氧化钠溶液配制pH值分别为5,6,7,8,9,10,11的PDA培养基,测定方法与1.3.5(1)一致。
(3) 碳、氮源对龙牙百合腐败菌菌丝和产孢量的影响:以等量碳源的淀粉、葡萄糖、D-木糖、D-果糖、乳糖、甘露醇代替查氏培养基中的蔗糖,配成不同碳源培养基,未添加碳源的培养基作为对照(CK1);同法以含等量氮源的L-天冬酸、L-苯丙氨酸、蛋白胨、牛肉膏、酵母膏、硝酸钾配置不同氮源的培养基,以无氮源培养基为对照(CK2),测定方式与1.3.5(1)一致。
(4) 光照对龙牙百合腐败菌菌丝和产孢量的影响:将接种后的PDA平板分别置于持续光照、持续黑暗和12 h光暗交替3种培养条件下,测定方法与1.3.5(1)一致。
(5) 腐败菌菌丝致死温度的测定:设置51,54,57,60,63,66,69 ℃共7个温度处理,每个处理用3个灭菌试管,在无菌条件下向每个试管中加入5个直径4 mm菌饼,塞好棉塞后在预设的恒温水浴锅中进行加热,10 min后取出,待冷却后随机从每个试管里取出3个菌饼放到PDA平板上,置于28 ℃恒温培养箱中培养,根据菌饼是否长出菌丝判断致死温度。
1.3.6 抑制剂对龙牙百合腐败菌的抑制效果 参考方中达[15]的方法修改如下:灭菌去离子水,按培养基终浓度制备浓度为3 g/L的抑制剂母液,分别加入2 mL至无菌培养皿中,倒入冷却至50 ℃左右培养基18 mL,充分混匀冷却后,即制成抑制剂最终浓度为300 mg/L培养基平板,同时做3个重复试验。接种后在28 ℃恒温培养箱中培养2 d,按式(1)测量各菌的菌落直径计算抑制率[16]。
(1)
式中:
c——抑制率,%;
d1——对照组菌落直径,mm;
d2——药剂组菌落直径,mm。
初筛出对该菌具有显著抑菌效果的抑制剂,参照程桂林等[17]的试管倍比稀释法,稍作修改:测定抑制剂的MIC浓度。每支试管加入4 mL灭菌PDA液体,加入4 mL 受试药物依次倍比稀释,每种药物稀释6个梯度,第7管添加等量无菌水替代菌液,作为阳性对照,第8管未添加抑制剂,作为阴性对照。将试验菌液用灭菌生理盐水稀释成10-6个/mL浓度,取100 μL分别加入至上述各试管中,混匀后于28 ℃温箱中培育24 h后观察结果。肉眼观察到澄清透明的试管,其中的抑制剂浓度即为菌株的MIC。
1.4 数据处理
采用SPSS 17.0进行数据分析,Origin进行绘图,试验结果以(平均值±标准差)表示。
2 结果与分析
2.1 龙牙百合腐败菌的分离及纯化
在PDA平板上通过平板划线可以分离、纯化出不同形态的真菌,以肉眼可见的占生长优势的霉菌作为分离纯化对象,得到的优势菌记作菌W-1(图1)。
2.2 科赫法则证病
接种W-1菌株的百合鳞茎均出现明显的腐败现象(图2)。再从腐败百合进行病原分离,获得与原真菌一样的菌株。根据科赫氏法则,证实菌W-1为百合腐败菌。
2.3 龙牙百合腐败菌的形态特征观察、鉴定
W-1在PDA平板培养基上培养,菌落呈突起絮状,菌丝颜色呈白色,基物颜色从第2天到第7天都在不断变化,主要是从白色变为堇色、桃红色,再变为深紫色,如图3(a)、(b);孢子存在2种分生孢子形态,小孢子数目较多,呈长椭圆形、卵形,单细胞,大小(8~12) μm×(2~3) μm;大孢子数目较少,呈长椭圆形弯曲,镰刀状,两头稍尖,如图3(c)、(d),初步判定为尖孢镰刀菌(Fusariumoxysporum)。
图1 霉菌在龙牙百合上生长

图2 健康龙牙百合接种菌W-1后的情况

图3 W-1菌株形态观察
2.4 龙牙百合腐败菌的现代分子生物学鉴定
测得的rDNA-ITS序列长度为536 bp,经过GenBank同源性分析选取相似性最高的7个菌株,结果如表1所示。
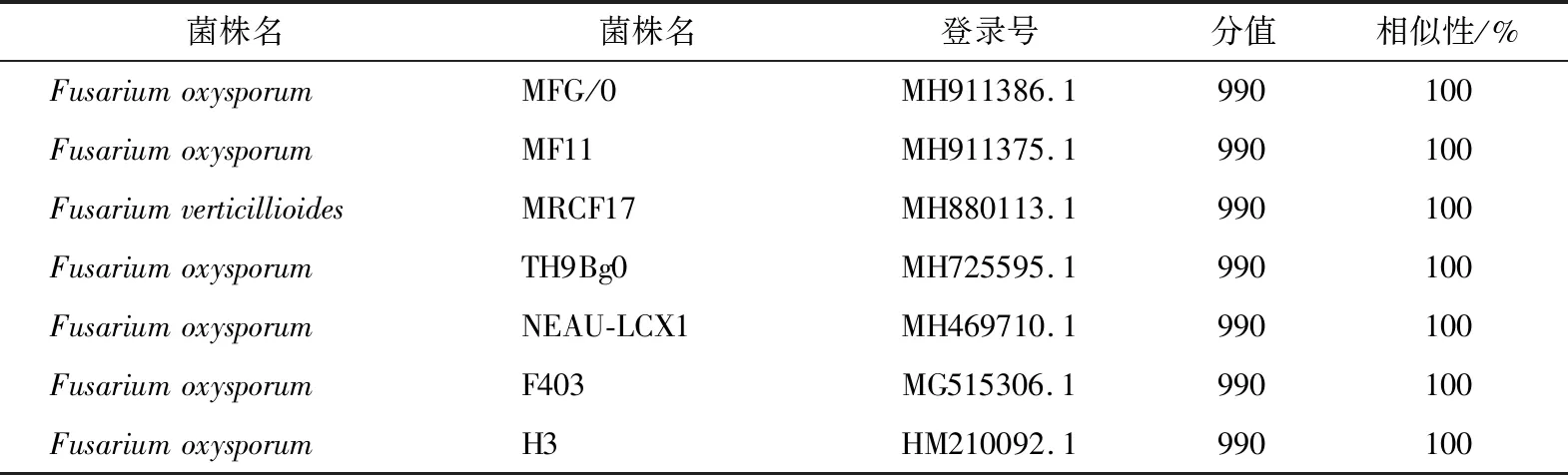
表1 菌株ITS序列同GenBank中霉菌菌株同源性比较
从表1可以看出,通过ITS序列同源性比较,该菌株与GenBank中7株尖孢镰刀菌的ITS序列相似性均达到100%,而且分值最高的全部为尖孢镰刀菌。根据同源性比较结果,可以初步确认W-1菌为尖孢镰刀菌。根据ITS序列同源性,从GenBank中选择10个菌株的ITS基因序列,应用MEGA 7.0软件构建系统发育树。由图4可知,W-1菌与尖孢镰刀菌Fusariumoxysporum(MH911386.1)在一个分支中,且W-1和尖孢镰刀菌Fusariumoxysporum(MH911386.1)的亲缘关系最近,故由形态和分子鉴定结果将该菌鉴定为镰刀菌属尖孢镰刀菌,命名为尖孢镰刀菌(Fusariumoxysporum)W-1。
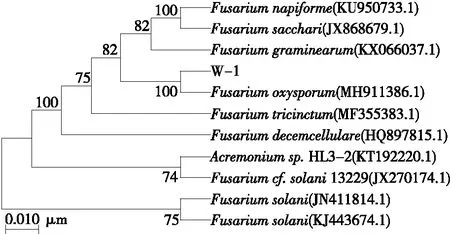
图4 以ITS序列为基础构建的W-1菌株的系统发育树
2.5 尖孢镰刀菌W-1的生物学特性研究
2.5.1 温度对菌株W-1菌丝生长和产孢量的影响 由图5 可知,菌株W-1具有较强的生存能力,在10~40 ℃范围内均可生长、产孢,温度达到45 ℃时菌丝不生长,在30 ℃ 时菌丝生长最快,5 d后菌落直径达62.95 mm,在25 ℃时产孢量最大,7 d后产孢量为4.63×106个/mL,且显著(P<0.05)高于其他处理组,与曾富春等[18]和潘虹等[19]的研究结果一致。
2.5.2 pH对菌株W-1菌丝和产孢量的影响 由图6可知,在pH 5~11范围内,菌株W-1均能生长、产孢,随着pH的升高,菌株直径呈先增加后减小趋势,在pH 7,8时菌丝生长最快,生长5 d后菌落直径达56.68,57.28 mm,与耿丽华等[20]的研究结果一致,且随着pH的继续增大,菌落直径相应递减,但幅度比酸性条件下小,可见,该菌更适宜在中性偏碱性的环境中生长;pH为7时,产孢量最大为4.81×106个/mL,不同pH对该菌产孢影响差异显著,说明通过将土壤调至弱酸性可对百合腐败菌起到一定的抑制作用。

图5 温度对菌株W-1菌丝生长和产孢量的影响
2.5.3 碳、氮源对菌株W-1菌丝和产孢量的影响 由表2 可以看出,菌株W-1菌丝在单糖、多糖、糖醇为碳源的培养基中均可生长,说明该菌碳源利用谱较广。在以葡萄糖和D-果糖为碳源的培养基上生长较快,且在统计学0.05水平上无显著差异性,与巩慧玲等[9]研究结果类似;在以甘露醇为碳源的培养基上生长最慢,甚至比对照组生长更慢,说明甘露醇对于该菌来说并不适合作为碳源使用,与赵杰[21]对于尖孢镰刀菌的研究结果有一定差异,可能与菌株和基础培养基不同有关。该菌在以D-木糖为碳源时,产孢量最大,以葡萄糖、淀粉和D-果糖为碳源时,三者产孢量无显著差异,不添加碳源的对照组产孢量最少,说明适合的碳源有助于菌丝生长和产孢。
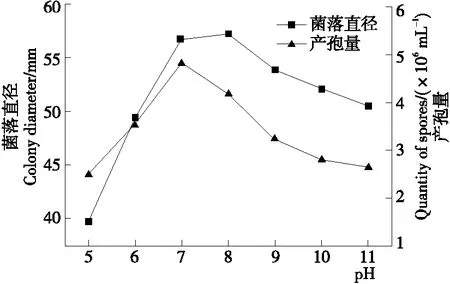
图6 pH对菌株W-1菌丝和产孢量的影响
Table2EffectofdifferentcarbonsourcesonmycelialgrowthandsporulationofstrainW-1(n=3)

碳源菌落直径/mm产孢量/(×106mL-1)葡萄糖56.97±1.32a3.38±0.03b淀粉54.22±1.46b3.43±0.06bD-木糖53.85±1.35b4.06±0.08a乳糖53.80±1.12b1.23±0.06dD-果糖55.20±1.20ab3.33±0.10b甘露醇41.79±0.49d2.33±0.06c对照CK146.76±0.59c1.21±0.08d
† 字母不同表示差异显著(P<0.05)。
由表3可知,菌株W-1对不同氮源的利用情况差异显著,在以牛肉膏为氮源的培养基上生长最快,生长5 d后菌落直径达到65.13 mm,其次,以蛋白胨和硝酸钾为氮源的培养基生长速度较快,且两者无显著差异,在L-天冬酸为氮源的培养基上生长最慢,甚至比对照组还慢,说明L-天冬酸不适合作为菌株W-1的氮源;该菌在以牛肉膏和L-苯丙酸钾为氮源的培养基上产孢量最大,7 d后产孢量分别为3.48×106,3.49×106个/mL,在不添加氮源的培养基上产孢量最少,仅2.13×106个/mL。综上,牛肉膏更适合该菌株生长,可能是牛肉膏含有多肽类、氨基酸类、核苷酸类、矿物质类及维生素类的水溶性物质,营养成分丰富,可以满足菌株W-1菌丝的生长需求,而酵母膏、无机氮源等氮源相对成分单一,提供的营养效果无牛肉膏显著。
表3氮源对菌株W-1菌丝生长和产孢量的影响†
Table3EffectofdifferentnitrogensourcesonmycelialgrowthandsporulationofstrainW-1(n=3)

氮源菌落直径/mm产孢量/(×106mL-1)L-天冬酸31.12±1.10d2.13±0.08dL-苯丙氨酸51.88±0.75c3.49±0.03a蛋白胨57.67±0.67b2.33±0.06b牛肉膏65.13±1.41a3.48±0.03a酵母膏51.75±0.51c2.31±0.12bc硝酸钾56.07±1.29b2.20±0.08cd对照CK244.78±1.23d2.13±0.06e
† 字母不同表示差异显著(P<0.05)。
2.5.4 光照对菌株W-1菌丝和产孢量的影响 由表4可知,不同光照处理条件下,各组菌丝生长情况不同:在连续光照条件下,菌丝直径和产孢量都达到最大,分别为58.09 mm和3.18×106个/mL,与其他处理组相比具有显著差异性(P<0.05),说明光照有利于该菌生长。
表4光照对菌株W-1菌丝和产孢量的影响†
Table4EffectofdifferentlightonthemyceliumandsporulationofstrainW-1(n=3)

光照条件菌落直径/mm产孢量/(×106mL-1)连续光照58.09±0.45a3.18±0.09a连续黑暗47.08±0.12c2.23±0.08c光暗交替49.44±0.54b2.64±0.06b
† 字母不同表示差异显著(P<0.05)。
2.5.5 菌株W-1菌丝致死温度的测定 菌株W-1菌丝在51,54,57,60,63 ℃处理10 min还能生长,但在66,69 ℃ 处理10 min后不能生长,说明该腐败菌菌丝的致死温度为66 ℃,10 min。
2.6 抑制剂对龙牙百合腐败菌的抑制效果
抑制剂浓度为300 mg/L时,由表5可知,纳他霉素对菌株W-1的抑菌效果最好,抑制率为95.98%,脱氢乙酸钠和焦亚硫酸钠对菌株W-1的抑菌效果次之,抑制率分别为86.97%,86.67%;茶多酚和丙酸钠与对照组无显著差异,表明这2种抑制剂对菌株W-1无抑菌效果;其他抑菌剂都有一定抑菌效果,但抑菌效果有限。
采用试管倍比稀释法测定3种抑制剂的MIC浓度,结果表明,脱氢乙酸纳MIC浓度为150 mg/L,与李忠平等[22]报道结果相似,纳他霉素、焦亚硫酸钠MIC浓度分别为125,100 mg/L,目前尚无关于那他霉素和焦亚硫酸钠对于尖孢镰刀菌的抑菌报道,隋莎莎等[23]、李永才等[24]关于那他霉素和焦亚硫酸钠对青霉菌的抑制效果研究,结果与本试验有差异,可能是试验方法和试验菌株差异或试验误差所致。
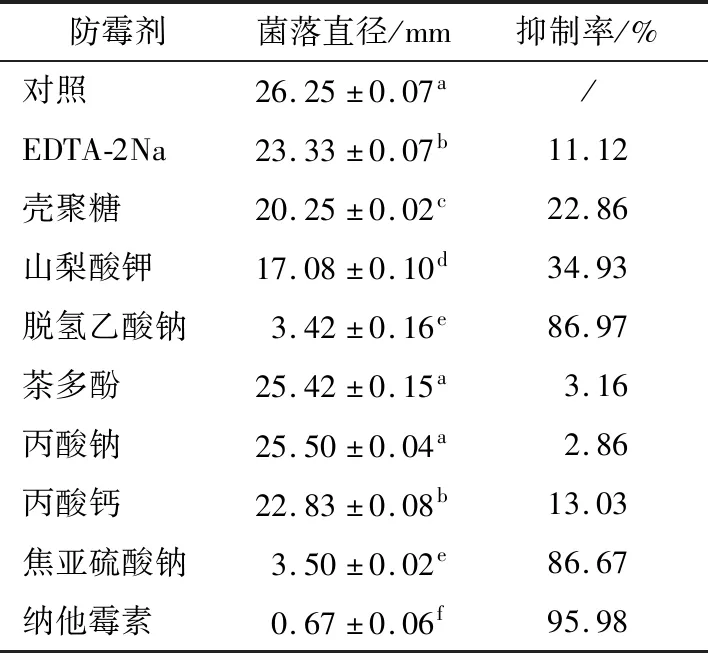
表5 防霉剂对菌株W-1的抑制效果†
† 字母不同表示差异显著(P<0.05)。
3 结论
通过分离纯化生长在龙牙百合上的优势腐败菌,确定了引起湖南隆回地区的龙牙百合鳞茎腐烂的病原菌为尖孢镰刀菌,该菌菌丝在30 ℃,pH 7,8条件下生长最快,菌丝致死温度66 ℃处理10 min;该菌可利用多种碳氮源,其中,在以葡萄糖和淀粉为碳源,牛肉膏为氮源的培养基上生长最块;在25 ℃、pH 7的情况下产孢量最大,以D-木糖为碳源、牛肉膏和L-苯丙氨酸为氮源的条件下更利于产孢;光照有利于该菌菌丝生长和产孢。9种食品级防腐剂对该菌的抑菌效果表明,纳他霉素、脱氢乙酸钠和焦亚硫酸钠对该菌具有显著抑菌效果,MIC浓度分别为150,125,100 mg/L。使用食品级抑菌剂对龙牙百合进行抑菌,为生产实践中的百合防腐贮藏提供有价值的指导。本研究后续工作可分2个方向进行,对初筛抑菌剂试验得到的3种高效抑菌剂进行复配,提升抑菌效果,减少抑菌剂的用量;针对分离出的腐败菌的生物学特性进行病害的防控工作,如通过调节贮藏期的温度、pH等因子来抑制病原菌生长的效果,最终达到高效的百合病害防控效果。
