低植酸豆基配方粉的制备及消化特性
2019-07-05徐婧婷赵忠良王世杰郭顺堂
徐婧婷,赵忠良,朱 宏,王世杰,郭顺堂,*
(1.中国农业大学食品科学与营养工程学院,植物蛋白与谷物加工北京市重点实验室,北京 100083;2.北京康得利智能科技有限公司,北京 100074;3.石家庄君乐宝乳业有限公司,河北 石家庄 050221)
婴儿豆基粉是以大豆蛋白为基料,根据婴儿生长发育的营养需求添加碳水化合物、脂肪、维生素和矿物质等而制成的一种配方食品,具有乳代用品的性质,可替代母乳或作为断奶食品[1]。其设计依据是大豆中含有丰富的蛋白质,氨基酸组成与牛乳蛋白相近,易被婴幼儿吸收[2-3]。近年研究也表明,豆基配方粉与乳基配方粉喂养的婴儿在蛋白质代谢上无显著差异[4],因此豆基配方粉在欧美市场已得到广泛推广和应用。以美国为例,食用豆基配方粉的婴幼儿(0~12月)比例达12%[5]。
然而大豆中含有多种抗营养因子,如植酸、胰蛋白酶抑制剂、脲酶、致甲状腺肿素,使其消化营养性不如乳基配方粉[6]。如植酸可以螯合食物中的金属离子,形成不溶性复合物,影响人体对矿物质的吸收[7],可与带正电荷的分子结合,如氨基酸、膳食蛋白等,降低氨基酸的消化率。还可与脂肪酸发生反应,在肠道内生成不溶性物质,它还能与淀粉结合,抑制淀粉酶的作用,降低碳水化合物的消化率[8]。凝集素会与小肠壁上皮细胞表面特异性受体结合,损坏小肠壁刷状缘黏膜结构,影响消化酶的分泌,从而使肠道对营养物质的消化吸收能力受损,降低蛋白质的消化利用率[9]。致甲状腺肿素可与血液中碘结合,致使甲状腺素合成所需碘来源不足,从而导致甲状腺代偿性增生肿大[10]。与此同时,大豆本身也是8大致敏食物之一,约有1%~6%的婴儿对大豆蛋白过敏[11],可引起患者过敏性皮炎及胃肠道紊乱等过敏性症状[12]。
因此,为保证豆基配方粉的消化营养性,有必要去除大豆蛋白中的抗营养因子和降低致敏性。凝集素、胰蛋白酶抑制剂、脲酶等均具有热不稳定性,在加工过程中通过热处理即可使其失活。但植酸具有很强的热稳定性,仅采用热处理效果不佳。植酸酶是一种能够高效酶解植酸及其植酸盐,将其水解为肌醇与磷酸盐的一类酶的总称,它可以将植酸分子水解成肌醇和6 种无机磷酸盐分子[13]。研究发现,将发芽小麦与大豆混合处理,能够酶解掉大豆所含的植酸,减少金属元素被螯合的量,改善终产品的磷钙比,而这就是源于小麦萌发时产生的植酸酶的作用。因此可采用植酸酶酶解,去除大豆中的植酸含量[14]。大豆中的致敏原主要存在于7S中,11S相对安全[15-16],而7S的变性温度为75 ℃,因此将大豆蛋白在75 ℃处理后再进行蛋白酶酶解,则可以使7S可以充分水解,而11S不被水解[17]。
本研究在前期实验的基础上,以大豆为原料,对大豆进行热烫处理,使7S变性后再进行蛋白酶酶解,并结合植酸酶特异性去除植酸,对豆基粉的消化性进行体外模拟实验,考察产品消化性,为实现工业化低植酸低过敏性婴儿豆基粉生产提供技术支持。
1 材料与方法
1.1 材料与试剂
东北大豆、乳粉、玉米糖浆、大豆油 市售;植酸酶P1295 美国Sigma公司;十二水合磺基水杨酸、磷酸氢钠、HCI、KH2PO4、Na2HPO4、FeCl3、NaOH、尿素、Na2SO4、三氯化铁、丙烯酰胺(均为分析纯) 北京化学试剂公司;β-巯基乙醇、牛血清蛋白 德国Amersco公司;风味蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶 丹麦诺维信公司;D201大孔树脂 天津兴南允能高分子技术有限公司。
1.2 仪器与设备
JYL-350豆浆机 山东九阳小家电有限公司;LXJIIB大容量低速离心机 上海安亭科学仪器厂;离子交换柱(Ф 0.8 cm×10 cm) 辽宁锦州新科有机玻璃厂;FD-1C-50真空冷冻干燥机 北京博医康实验仪器有限公司;PP-25 pH计 德国Sartorius公司;90-1磁力搅拌器上海雷磁新泾仪器有限公司;SHJ-A水浴恒温磁力搅拌器金坛市华锋仪器公司;UV1800紫外-可见分光光度计、AY220千分之一电子天平 日本Shimadzu公司;QL-901旋涡混合仪 海门其林贝尔仪器制造有限公司;DHG-9140A电热恒温鼓风干燥箱 上海一恒科技有限公司;MOEDLBE-210N电泳槽 日本Bio-Craft公司;DYYIII8B稳压稳流定时电泳仪 北京六一仪器厂;TS-1脱色摇床 江苏海门市麒麟医用仪器厂。
1.3 方法
1.3.1 去乳清蛋白溶液的制备
称取50 g脱皮的破碎大豆于500 mL烧杯中,自来水清洗3 遍后再用蒸馏水清洗2 遍,滤去多余的水分。向盛有膨润大豆的400 mL烧杯中,加入150 mL、85 ℃质量分数3‰ NaHCO3溶液,然后置烧杯于85 ℃的恒温水浴中,料液温度达到(85±2)℃时计时10 min后取出烧杯,再将200 mL、85 ℃蒸馏水和浸泡后的大豆一起转入打浆机中,打浆3 次,每次40 s,用120 目尼龙网过滤除渣即得到蛋白浸提液。将浸提液用6 mol/L HCl和1 mol/L HCl溶液调节pH值至5.15酸沉,4 000 r/mim离心5 min,沉淀水洗2 次,搅拌均匀,加水复溶至蛋白质量分数为3%,15 000 r/min剪切均质5 min,即得蛋白溶液。
1.3.2 植酸酶对蛋白溶液的酶解作用
1.3.2.1 不同时间条件下植酸酶解蛋白溶液的制备
根据美国Sigma公司提供的植酸酶说明,植酸酶的最适作用条件为pH 5.15、55 ℃,因此以pH 5.15、温度55 ℃条件为基础,确定酶解时间。将按1.3.1节制备的去乳清蛋白溶液置于锥形瓶内,调节pH值至5.15,放入55 ℃水浴锅中平衡10 min,加入质量分数1%的植酸酶溶液,分别保持60、120 min和180 min,然后置于95 ℃,水浴灭酶5 min,其中一组为空白对照。再将蛋白酶解液冻干,待测。
1.3.2.2 不同温度条件下植酸酶酶解蛋白溶液的制备
以pH 5.15、酶解时间60 min为基础确定酶解温度。将去乳清蛋白溶液置于锥形瓶内,调节pH值至5.15,分别放入45、50 ℃和55 ℃水浴锅中平衡10 min,加入1%的植酸酶溶液,酶解60 min后置于95 ℃水浴灭酶5 min,其中一组为空白对照。再将蛋白酶解液冻干,待测。
1.3.2.3 不同pH值条件下植酸酶解蛋白溶液的制备
以酶解温度55 ℃、酶解时间60 min为基础确定pH值。将去乳清蛋白溶液置于锥形瓶内,分别调节pH值至5.15、6、7,放入55 ℃水浴锅中平衡10 min,加入1%的植酸酶溶液,酶解60 min后95 ℃水浴灭酶5 min,其中一组为空白对照。再将蛋白酶解液冻干,待测。
1.3.3 不同蛋白酶对蛋白溶液的酶解效果
按表1中蛋白酶类型分别调节蛋白溶液pH值,放入50 ℃水浴锅中平衡10 min,按加酶量0.5%加入蛋白酶,酶解1 h后95 ℃水浴灭酶5 min,冷却即得不同蛋白酶处理的蛋白酶解液。
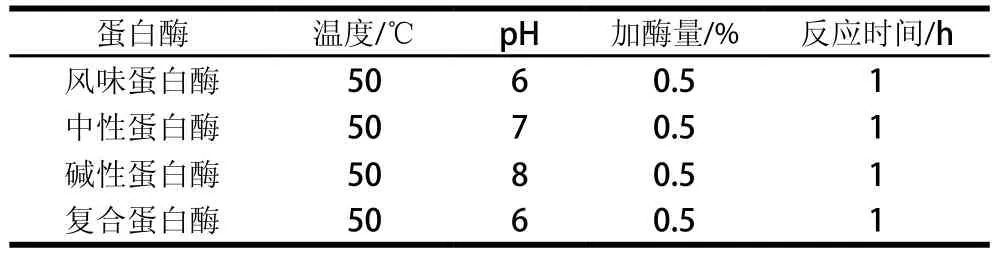
表1 蛋白酶对大豆蛋白的酶解作用Table 1 Enzymatic hydrolysis of soybean protein by proteases
1.3.4 中性蛋白酶对蛋白溶液的酶解作用
1.3.4.1 不同酶解时间酶解蛋白溶液的制备
将去乳清蛋白溶液置于锥形瓶内,调节pH值至7.0,放入45 ℃水浴锅中平衡10 min,按加酶量0.5%加入中性蛋白酶溶液,分别酶解10、30 min和60 min,95 ℃水浴灭酶5 min,其中一组为空白对照。冷却即得不同时间处理的蛋白酶解液。
1.3.4.2 不同酶解温度酶解蛋白溶液的制备
将去乳清蛋白溶液置于锥形瓶内,将pH值调节至7.0,分别放入45、50 ℃和55 ℃水浴锅中平衡10 min,按加酶量0.5%加入中性蛋白酶溶液,其中一组为空白对照,酶解10 min后95 ℃水浴灭酶5 min。冷却即得不同温度处理的蛋白酶解液。
1.3.4.3 不同酶解pH值酶解蛋白溶液的制备
将去乳清蛋白溶液置于锥形瓶内,分别调节pH值至5.15、6.0、7.0,放入45 ℃水浴锅中平衡10 min,按加酶量0.5%加入中性蛋白酶溶液,其中一组为空白对照,酶解10 min后95 ℃水浴灭酶5 min。冷却即得不同pH值处理的蛋白酶解液。
1.3.5 植酸含量的测定
对Latta等[18]报道的离子交换比色方法加以改进。将50 g无水硫酸钠溶于500 mL 1%的盐酸溶液,用于样品中植酸的提取。取10 g样品,与50 mL上述的硫酸钠/盐酸溶液混合,室温搅拌2 h。混浊的提取液经过滤、收集。取10 mL滤液加入30 g/L的NaOH溶液和19 mL的去离子水,混合后缓慢注入填有0.5 g AX1-G4强碱型阴离子树脂的离子交换柱(Ф 0.8 cm×10 cm)中。树脂先后由15 mL纯净水和15 mL 0.05 mol/L的氯化钠溶液洗脱,弃去洗脱液。最后用0.7 mol/L氯化钠溶液洗脱,流出液体接收并定容于25 mL容量瓶中。5 mL洗脱液与4 mL改进的Wade试剂(0.03%三氯化铁和0.3%磺基水杨酸混合溶液)混合,静置20 min于3 000 r/min离心10 min后,于500 nm波长处测定上清液的吸光度。用5 mL质量浓度分别为0、0.02、0.04、0.06、0.08、0.1 mg/mL的植酸钠标品与上述Wade试剂,制作标准曲线并计算样品植酸含量。
1.3.6 低植酸豆基配方粉生产工艺
将低植酸大豆蛋白基料溶液与脂肪、碳水化合物进行复配,每100 kJ(100 kcal)所含蛋白质、脂肪、碳水化合物的量参照GB 10765—2010《婴儿配方食品》进行设计。喷雾干燥后即得低植酸豆基配方粉,配料如表2所示。

表2 豆基配方粉的营养成分配料Table 2 List of nutritional ingredients of soybean-based infant formula%
1.3.7 豆基配方粉的酸凝特性
将豆基配方粉和对照乳粉配制成2%的溶液,室温下磁力搅拌60 min,使其充分溶解。置于37 ℃水浴锅内保温,以25 r/min搅拌,1 mol/L HCl调节pH值分别为4.0,静置30 min,观察酸凝状态后,测量黏度。再将pH值调为6.0,观察酸凝状态后,测量黏度。
1.3.8 模拟婴儿体外消化实验
根据婴儿体外消化实验模型[19-22]对去乳清蛋白溶液进行了体外消化模拟。模拟胃液:用0.2% NaCl溶液(pH 4)配制质量分数2.5%胃蛋白酶溶液;模拟肠液:用0.68% KH2PO4+0.062% NaOH混合溶液(pH 7)配制质量分数0.5%胰蛋白酶溶液;样品的消化:将待消化样品pH值调至4.0,在37 ℃水浴中平衡10 min,加入模拟胃液(加酶量1/5(m/m)),37 ℃消化30 min。再将样品pH值调至7.0,在37 ℃水浴中平衡10 min,加入模拟肠液(加酶量1/40(m/m)),37 ℃消化60 min。
1.3.9 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)
参照Ren Chengang等[23]的方法,并略作修改。于1.5 mL离心管中加入0.36 g脲素,再加入0.5 mL含有0.2% SDS、0.063 mol/L Tris-HCl和20%甘油(pH 6.8)的样品处理液,再添加20 μL巯基乙醇,再加入20 μL饱和溴酚蓝溶液,取1mg样品(以蛋白质量计)加入到上述离心管中,最后加入蒸馏水使得离心管中的样品总体积为1 mL,用旋涡振荡器使其充分混和均匀后,室温静置12 h以上,之后进行电泳。
采用Bio Craft Model BE-210N垂直平板电泳装置。胶板厚度为1 mm,上层浓缩胶为4%,交联度2.7%;下层分离胶为12.5%,交联度2.7%。电泳缓冲液中含有5 mmol/L Tris、38.4 mmol/L的甘氨酸和0.1%的SDS溶液。浓缩胶阶段保持15 mA的电流,分离胶阶段保持25 mA的电流。
电泳结束后,电泳胶片采用含有33%甲醇和12%三氯乙酸的电泳固定液固定4 h。固定结束后,用考马斯亮蓝G-250染色液染色3 h。染色结束后,用蒸馏水浸泡胶片进行脱色处理,直至底色基本脱去,电泳条带清晰可见为止。用佳能扫描仪扫描胶片得到电泳图片。采用Scion image PC software 软件对染色条带进行光密度分析,扫描成像。
1.4 数据统计与分析
所有实验均进行重复,结果取其平均值。实验数据采用Excel和SPSS 17.0软件进行分析处理和方差分析,利用Origin 8.0软件进行绘图,结果以 ±s表示,通过单因素方差分析对实验数据进行差异显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 植酸酶酶解对蛋白溶液中植酸含量的影响
根据实验室前期研究,用阴离子交换树脂法处理大豆分离蛋白,可以去除90%左右的植酸含量[24-25]。但是在工厂进行中试生产时发现,由于蛋白溶液具有很高的黏度,会导致大量的蛋白溶液通过装有阴离子交换树脂时发生堵塞现象,从而降低了其工业化使用的可能性。
植酸酶具有特殊的分子结构和空间结构,能够依次分解植酸分子中的磷,将植酸(盐)降解为系列肌醇磷酸和无机磷,最后肌醇单磷酸酯酶把肌醇单磷酸降解为肌醇和正磷酸。研究发现,在饲料中添加植酸酶可提高肉鸡10%~30%的消化率,增加肉鸡体质量[26-27],更可提高肉鸡的免疫水平[28]。在大蛋白溶液中添加植酸酶后有机磷水解率达82.9%,水解后大蛋白溶液中游离钙含量比水解前增加了49.5 mg/kg,玉米面添加植酸酶后有机磷水解率达72.4%,水解后玉米面中游离钙含量比水解前增加了30.5 mg/kg[29]。因此植酸酶能有效地水解食品中的植酸盐,降低其抗营养作用,提高食品的营养价值。本研究选择植酸酶酶解处理,确定酶解时间、酶解温度和酶解pH值条件,以降低大豆蛋白中的植酸含量。
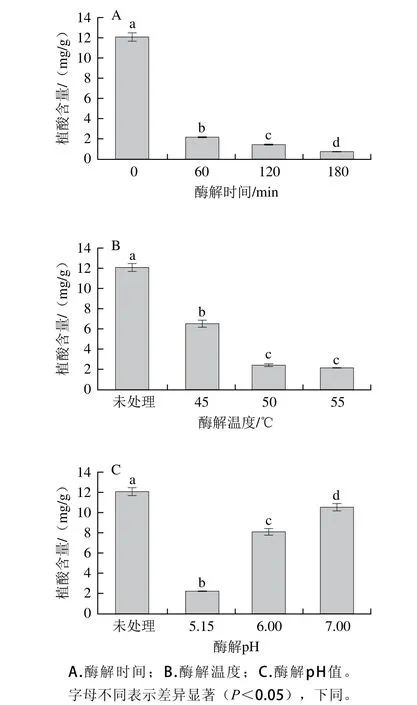
图1 酶解条件对蛋白溶液植酸含量的影响Fig. 1 Effect of enzymatic conditions on the content of phytic acid in soymilk
通常酶解作用时间越长,酶解效果越好[30],如图1A所示,本研究中植酸的去除率也随时间的延长而提高,当酶解时间为60、120 min和180 min时,植酸的去除率分别达82.2%、88.0%、94.4%,因此在60 min时便可达80%以上的去除率。在确定酶解时间的基础上,对酶解温度进行确定,结果如图1B所示。植酸酶的最适作用温度为55 ℃,本研究中也发现当温度为45 ℃时其活性较弱,而在温度为50 ℃和55 ℃时活性较强,对蛋白溶液中的植酸去除率分别为45.9%、80.1%、82.2%。虽然55 ℃为最优反应温度,但对于大豆蛋白中植酸的去除效果,选择50 ℃以上的作用温度便可达到80%以上的去除率。与此同时,植酸酶的最适作用pH值为5.15,本研究也发现pH值对植酸酶的影响最为明显,在pH 5.15时去除率可达82.2%,而在pH 6和pH 7时分别仅为32.9%和12.3%(图1C)。总体而言,pH 5.15,温度50 ℃以上,酶解时间60 min时,植酸去除率即可达80%以上。与普通市售豆基粉的植酸含量相比,市售豆基粉的植酸为10.02~15.61 mg/g[31],而本技术所获蛋白的植酸含量为1.6~2.4 mg/g,与市售豆基粉相比下降了85%以上。
2.2 大豆蛋白特异性水解效果
大豆蛋白按沉降系数可以分为2S、7S、11S、15S,其中主要为7S和11S,7S包括α、α’和β亚基,11S包括A亚基和B亚基,约占大豆蛋白的70%。大豆蛋白具有较多的过敏源,若过敏源的活性越低,其安全性则更大[32]。而大豆中主要的致敏源存在于7S中,因此将7S酶解可降低其致敏性的风险。7S变性温度为75 ℃,在75 ℃加热时易发生变性解离,蛋白粒子发生解聚重排形成球状的聚集体,7S的α、α’、β亚基和酸性多肽(A)会由于其本身具有的高亲水性而暴露聚集在聚集体的外层,从而导致更易被蛋白酶酶解掉,7S组分会急剧消失[17]。因此本研究在前期对大豆进行热烫处理(85 ℃的3‰ NaHCO3溶液热烫10 min)使7S变性,再对蛋白浸提液进行酶解反应处理,实现7S特异性水解,而保留11S的性质,降低大豆的致敏性。
2.2.1 不同蛋白酶酶解效果比较
蛋白酶种类不同,最适作用条件也有不同。本产品设计为婴儿豆基粉,因此需要更尽可能保证产品反应条件更温和,才可更能保证产品品质或营养不受破坏。为比较不同蛋白酶的酶解效果,分别采用风味蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶对蛋白溶液进行酶解处理,采用电泳方式观察不同蛋白酶对7S和11S的酶解交果,结果如图2所示。蛋白溶液在风味蛋白酶和复合蛋白酶酶解1 h后7S还保留有大部分,而碱性蛋白酶已经将7S和11S完全水解,仅中性蛋白酶此时基本将7S水解完全,并还大量保存11S,A、B亚基基本保持不变。因此采用中性蛋白酶可以特异性水解7S,降低其致敏性的风险。
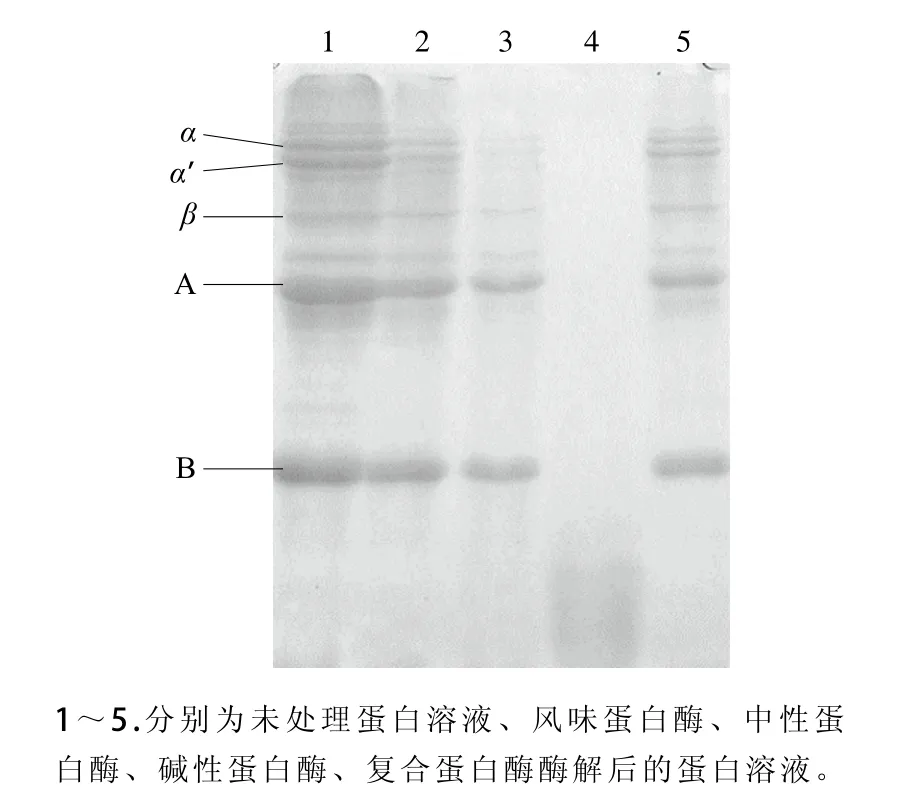
图2 不同蛋白酶酶解蛋白溶液后的SDS-PAGE图谱Fig. 2 SDS-PAGE patterns of soymilk hydrolyzed by various proteases
2.2.2 中性蛋白酶对蛋白溶液中大豆蛋白的酶解条件优化
中性蛋白酶适应性强,在pH 5~8、温度45~60 ℃范围内均有较高活性[33]。为实现中性蛋白酶对7S特异性水解,本研究进一步从电泳角度对中性蛋白酶的酶解温度、酶解时间和pH值条件进行优选,确定最优处理条件,结果如图3所示。

图3 不同酶解条件下蛋白溶液中大豆蛋白样品的SDS-PAGE图谱Fig. 3 SDS-PAGE profiles of soy protein isolate hydrolysates under different enzymatic hydrolysis conditions
与未处理的相比,酶解温度45 ℃和50 ℃时,当酶解10 min以后,大豆蛋白中的7S组分大部分被水解,α、α’、β亚基明显发生了降解,已经基本消失,而11S的A、B亚基基本都还存在。55 ℃酶解的大豆蛋白,7S组分虽然也发生了一定程度的降解,但和45、50 ℃时的酶解情况相比其程度更弱。pH值为5.15时,酶解程度很弱,大豆蛋白组分7S的α、α’、β各亚基变化很小,酶解60 min后效果依然不明显。而pH 6和pH 7时用中性蛋白酶酶解10 min后7S各亚基已基本消失,两者酶解效果没有太大差别。同时也可以看出在pH 6和pH 7时酶解,A、B亚基的下方条带增多,7S的酶解产物的条带也更加明显。结合中性蛋白酶酶解最优条件,在pH 7,温度45 ℃,酶解10 min即可实现7S的水解,可以达到特异性去除致敏蛋白7S的目的。
2.3 低植酸大豆蛋白基料制备及豆基配方粉消化性比较
综合上述研究,从工艺的最优化及成本最低的角度考虑,结合大豆原料的加工处理,提出了低植酸大豆蛋白基料的制备工艺如下:
浸泡大豆进行热烫处理(3‰ NaHCO3溶液、(85±2)℃、10 min)后,打浆除渣获得蛋白浸提液。调节蛋白浸提液pH值至5.15,酸沉处理去除乳清,然后采用植酸酶酶解,使植酸去除率接近90%(最优条件为加酶量1%、pH 5.15、温度50 ℃、酶解处理60 min);接着采用中性蛋白酶进行特异性酶解致敏蛋白,实现7S特异性酶解而保留11S(最优条件为加酶量0.5%、pH 7、温度45 ℃、酶解10 min)。
由于该工艺采用蛋白酸沉处理,因此在酸沉过程中脂肪随之被保留,含量在24%左右,因此在进行豆基配方粉的配方设计时,将蛋白基料中脂肪的含量也考虑其中。在此基础上将蛋白基料与脂肪、碳水化合物进行复配,按每100 kJ所含蛋白质、脂肪、碳水化合物的量参照GB 10765—2010进行设计,经喷雾干燥后制备了豆基婴配方粉。以豆乳粉、市售乳粉为对照,进行酸凝状态比较与体外消化实验,明确本产品的消化特性。
2.3.1 豆基配方粉的酸凝状态比较

图4 不同溶液在pH 4(A)和pH 6(B)条件下的酸凝状态Fig. 4 Flocculation state of different solutions acidified to pH 4 (A) and pH 6 (B)

图5 不同产品酸凝后的黏度变化Fig. 5 Effect of acid clotting on the viscosity of soybean-based formula and milk- based formula
婴儿胃部的环境pH值为4左右,母乳喂养30 min后,其pH值可上升为6.4左右[34]。为明确本产品对婴儿消化性的影响,本研究模拟婴儿胃部环境,分析在pH 4的条件下蛋白溶液消化30 min,然后调升至pH 6时产品的酸凝状态并测定酸凝产品的黏度,确定产品消化性。从图4、5可知,在pH 4条件下,豆乳粉溶液会出现明显的聚集沉淀,这是因为此时pH 4与大豆蛋白的等电点(pH 4.5)接近;当pH值调升至6时,豆乳粉溶液的聚沉现象减少。在pH 4酸凝时,市售乳粉会出现大量絮状物,黏度也会增大;当在胃中消化0.5 h,将pH值调升至6时,絮状物消失,黏度几乎没有变化。牛乳中αs-酪蛋白的大量存在造成了酪蛋白胶束粒子颗粒大,在婴儿胃中(pH 4.0)会形成坚硬的凝块[25],但母乳中酪蛋白组成主要为β-酪蛋白,而且在婴儿胃中几乎不形成凝块[35]。本研究产品获得的豆基配方粉在pH 4时,虽然会有少量沉聚物产生,但并没有发生聚沉,且酸凝后状态松软;当pH值调升至6时,和乳粉一样几乎没有沉聚物,黏度也无明显差别。由此可知,本实验制得的豆基配方粉具有很好的食用舒适性。
2.3.2 婴儿对豆基配方粉的消化情况
一般来说,食品中过敏原为分子质量介于10 000~70 000 Da之间的蛋白或糖蛋白,其中90%的过敏原是蛋白质,只占食品总蛋白的极小一部分,分别属于不同的蛋白家族。但是这些食品过敏原蛋白只要摄入微量即可引起严重的过敏反应。具有抗原特性的蛋白质大多数为具有酸性等电点的糖蛋白,通常都能经受住加热和烹调等加工工艺的处理,并且能抵抗肠道的消化作用,具有一定的抗消化稳定性,从而引起IgE介导的I型变态反应[36-37]。因此,通常将某种蛋白的消化稳定性作为一种重要指标去评价该蛋白的潜在致敏性[38]。

图6 模拟婴儿消化豆基配方粉的SDS-PAGE图谱Fig. 6 SDS-PAGE profile of soybean-based infant formula digested in simulated infant gastrointestinal tract
体外消化模型可用于了解人体胃肠道模拟生理条件下所摄入食物的消化率和结构变化,它具有成本低、无伦理问题、易于取样的优点[39]。因此,为明确本研究复配的豆基配方粉的消化情况,采用婴幼儿体外消化实验模型,对豆基配方粉进行体外模拟消化,结果如图6所示。豆基配方粉在胃的消化过程中,11S的A、B亚基逐渐消失,其中B亚基被消化酶酶解的速率快于A亚基,当进入小肠消化30 min时,可以发现此时蛋白条带已完全消失,未出现普通大豆蛋白基料的抗消化酶解产物[31]。因此可以说该豆基配方粉在婴儿肠道中具有较好的消化性。
3 结 论
本研究以大豆为原料,将浸泡大豆进行热烫处理(3‰ NaHCO3溶液、(85±2)℃、10 min)后,打浆除渣获得蛋白浸提液。调节蛋白浸提液pH值至5.15,酸沉处理去除乳清,然后采用植酸酶酶解,使植酸去除率接近90%(最优条件为酶用量1%、pH 5.15、温度50 ℃、酶解处理60 min);接着采用中性蛋白酶进行特异性酶解致敏蛋白,实现7S特异性酶解而保留11S(最优条件为加酶量0.5%、pH 7、温度45 ℃、酶解10 min)。
进一步按GB 10765—2010将低植酸大豆蛋白基料溶液与脂肪、碳水化合物进行复配,获得低植酸豆基配方粉。该豆基配方粉在体外模拟婴儿胃内环境几乎不形成凝块,有利于婴儿对大豆蛋白质的吸收利用,提高婴儿食用后的舒适性,而且体外消化表明,胃肠消化的豆基配方粉消化性较好,在小肠消化30 min后即可实现全完消化,具有良好的消化食用性。
