植物乳杆菌亚硝酸盐还原酶基因在大肠杆菌中 重组表达、纯化及酶学性质分析
2019-07-04张庆芳李美玉王晓辉胡善松于爽迟乃玉
张庆芳,李美玉,王晓辉,胡善松,于爽,迟乃玉*
1(大连大学 生命科学与技术学院,辽宁 大连,116622) 2(辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
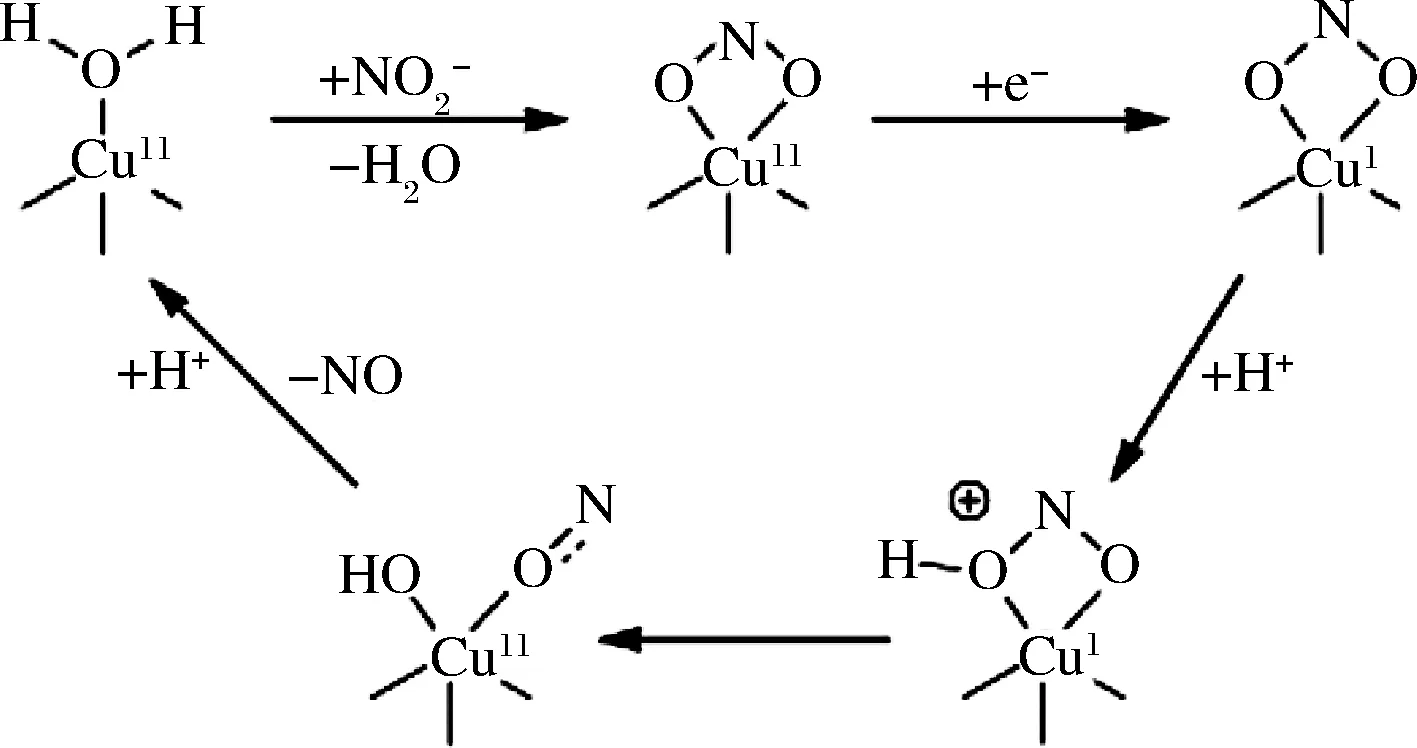
图1 CuNiR中亚硝酸盐还原的作用机理Fig.1 The mechanism of action of nitrite reduction in CuNiR
随后,水复合材料能够重新进入催化体系并发挥其在亚硝酸盐还原中的作用[7]。HORRELL等[8]研究了CuNiR分子与结构特征,但未报道CuNiR酶学性质的研究。本研究在酸菜汤汁中分离得到1株植物乳杆菌(Lactobacillussp.),命名为LMY-20。合成了LMY-20菌株的nir基因,并对其蛋白进行了表达纯化及酶活性质研究,重组NiR温度稳定性较好,为亚硝酸盐还原酶基因的进一步开发及利用提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillussp. LMY-20)从东北酸菜汤汁中分离筛选得到,保藏于大连大学生命科学与技术学院辽宁省海洋微生物工程实验室;表达载体pET28a(+)和E.coliDH5α由Synbio Technologies提供;E.coliBL21(DE3)、pMD-19-T Vector、PowerMaxTM Soil DNA Isolation Kit基因组大量提取试剂盒购自TaKaRa公司;DL2000 DNA Marker、普通琼脂糖凝胶DNA回收试剂盒、限制性内切酶NcoI和XhoI、2xTaq PCR Master-Mix,购自北京TIANGEN生物公司;预染蛋白分子质量标准(PageRuler Prestained Protein Ladder),购自MBI Fermentas公司;Bradford蛋白浓度测定试剂盒,购自上海生工。其他试剂为分析纯。
1.2 培养基
MRS培养基(g/L):葡萄糖20、蛋白胨10、酵母粉4、K2HPO42、牛肉粉8、MgSO40.2、乙酸钠5、柠檬酸三铵2、MnSO40.05、吐温-80 1、琼脂20、pH(6.2±0.2)。
LB培养基(g/L):胰蛋白胨10、酵母浸提物5、NaCl 10。LA培养基:LB液体或固体培养基中加入终质量浓度为100 μg/mL卡那霉素。
1.3 实验设备
Veriti Dx PCR扩增仪,Thermo Fisher Scientific公司;GS-158低温台式离心机,BECKMAN公司;J21-M高速冷冻离心机,BECKMAN公司;台式冷冻离心机,Eppendorf公司;CH1015超级恒温水浴槽,上海恒平仪器厂;Inazge Mlaster RVDS电泳成像系统,Parmacia Biotech公司;DYY-Ⅲ形电泳槽,北京六一仪器厂;Milli-QAcademic超纯水器、pH计,BECKMAN公司。
1.4 实验方法
1.4.1 目的基因的获取与合成
Lactobacillussp. LMY-20于MRS培养基30 ℃,160 r/min振荡培养36 h后离心富集菌体,利用基因组大量提取试剂盒提取基因组DNA。所提DNA送到北京百迈克生物科技有限公司进行DNA质量检测,并使用Illumina Hiseq X10高通量测序平台进行双端测序(PE150),建库大小为270 bp。对测序数据过滤低质量后,利用Velvet软件[9]进行初步组装得到最终基因组框架图。组装得到基因组序列总长度为3.27 Mb,GC含量为44.36%,测序深度为180×。基因预测与功能注释由RAST(rapid annotation using subsystem technology)[10]完成,选取默认参数。亚硝酸盐还原酶基因的获取由基因功能注释结果及BLAST比对NiR参考蛋白序列(ERL45402.1,AHN70577.1,ATO54837.1,AFO84709.1,GAF39669.1,WP_094784585.1,PNE49716.1,PNE49716.1,WP_005922732.1,EAV38847.1,CUW15443.1,OEG23520.1,OJG98603.1)确定,由Synbio Technologies公司对菌株LMY-20的nir基因进行基因全长合成并构建于克隆载体pMD-19-T。
1.4.2 重组表达载体pET28a-nir的构建
以pMD-19-T-nir为模板,nir-F:5-CTCGAGAAAA GACCATGGCCAA-3和nir-R:5-CTTAAGAATCCTGT TTGGAC-3为引物, PCR扩增nir基因。PCR反应条件:94 ℃变性5 min。循环参数为:94 ℃、30 s,65 ℃、45 s(即退火时每圈减少2 ℃),72 ℃、 1 min、5个循环。循环参数为:94 ℃、30 s,55 ℃、 45 s,72 ℃、1 min,72 ℃、 10 s,25个循环,PCR反应结束。PCR产物于1%琼脂糖凝胶上电泳鉴定纯度和分子质量的大小。回收PCR产物,将获得的片段经NcoI和XhoI双酶切后亚克隆至pET28a(+)载体的NcoI和XhoI位点之间,连接产物转化大肠杆菌DH5α,转化子经菌落PCR鉴定筛选出符合要求的阳性克隆,对阳性克隆进行测序NcoI和XhoI双酶切验证,将构建正确的重组质粒命名为pET28a(+)-nir。
1.4.3nir基因的表达
将构建好的表达菌株接种到LB/Kan液体培养基中,37 ℃振荡过夜培养14 h,然后分别按1%的菌液量接种于含有100 mL LB/Kan液体培养基的三角瓶中,37 ℃振荡培养4 h (菌液OD600达到0.4~0.6) 时[11],加入异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)使最终浓度为1 mmol/L,37 ℃诱导时间4 h行诱导表达;同时以空载体和未诱导作对照。将菌液8 000 r/min离心10 min,弃去上清液,沉淀菌体用PBS缓冲液(pH 7.4)洗涤2次,将洗涤后的菌体重悬于10 mL预冷的PBS缓冲液(pH 7.4) 中,超声裂解10 min,每次3 s,间隔5 s,功率200 W。然后10 000 r/min,4 ℃,离心20 min。分别上清液、沉淀为蛋白样品经变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE) 检测,记录并分析结果。
1.4.4 NiR蛋白包涵体的变性溶解与纯化
上述沉淀物用20 mL包涵体洗涤液(2 mol/L尿素,1‰ 曲拉通X-100(体积分数),1‰ 十二烷基肌氨酸钠(体积分数),1 mmol/L DTT,20 mmol/L Tris-HCl (pH 8.0),1 mmol/L EDTA,50 mmol/L NaCl)在4 ℃条件下洗涤3次,置8 000 r/min离心20 min;洗涤后的沉淀用10 mL蛋白质变性液(6 mol/L 尿素,1 mmol/L DTT,1%(体积分数)十二烷基肌氨酸钠)重悬包涵体,8 000 r/min离心30 min,弃掉沉淀;将上述变形后的蛋白液用复性液(20 mmol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L DTT,0.1%(体积分数)曲拉通X-100, 20%(体积分数)甘油)4 ℃搅拌透析24 h后,逐渐换到终体积分数为10%甘油,4 ℃搅拌透析24 h。 透析袋中的目的蛋白包涵体经变性溶解后为粗酶液[12-13]。粗蛋白Ni+-NTA亲和层析柱(Novagen)进行亲和层析纯化[14],洗脱蛋白液4 ℃保存,蛋白样品经SDS-PAGE检测,记录并分析结果。
1.4.5 蛋白质浓度测定
蛋白浓度通过Bradford蛋白浓度测定试剂盒(bradford protein assay kit) 测定。
1.4.6 NiR酶活性的测定[15-16]

测定酶活反应体系(500 μL)(μL):0.1 mol/L磷酸盐缓冲液(pH 6.5) 50,0.1 mol/L NaNO225,0.1 mol/L MV 15,0.1 mol/L Na2S2O480,酶液300。37 ℃水浴中反应10 min,剧烈振荡终止反应(以磷酸缓冲液为空白)。取10 μL用盐酸萘乙二胺法测定亚硝酸盐残留量。亚硝酸还原酶活力单位通过在37 ℃ 下,每分钟还原1 μmol亚硝酸盐所消耗的酶量来表示。比活力用1 mg蛋白质中酶的活力单位数来表示。
1.4.7 重组NiR的性质分析
最适反应温度:在pH 6.5的PBS缓冲溶液条件下,在4、10、20、25、30、35、37、40、50、60、70 ℃下测定酶活,以37 ℃的酶活为100%计算相对酶活。
酶的热稳定性:将酶液分别置于不同温度(4、10、20、25、30、35、37、40、50、60、70 ℃)下水浴40 min,在pH6.5的PBS缓冲溶液中和最适反应温度下检测残余酶活,并以未保温时的酶活为100%计算相对酶活。
最适反应pH值:在最适酶活反应温度下,分别用0.25 mol/L、pH 2.0、3.0、4.0、4.5、5.0、5.5、6.0的柠檬酸-柠檬酸钠缓冲液;0.25 mol/L、pH 6.5、7.0、 7.5、8.0的Tris-HCl缓冲液;分别用0.25 mol/L、pH 9.0、10.0、11.0的Na2HPO4-NaOH缓冲液中测定酶活,以pH 6.5的酶活为100%计算相对酶活,绘制酶活曲线。
酶的pH值稳定性:将酶液分别置于上述缓冲液中水浴40 min,在最适反应pH值和最适反应温度下检测残余酶活,并以未保温时的酶活为100%计算相对活性,绘制酶活曲线。
金属离子及EDTA对酶活性的影响:分别向反应体系中加入终浓度为1、5 mmol/L的Zn2+, Cu2+, Ba2+, Na+, Fe3+, Mg2+, Al3+, Mn2+及EDTA,在标准条件下测定酶活,并和不添加任何金属离子的酶活进行比较,计算相对活性,每次做3组平行实验。
1.4.8 动力学分析
在标准条件下,分别测定0.01~0.1 mol/L NaNO2存在条件下NiR的动力学参数。以Origin 8.0 对数据进行拟合,推算酶催化的Km及Vmax,依据测定蛋白含量,计算kcat及催化效率(kcat/Km),所有测定设置3个平行。
2 结果与分析
2.1 目的基因PCR扩增产物的鉴定
以质粒pMD-19-T-nir为模板,用引物nir-F和nir-R PCR扩增nir基因,PCR产物经1%(质量分数)琼脂糖凝胶电泳,可见约1.3 kb的特异性条带(图2),大小与预期相符(1.262 kb)。
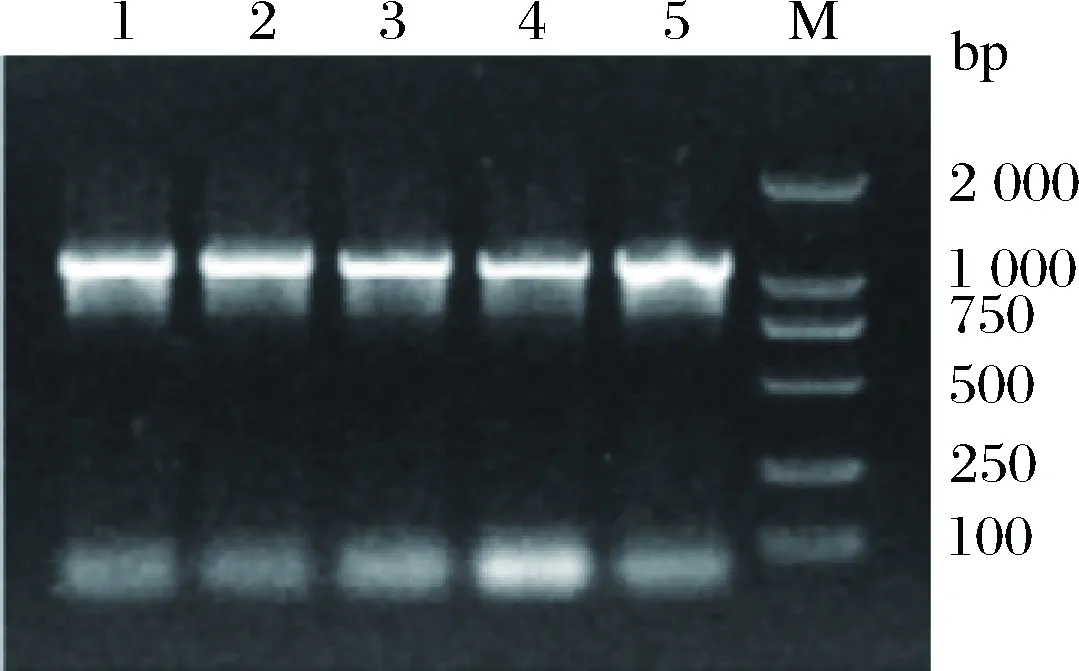
1~5-nir基因的PCR产物;M-DNA marker DL2000图2 亚硝酸盐还原酶基因PCR产物Fig.2 Electrophoretic profile of the PCR product of nir
2.2 重组表达载体pET28a(+)-nir的鉴定
重组表达载体pET28a(+)-nir经NcoI和XhoI双酶切,1%琼脂糖凝胶电泳分析,可见约5.4 kb的载体片段和1.3 kb的目的基因片段(图3)。对重组表达载体pET28a(+)-nir进行DNA测序,结果显示插入基因序列与设计序列完全一致,成功构建了重组表达载体pET28a(+)-nir。

M-DNA marker DL5000;1-pET28a(+)-nir的酶切产物;2-未酶切的pET28a(+)-nir图3 重组表达质粒pET28a(+)-nir的酶切鉴定Fig.3 Identification of the pET28a(+)-nir plasmid digested with NcoI and XhoI
2.3 NiR目的蛋白诱导表达
将经鉴定正确的原核重组表达质粒载体pET28a(+)-nir转化至表达宿主菌E.coliBL21(DE3)中诱导表达。菌体裂解物进行SDS-PAGE电泳,由图4可知,泳道空载、未诱导宿主菌株和诱导菌株的破碎上清液均未见目的蛋白,而诱导菌株的破碎沉淀泳道约45 kDa位置处出现特异条带,与预期表达的相对分子质量(44.959 kDa)相符,说明目的蛋白NiR在宿主菌E.coliBL21(DE3)中成功表达,但只在沉淀中检测到目的蛋白,由此可知,目的蛋白NiR在大肠杆菌中以包涵体形式不可溶表达。

1-诱导pET28a(+)-nir/BL21(DE3)沉淀;2-诱导pET28a(+)-nir/BL21(DE3)上清;3-未诱导pET28a(+)-nir /BL21(DE3) 沉淀;4-未诱导pET28a(+)-nir /BL21(DE3) 上清;M-蛋白质marker图4 目的蛋白NiR的SDS-PAGE检测结果Fig.4 SDS-PAGE analysis of NiR protein
2.4 包涵体复性与Ni+-IDA亲和纯化
在低温条件下,将离心所得的包涵体先用缓冲液洗涤,除去包涵体表面杂质,再对包涵体进行溶解,收集上清液。经透析复性,去除高浓度尿素,逐渐恢复重组蛋白空间构象,复性后的蛋白为粗酶液,其NiR酶活为33.97 U/mg。
蛋白复性液通过Ni+-NTA亲和层析法纯化重组NiR(图5)。纯化NiR总蛋白含量为10.3 mg,比活力为226.48 U/mg,总活力为2 332.72 U,总回收率为63.00%,纯化倍数为7.32(表1)。
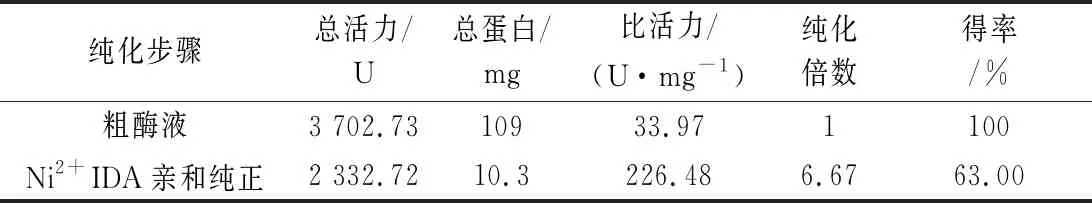
表1 重组NiR的纯化Table 1 Summary of NiR enzyme
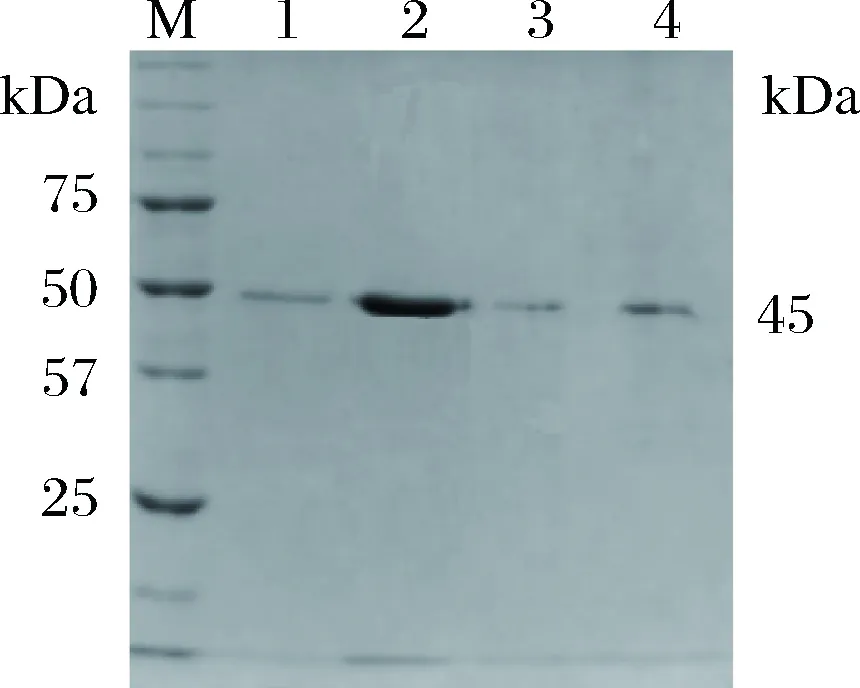
M-蛋白质marker;1~4-Ni2+柱的80、100、150、300 mmol/L咪唑溶液洗脱液图5 纯化产物的SDS-PAGE分析Fig.5 SDS-PAGE profile of purified NiR
2.5 酶学性质研究
2.5.1 pH对酶活性的影响
由图6-a可知,重组NiR相对酶活在pH 2.0~12.0先升高后降低,在pH为6.5时达到最大值,之后相对酶活逐渐降低,因此,重组NiR的最适pH值为6.5。在37 ℃条件下,分别采用不同pH值的PBS缓冲液孵育重组NiR,结果表明,该酶在pH 6.5~8.0的稳定性较好,相对酶活保持在60%以上。其中,在pH为7.0时最稳定(图6-b)。

a-最适pH; b-酶的pH稳定性图6 pH和酶的pH稳定性对重组NiR酶活力的影响Fig.6 Effect of reaction pH and pH stability of the enzyme on NiR enzymes activity
2.5.2 温度对酶活性的影响
由图7-a可知,重组NiR最适温度为37 ℃,在25~40 ℃时具有85%以上的相对酶活。在pH 6.5条件下,分别在不同温度下孵育重组NiR,结果表明,该酶在4~40 ℃的温度稳定性较好,相对酶活保持在65%以上(图7-b),具有广泛的温度适应性。

a-最适温度;b-酶的热稳定性图7 温度和酶的热稳定性对重组NiR酶活力的影响Fig.7 Temperature and thermal stability of the enzyme on NiR enzymes activity
2.5.3 金属离子及EDTA对酶活性的影响
Fe3+、Cu2+和Na+对重组NiR有促进作用,其中Na+促进作用明显; Mg2+、Mn2+和Zn2+对该酶的酶活力有轻微抑制作用,该酶的酶活力被Al3+、EDTA和苯甲基磺酰氧(phenylmethanesulfonyl fluoride, PMSF)强烈抑制(表2)。
2.6 动力学分析
在标准方法和条件下,在pH 6.5和37 ℃下研究NiR动力学参数Km和Kcat。Km和Kcat的值分别为0.38 mmol/L和0.27×103s-1(图8)。NiR的催化效率可以用kcat/Km计算,计算值为1.4×106mmol/(L·s)。
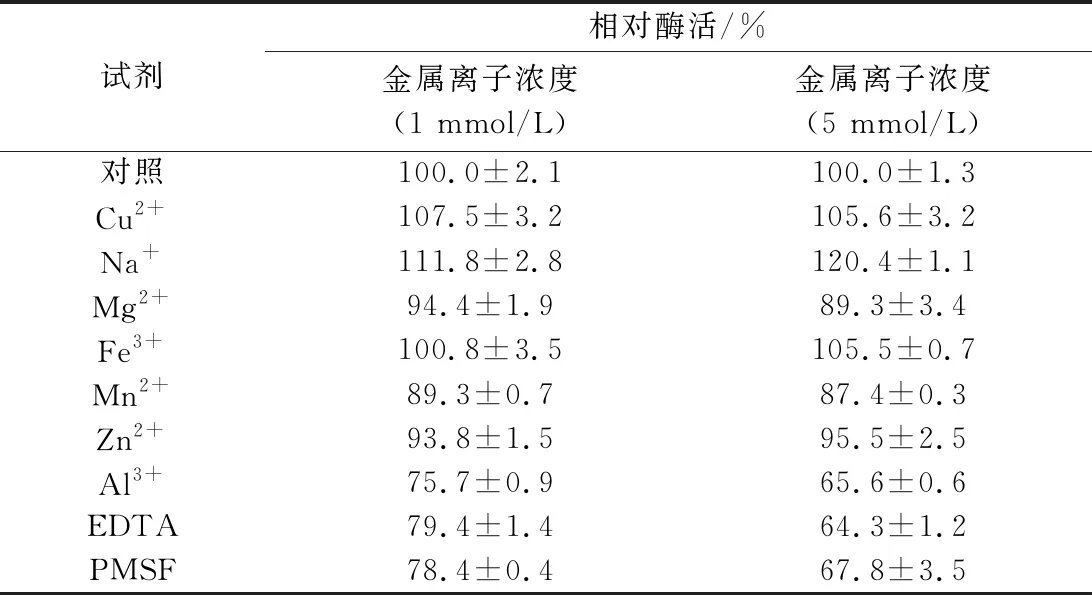
表2 金属离子及EDTA对酶活性的影响Table 2 Effects of various reagents on the activity of NiR
注:数值为平均值±SD。
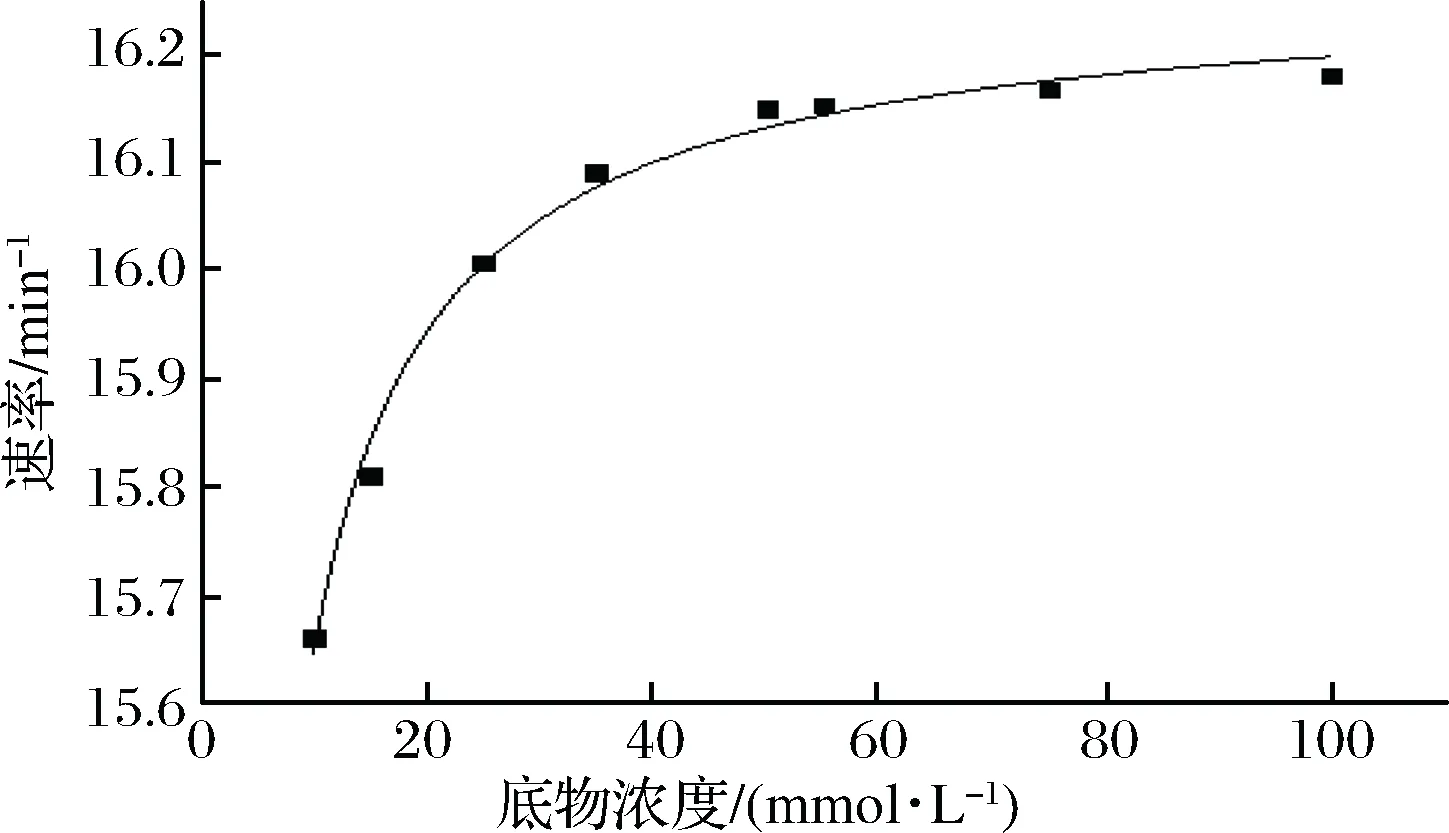
图8 在pH 6.5和37 ℃下NiR降解NaNO2的动力学Fig.8 Kinetics of NiR degradation of nitrite at pH 6.5 and 37 ℃
3 讨论
亚硝酸盐还原酶大多数为胞内酶,受分离纯化技术的影响,该酶的应用受到了极大限制[17]。E.coli表达系统具有成本低、繁殖快、表达量高、遗传背景研究深入清楚以及有大量可利用的表达载体、宿主和纯化系统等优点,成为目前应用最广的表达体系[18-19]。但由于宿主蛋白的异源表达可能缺乏某些蛋白质折叠所需的辅助因子或调节蛋白折叠机制及环境不适等,使次级键在折叠过程中较难正确形成,易形成失去原有蛋白质特性和功能的包涵体[20-21]。本研究采用超声波冰浴破壁法裂解细菌,细胞破壁效果较好,用洗涤液洗涤包涵体,经变性液溶解变性,再经复性液复性,最后用镍亲和层析法得到了浓度和纯度较高的目的蛋白。
本实验中我们选择了带有NcoI酶切位点的表达载体pET-28a,该表达载体多克隆位点C端有一个能编码6个组氨酸的融合标签His-Tag,6×His通常不影响表达产物的生物学活性,因而不必通过酶水解获得目的蛋白,使表达的整个过程更为简单,同时该融合标签可用于目的蛋白的检测和纯化。在融合标签His-Tag后还相连一个终止密码子TGA,它保证了目的蛋白和His-Tag的完整表达[22-24]。截至目前,文献报道亚硝酸盐还原酶主要集中于甜菜、小麦、菠菜等植物中[17, 25],而微生物亚硝酸盐还原酶报道较少[26]。本研究成功将亚硝酸盐还原酶基因连接至原核表达载体pET-28a上,然后将重组载体pET-28a-nir转化到表达宿主E.coliBL21中,利用IPTG进行诱导表达后经SDS-PAGE检测显示为不可溶的包涵体表达,随后进行包涵体复性及镍柱亲和层析纯化蛋白,并研究了重组NiR的性质。结果表明,该酶具有广泛的温度适应性和稳定性,为NiR的应用及工业化生产奠定基础。
