右美托咪定或BNIP3基因siRNA对PC12细胞凋亡的影响
2019-07-04李坤旺冯智英樊理华彭志友陈苗妙章玲宾徐巧敏游敏吉
李坤旺 冯智英 樊理华 彭志友 陈苗妙 章玲宾 徐巧敏 游敏吉
(1浙江大学医学院附属第一医院疼痛科,浙江 杭州 310003;丽水市人民医院 2麻醉科;3重症医学科)
随着社会老龄化,越来越多老年患者因各种疾病需要手术治疗,而多种神经退行性病常在老年人发生,且发病率呈现出逐年上升趋势〔1,2〕。神经退行性病发生发展与氧化应激存在密切关系〔3〕。过氧化氢(H2O2)是一种常用的引起细胞发生应激的诱导剂,在细胞凋亡模型建立中有广泛的应用,研究表明,H2O2可诱导大鼠肾上腺嗜铬瘤(PC)12细胞凋亡〔4〕。因此,本研究也使用H2O2作用PC12细胞凋亡的诱导剂。右美托咪定(DEX)是一种具有高度选择性的α肾上腺素受体激动剂,具有轻度麻醉、镇痛及镇静等作用,多项研究表明,DEX对神经有保护作用。如DEX可保护低氧、利多卡因等因素诱导的PC12细胞损伤〔5,6〕。但DEX对H2O2诱导的PC12细胞凋亡及机制研究尚未明确。Bcl-2腺病毒E/B19 kDa相互作用蛋白(BNIP3)是B淋巴细胞癌基因(Bcl)-2家族中BH3-only亚家族的一个成员,发挥促凋亡作用,可诱导胰腺癌、骨肉瘤等多种肿瘤凋亡〔7,8〕,BNIP3对PC12细胞凋亡的影响研究较少,有研究显示,低氧条件可上调BNIP3表达,BNIP3表达抑制可降低由低氧诱导的PC12细胞损伤〔9〕,但BNIP3对H2O2诱导的PC12细胞凋亡影响及机制尚未明确。本研究旨在探讨DEX及BNIP3 siRNA单独或联合对H2O2诱导的PC12细胞凋亡影响及机制。
1 材料与方法
1.1细胞及主要试剂和仪器 PC12细胞购自美国ATCC。DEX购自江苏恒瑞医药股份有限公司;噻唑蓝(MTT)、2',7'-二氯荧光黄双乙酸盐(DCFH-DA)均购自美国Sigma;细胞凋亡试剂盒购自江苏凯基;BNIP3、核因子(NF)-κB p65、κB抑制蛋白激酶(IKK)α和Bcl-2抗体均购自美国CST;Multiskan酶标仪购自美国Thermo;FACSCalibur流式细胞仪购自美国BD。
1.2转染 PC12细胞在含有10%胎牛血清(FBS)及青霉素和链霉素各100 U/ml的完全杜尔伯克改良基础培养基(DMEM)培养基(瓶底铺0.1 mol/L的多聚赖氨酸)中,于37℃、5%体积分数CO2培养箱中培养。细胞处于生长对数期且达70%生长融合时,以2×106/ml密度接种于6孔板,孵育24 h后分别转染靶向抑制BNIP3的siRNA(si-BNIP3组),并同时转染阴性对照siRNA(NC组)及设置空白组,siRNA由上海吉玛设计及合成,转染参照LipofectamineTM2000说明(美国,Invitrogen 公司)。转染48 h,收集细胞,用于实验研究。
1.3分组及处理 PC12细胞分为NC组、H2O2组、DEX组、si-BNIP3组和DEX+si-BNIP3组,均无血清培养24 h,除NC组外,均给予200 μmol/L终浓度的H2O2,处理24 h后DEX组加入100 μmol/L DEX处理48 h,si-BNIP3组转染靶向抑制BNIP3的siRNA 48 h,DEX+si-BNIP3组加入100 μmol/L DEX后瞬时转染靶向抑制BNIP3的siRNA。
1.4MTT法检测细胞活力 接种PC12细胞于96孔板,每孔5×103个细胞,体积200 μl,培养24 h后按照1.3分组处理,处理至规定时间后加MTT溶液(5 mg/ml),每孔20 μl,孵育4 h后终止培养,将培养上清液吸出,加入二甲基亚砜(DMSO)150 μl,震荡混匀10 min,490 nm波长,酶标仪测定各孔的吸光度值(A值)。实验重复3次。
1.5流式细胞术检测细胞凋亡率 预冷的磷酸盐缓冲液(PBS)洗涤按照1.3分组处理至规定时间的细胞,取(5~10)×104重悬的细胞,1 000 r/min离心5 min,弃上清,用适量1×结合缓冲液悬浮细胞,加入5 μl的Annexin V-FITC,混匀后再加入10 μl的碘化丙啶(PI),避光室温反应15~20 min,上机前加入1×结合缓冲液400 μl,1 h内上机,流式细胞术检测细胞凋亡率。实验重复3次。
1.6流式细胞术检测ROS含量 以(1~2)×104/ml密度接种PC12细胞的细胞悬液于培养瓶内,细胞贴壁生长达80%~90%时,参照1.3分组处理细胞,收集处理至规定时间的细胞,悬浮细胞于含DCFH-DA(终浓度10 μmol/L)的无血清培养液中,37℃孵育20 min,流式细胞仪检测。由于ROS探针DCFH-DA本身不含荧光,但能穿过细胞膜,在胞内的ROS可将不带荧光的DCFH氧化为有荧光生成的DCF,因此检测DCF的荧光强度可反映出细胞内ROS水平。
1.7Western印迹法 放射免疫沉淀法(RIPA)裂解液适量提取细胞总蛋白,二喹啉甲酸(BCA)法对蛋白定量,每孔道上样40 μg总蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白分离后电转聚偏氟乙烯(PVDF)膜,膜转好后用5%脱脂奶粉封闭2 h,洗膜,4℃摇床孵育BNIP3、NF-κB p65、IKKα和Bcl-2抗体(均为1∶1 000稀释)过夜,洗膜,加入辣根过氧化物酶(HRP)标记的抗体,室温孵育1.5 h,ECL显色。甘油醛-3-磷酸脱氢酶(GAPDH)为内参,Quantity软件分析各蛋白条带灰度值。实验重复3次。
1.8统计学方法 采用SPSS21.0软件进行方差分析,SNK-q检验。
2 结 果
2.1BNIP3 siRNA转染PC12细胞效果 si-BNIP3组 BNIP3表达(0.084±0.010)显著低于空白组(0.506±0.046,P<0.05),而NC组BNIP3表达(0.518±0.050)与空白组差异无统计学意义(P>0.05)。见图1。
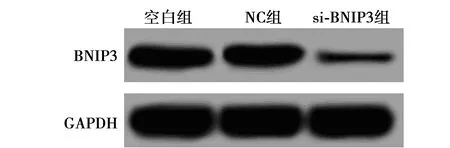
图1 BNIP3 siRNA转染PC12细胞后BNIP3蛋白表达电泳图
2.2DEX或BNIP3 siRNA对PC12细胞活力的影响 H2O2刺激可明显降低PC12细胞活力(0.268±0.035),与NC组(0.722±0.063)比较差异有统计学意义(P<0.05),而DEX(0.455±0.046)及BNIP3 siRNA(0.512±0.053)均可促进PC12细胞活力,与H2O2组比较差异显著(P<0.05),联合使用DEX和BNIP3(0.703±0.074)对细胞活力促进作用更明显,与DEX组和si-BNIP3组比较差异显著(P<0.05)。
2.3DEX或BNIP3 siRNA对PC12细胞凋亡的影响 H2O2组细胞凋亡率〔(36.86±3.78)%〕显著高于NC组〔(3.02±0.34)%〕,DEX组和si-BNIP3组细胞凋亡率〔(23.14±2.11)%、(20.56±2.03)%〕显著低于H2O2组,显著高于DEX+si-BNIP3组〔(9.23±0.72)%,P<0.05〕 见图2。

图2 DEX或BNIP3 siRNA对PC12细胞凋亡的影响
2.4DEX或BNIP3 siRNA对PC12细胞ROS水平的影响 H2O2组细胞ROS水平(荧光强度47.54±3.11)显著高于NC组(20.15±0.76),DEX组和si-BNIP3组细胞ROS水平(荧光强度34.26±2.24,30.06±20.02)显著低于H2O2组,显著高于DEX+si-BNIP3组(23.32±1.47,P<0.05)。
2.5DEX或BNIP3 siRNA对PC12细胞NF-κB信号的影响 H2O2组细胞NF-κB p65和IKKα的蛋白表达水平显著高于NC组(P<0.05),Bcl-2的蛋白表达水平显著低于NC组(P<0.05);DEX组和si-BNIP3组细胞NF-κB p65和IKKα的蛋白表达水平显著低于H2O2组(P<0.05),显著高于DEX+si-BNIP3组(P<0.05),Bcl-2的蛋白表达水平显著高于H2O2组(P<0.05),低于DEX+si-BNIP3组(P<0.05)。见图3,表1。

1~5:NC组、H2O2组、DEX组、si-BNIP3组、DEX+si-BNIP3组图3 DEX或BNIP3 siRNA对PC12细胞NF-κB信号的影响

表1 5组NF-κB p65、IKKα、PCNA和Bcl-2的蛋白相对表达量比较
与NC组比较:1)P<0.05;与H2O2组比较:2)P<0.05;与DEX+si-BNIP3组比较:3)P<0.05
3 讨 论
氧化应激与多种慢性及急性神经退行性疾病密切相关,虽机制尚未明确,但氧化应激可诱导细胞发生凋亡〔3〕。H2O2是ROS的一个主要活性成分,可以跨膜进入细胞,是常用的一种氧化应激诱导剂。有研究表明,在脂多糖、TNF-α等凋亡促进因素作用下,凋亡细胞内H2O2的含量明显增多,且H2O2的暴露可引起原代神经细胞、PC12细胞等多种细胞发生凋亡,且多项研究已使用H2O2建立PC12细胞凋亡模型〔10,11〕,因此,本研究也使用H2O2作为PC12细胞凋亡的诱导剂。
DEX作为一种麻醉辅助药在临床上有广泛的应用,DEX对神经损伤有一定的保护作用。如DEX可减低由谷氨酸引起的PC12细胞损伤〔12〕;DEX可增加由氧氟化碳(COCl2)引起的PC12细胞存活率降低,且抑制细胞的凋亡〔13〕。有研究表明,50~200 μmol/L的DEK均可降低由H2O2诱导的PC12细胞凋亡,因此本研究选择100 μmol/L的DEK作为研究对象〔14〕。细胞凋亡调控是一个复杂的过程,死亡受体途径及线粒体途径是各种凋亡信号的主要传递途径,可活化细胞内caspase,因而引起细胞的死亡。BNIP3隶属于Bcl-2蛋白超家族,是一个促凋亡蛋白,在多种肿瘤中表达沉默,过表达BNIP3可抑制肿瘤细胞的生长〔15〕。在神经损伤中BNIP3的研究较少,有研究发现,缺氧、脑缺血再灌注损伤可上调BNIP3表达,引起神经细胞凋亡,而下调BNIP3表达可降低神经细胞凋亡〔16〕。目前RNA干扰(RNAi)在基因功能研究、疾病治疗等方面应用广泛〔17〕。本研究发现BNIP3 siRNA及DEX均可增加PC12细胞活力,抑制细胞凋亡,合用对细胞活力及凋亡影响更明显。这提示BNIP3 siRNA及DEX可产生叠加效应用于神经损伤保护。
ROS可快速地影响酶、膜脂质及一些其他的细胞成分,进而引起细胞的凋亡。已证实H2O2引起的PC12细胞凋亡与ROS在细胞内含量增加有关〔18〕。本研究发现BNIP3 siRNA和DEX均可降低PC12细胞ROS水平,两者联合降低ROS水平更明显。这提示ROS水平降低可能是BNIP3 siRNA和DEX抑制PC12细胞凋亡的一条途径。众所周知,MAPK、NF-κB等多种信号通路对细胞凋亡具有调节作用,NF-κB是一个核转录因子,几乎在所有的真核细胞中存在,有研究表明,NF-κB信号活化可导致PC12细胞凋亡,而抑制NF-κB信号可通过调节下游抑凋亡蛋白Bcl-2、凋亡抑制因子survivin等与凋亡相关蛋白的表达而抑制细胞凋亡〔19,20〕。本研究结果显示,BNIP3 siRNA及DEX均可下调NF-κB信号NF-κB p65和IKKα,上调Bcl-2表达,两者合用对NF-κB p65和IKKα表达抑制及Bcl-2表达促进作用更明显。这提示BNIP3 siRNA及DEX对PC12细胞凋亡的影响与抑制NF-κB信号有关。
