富锶水体处理对大黄鱼耳石和肌体中锶含量的影响
2019-07-03姜亚洲袁兴伟蒋宏雷焦海峰程家骅李圣法
张 辉,姜亚洲,袁兴伟,张 翼,蒋宏雷,焦海峰,程家骅,李圣法
(1.中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090;2.宁波市海洋与渔业研究院,浙江宁波 315012)
大黄鱼(Larimichthys crocea)是我国近海重要的增殖放流品种,其增殖放流工作开展已有10余年的历史[1]。基于锶元素的耳石元素指纹标记是研建小规格大黄鱼增殖放流苗种规模化标记技术的重要探索方向[2-5]。该项标记技术主要通过阶段性提升增殖放流鱼苗饲养水体中锶元素浓度,使其在处理鱼苗特定耳石区位富集,进而达到对处理鱼苗耳石元素指纹标记的目标。目前,对于该方面的研究报道较多,我国学者先后报道了大麻哈鱼(Oncorhynchus keta)[6]、黑鲷(Acanthopagrus schlegeli)[7]、鳙 (Aristichthys nobilis)[8]等物种的锶元素耳石元素指纹标记。张辉等[9]也通过富锶水体浸泡标记实验,从耳石元素指纹标记建立角度对利用该项技术开展大黄鱼鱼苗标记的可行性进行了实证研究。但该研究由于未能动态跟踪标记处理后耳石和肌体中锶元素含量的变化规律,致使耳石元素指纹标记的稳定性问题和标记过程是否会因提升受试鱼苗肌体中锶元素浓度进而引发食品安全问题等均有待进一步验证。
鉴于此,本研究拟通过开展富锶水体对大黄鱼鱼苗的浸泡标记实验,在系统分析受试鱼苗耳石Sr/Ca值对富锶水体标记过程的响应方式、探究耳石元素指纹标记稳定性的同时,动态跟踪受试鱼苗肌体和主要脏器中锶含量的变化规律,以期明确标记过程是否存在相关食品安全性风险。
1 材料与方法
1.1 实验设计
实验用大黄鱼取自浙江省象山县象山湾大黄鱼苗种繁育中心,为育苗后28 d的幼鱼。实验使用6个1 000 L的圆柱形黑桶,其中3个桶为处理组,另3个桶为对照组,每个桶中置有大约5 000尾大黄鱼幼鱼,养殖用水为经过三级处理后的天然海水。养殖期间的水温为20.7~23.0℃,盐度为 27.0~27.5,pH值保持在 7.8~8.5之间。育苗室的光强控制在1 000 lx以下。每个桶内均匀放置2个充气石,保持水中氧气充足。饵料主要投喂天然海区捕捞的活桡足类。根据实验前的海水测定,该苗种繁育中心的海水Sr2+浓度为(6.07±0.68)mg·L-1。据张翼等[7]研究发现,受试鱼苗成功标记的判别标准为任意点位Sr/Ca值均超过标记检测基线(即对照相应耳石区位Sr/Ca值均值与其3.3倍标准差之和)。鉴于此,本研究中处理组选用原海水3倍Sr2+浓度的富锶海水,每次换水后,在处理组中加入一定量的SrCl2·6H2O来调节Sr2+的浓度,使得处理组水中的Sr2+浓度保持在18mg·L-1。实验时间为2015年3月29日—4月4日,共7d。实验结束后,将各组大黄鱼幼鱼移至网箱暂养。
1.2 样品采集
实验样品的采集包括实验前、实验期间、实验结束后期3部分:
1)实验前,从3个处理组和3个对照组中随机采集大黄鱼幼鱼样品各30尾,处理组和对照组分别用T-0和C-0表示(数字表示实验的天数,以下同)。
2)实验期间,采集最后一天大黄鱼幼鱼,采集的样品包括处理组和对照组的6个桶,每个桶各采集30尾样品,处理组和对照组分别用T-7和C-7表示。
3)实验结束后,分11次采集大黄鱼幼鱼的样品,第1次为实验开始后的第8天采集,第2~10次为之后每隔3 d采集一次样品,第11次即最后一次为实验开始后的第66天采集样品。每次采集的样品包括处理组和对照组的6个桶,每个桶各采集30尾样品。第1次采集的样品处理组和对照组分别用T-8和C-8表示,其后的样品处理组和对照组后面的数字分别以实验开始后的天数来表示。采样时间以及处理组与对照组的平均体长见图1。
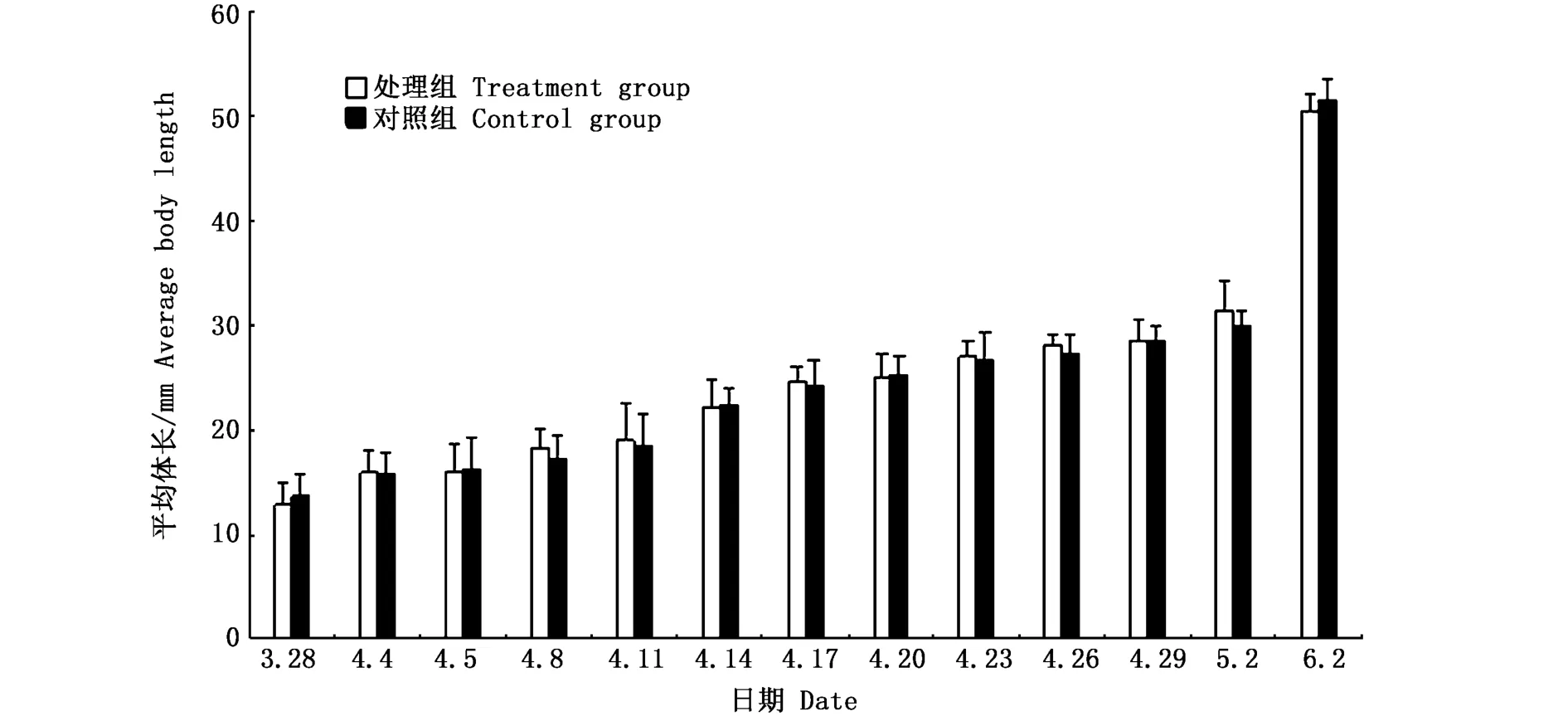
图1 大黄鱼处理组与对照组的平均体长变化Fig.1 Variations of average body length between treatment group and control group of Larimichthys crocea
1.3 元素分析
1.3.1 仪器和试剂
肌体消融主要通过SCP DigiPREP石墨消解仪进行消融,肌体元素分析采用Thermo X Series II ICPMS(Thermo Fisher Scientific, Bremen,Germany),耳石元素通过LA-ICPMS进行分析。
肌肉元素分析需要的试剂包含:1)钇标准溶液:1g·L-1,硝酸(2+98)介质;2)内标溶液:取1g·L-1钇标准溶液0.25 mL,加异丙醇10 mL,硝酸10 mL,用水定容至 500 mL,配成含钇 500 μg·L-1的溶液,常温下可保存至少3个月;3)质谱调谐液:选取10μg·L-1的铝、镁、铑、钇溶液为质谱调谐液,硝酸(2+98)介质。
1.3.2 样品处理
1)耳石处理:样品处理时,首先取出大黄鱼幼鱼的矢耳石,参照张翼等[10]的方法将耳石包埋、研磨和抛光,制成厚度约为0.5 mm左右的薄片,用于后续的分析。
2)肌体处理:包括对大黄鱼幼鱼鳃、肾脏、肝脏和肌肉采集,其中肌肉每次均采集,而鳃、肾脏和肝脏由于分量太轻,不能达到ICPMS仪器的检测最低限,因此只采集最后一次个体较大的。采集后的样本分别进行常压消解,消解的样本每份在0.50~2.00 g之间,将消解的样本置于消解罐中后,加入7 mL硝酸,然后将消解罐置于石墨消解仪上进行消解,消解流程参数见表1。消解结束后,待样本溶液冷却至室温,将消解液转移至50 mL比色管,用去离子水定容混匀,测定前用去离子水稀释10倍。

表1 常压消解流程参数Tab.1 Parameters of processing under normal peressure
1.3.3 样本分析
仪器点火稳定后,通过X-Y轴旋钮调节炬管位子,并改变等离子条件,使调谐元素的灵敏度及稳定性最佳且干扰最小。
1)耳石元素分析:采用激光线扫描测量,具体的耳石元素检测方法参照张翼等[10]的方法进行。
2)肌体元素分析:根据樊祥等[11-12]的研究,先将标准溶液引入仪器,再将试剂空白溶液、样本溶液引入仪器,在线加入内标溶液进行测定,将测定的数据进行分析并绘制标准曲线,计算线性回归方程。根据样本溶液中锶的信号强度,与标准曲线比较,计算大黄鱼幼鱼样本中锶的含量。
1.4 数据分析
为了反映处理组和对照组标记时间段耳石Sr/Ca值之间以及处理组和对照组在标记过程和标记之后的肌肉、鳃、肝脏、肾脏锶含量之间的差异,本研究利用SPSS 19.0软件系统中的独立样本t检验分别对其之间的差异进行比较。
2 结果与分析
2.1 Sr/Ca值组成
通过ICPMS检测发现,实验前,所有的大黄鱼幼鱼耳石在离耳石核心0~0.20 mm处,锶含量均较高,且不稳定;处理组和对照组耳石中的Sr/Ca并没有明显的差别。经过7 d的富锶水体浸泡处理,可以发现,与对照组相比,处理组大黄鱼幼鱼的耳石在距离耳石核心0.30 mm处锶含量开始出现上升的趋势,且在距离耳石核心0.40~0.50 mm处达到最高峰,并在该区段处于稳定趋势。随着富锶水体浸泡实验的结束,在距离耳石核心0.50 mm之后开始出现下降趋势,直至距离耳石核心0.60 mm处,回落至对照组水平(图2)。该区段处理组与对照组的Sr/Ca值分别为(3.42±0.90)mmol·mol-1和(1.52±1.52)mmol·mol-1。对处理组在该区段的Sr/Ca均值通过独立样本t检验表明,处理组与对照组之间的 Sr/Ca值有着极显著差异(P<0.01)。检测结果同时表明,在处理组的所有样品中,在距离耳石核心0.30~0.60 mm区段存在该峰值的样品鱼达到100%。

图2 处理组和对照组的锶钙比值Fig.2 Value of Sr/Ca in treatment and control groups
2.2 肌肉的锶含量
利用ICPMS进行检测分析,经独立样本t检验得出,实验前,大黄鱼幼鱼处理组和对照组肌肉中的锶含量差异不显著(P>0.05)。富锶水体处理的最后一天,大黄鱼幼鱼处理组和对照组肌肉中的锶含量差异显著(P<0.05),处理组肌肉中的锶元素平均含量是对照组的2倍多(图3)。实验开始后35d内的处理组与对照组肌肉中的锶含量差异均显著(P<0.05),从图3中可以看出,实验结束后的4 d内,处理组肌肉中的锶元素平均含量基本处于稳定的状态,实验结束后第7天已经有所下降,且在实验结束后28 d内一直处于下降的趋势。实验开始后第66天,处理组和对照组的大黄鱼肌肉中锶含量差异不显著(P>0.05)。
2.3 鳃、肾脏和肝脏的锶含量
鉴于规格较小的大黄鱼幼鱼鳃、肝脏和肾脏重量均达不到ICPMS的检测限,为了确定富锶水处理的大黄鱼幼鱼的鳃、肾脏和肝脏是否含有残留的高浓度锶,本研究采集了30尾实验开始后第66天大黄鱼幼鱼的鳃、肾脏和肝脏进行元素检测,经ICPMS检测分析后,利用独立样本t检验对处理组和对照组的锶元素含量的差异性检验结果表明,处理组和对照组的大黄鱼鳃、肾脏和肝脏中锶元素的含量差异均不显著(P>0.05)。
3 讨论
小规格的苗种规模化标记一直是困扰我国增殖放流效果评价的主要难题。传统的标记方法大多适合于个体较大的鱼类,而且还面临工作量大、死亡率高、标签易脱落等缺点[13]。基于锶元素的耳石指纹标志技术作为鱼类标志放流研究领域中的新兴技术,不仅克服了传统方法上的缺点,而且是一种对苗种规格限制小、便于规模化操作、无标记操作损伤、标记终生携带的方法[14-15]。本研究通过开展富锶水体对大黄鱼鱼苗浸泡标记实验,进一步证实了富锶水体对大黄鱼增殖放流鱼苗耳石元素指纹标记效果,明确了富锶水体处理的大黄鱼鱼苗放流后在肌体中的锶残留状况,验证了该项技术对于小规格的大黄鱼鱼苗规模化标记的可行性。
3.1 富锶水对大黄鱼幼鱼耳石锶含量的影响
从图2中可以发现,大黄鱼幼鱼耳石核心处的锶含量较高,很可能是由于亲体对幼体的母体效应。在其出膜的第28天,耳石中的锶含量达到了稳定初期。因此,笔者认为大黄鱼出膜的第28天是适合进行锶元素标记的。根据研究的结果还可发现,在实验初期,大黄鱼幼鱼耳石中的锶含量不断增加,随着时间的推移达到一个峰值,最后趋于稳定。实验结束后,随着水环境中Sr2+浓度趋于正常,处理组大黄鱼幼鱼耳石中的Sr/Ca值出现下降的趋势,该趋势在实验开始后的第17天后趋于稳定。鉴于此,可以确定经富锶水体处理的大黄鱼幼鱼个体在特定的耳石区段形成的峰可作为区分放流群体和自然群体稳定的锶标记,而其适合标记的时间为出膜后的第28天至转移到网箱养殖前。
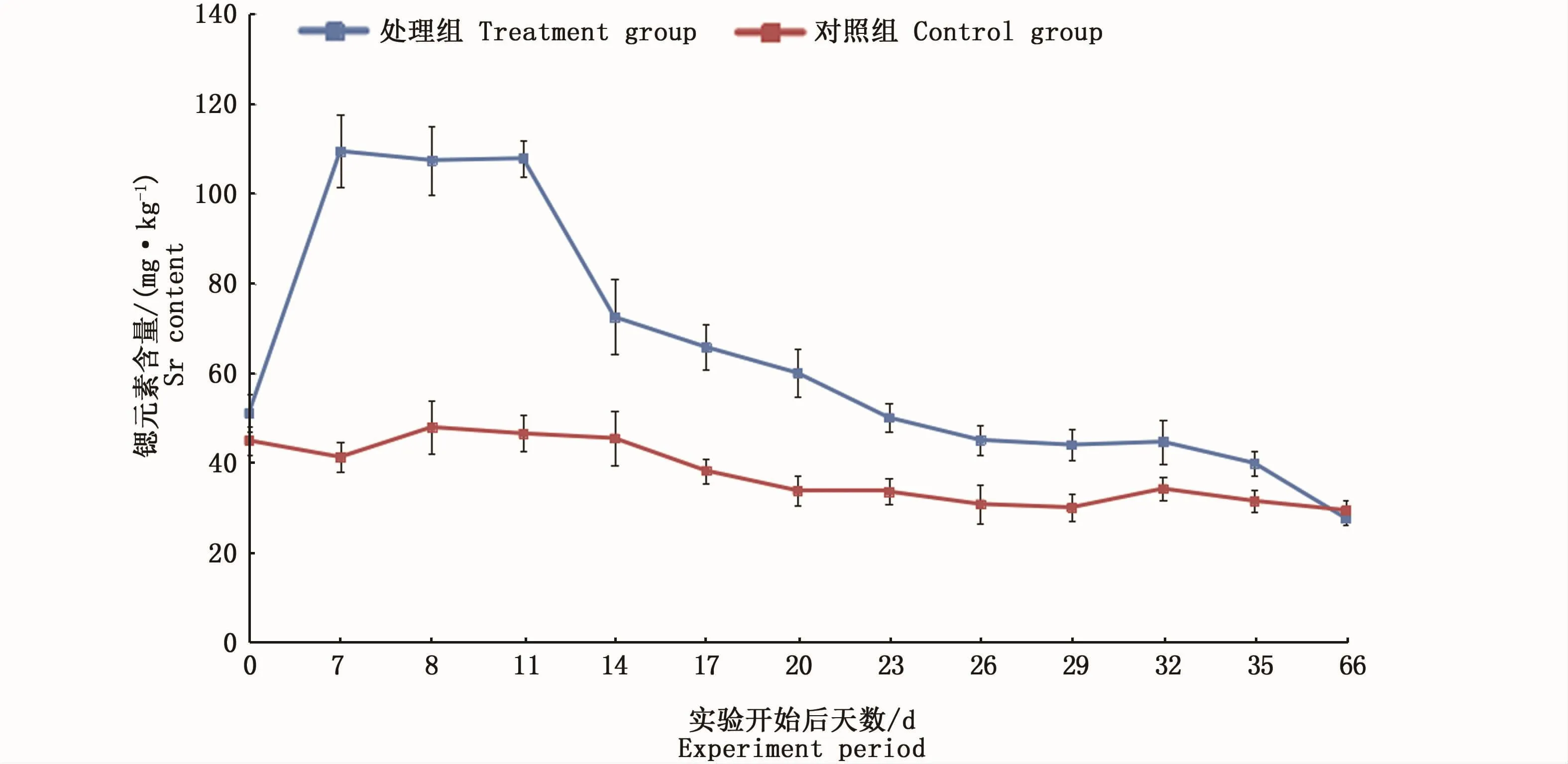
图3 大黄鱼处理组和对照组肌肉锶元素平均含量变化趋势Fig.3 Variation trend of Sr between treatment group and control group in Larimichthy scrocea
3.2 富锶水对大黄鱼幼鱼肌体锶含量的影响
锶是一种低毒的微量元素[16],标记放流的大黄鱼鱼苗在放流后随着时间的推移有一部分会被人类回捕且用于食用。现阶段,我国对于锶元素的水产品食用安全还没有一个统一的标准。蔺艳等[17-18]研究发现高锶矿泉水在锶浓度不超过8 mg·L-1时对细胞增殖有益,其中锶浓度为4 mg·L-1的效果最突出,主要以延长其增殖周期为主。美国环境保护局规定公共饮用水稳态锶上限浓度为4 mg·L-1[19]。为了避免富锶水处理的大黄鱼所带来的相关水产品安全问题,在放流前,标记个体的肌体中的锶含量应尽量与对照个体保持一致。
根据本研究结果可以发现,经过7 d的18 mg·L-1富锶水体处理,实验处理组大黄鱼幼鱼的肌肉中锶元素含量最高时达到了110mg·L-1左右。虽然锶对人体的致死量目前还不清楚,但这一浓度远远超过了正常人体锶的摄入量,因此该阶段的大黄鱼作为人类的食物而言是不安全的。随着时间的推移,实验处理组中的大黄鱼幼鱼肌肉中的锶元素含量开始呈现出不断衰退的趋势。实验开始后的第66天,处理组的大黄鱼幼鱼肌肉中锶元素含量已降低至正常值。
鳃是鱼体的吸收和排泄器官,肾脏是鱼体的排泄器官,肝脏则是鱼体的解毒器官[19-20]。为了确定鱼体各器官的锶含量的变化,本研究检测了经18 mg·L-1富锶水处理的大黄鱼幼鱼鳃、肾脏和肝脏锶含量的变化。但由于实验中的大黄鱼幼鱼个体的鳃、肾脏和肝脏的重量均达不到ICPMS的检测限,因此,只是对实验开始后第66天大黄鱼幼鱼的鳃、肝脏和肾脏进行检测,通过检测,发现66d的处理组大黄鱼幼鱼鳃、肝脏和肾脏中锶含量水平均达到了正常范围。
根据浙江省大黄鱼增殖放流技术规范标准,可以发现大黄鱼苗种放流的规格为平均体长不小于5cm[21]。从本研究的图1可以发现,实验开始后的第66天大黄鱼幼鱼的体长为5 cm左右,达到了大黄鱼放流的标准。鉴于上述,可以提议,在增殖放流效果标记的过程中,可以把经富锶水处理的大黄鱼进行暂养,待其肌体中的锶元素恢复正常水平后再进行放流,确保消除富锶水体处理过程中产生的锶元素超标而引起的食品安全隐患。
