微小亚历山大藻amtk-4共附生菌群多样性及其产毒新种Z1-D的sxtA1基因进化研究
2019-07-03张若男田晓清陆亚男樊成奇张晓玲
张若男,田晓清,陆亚男,樊成奇,张 静,杨 桥,张晓玲
(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076;2.浙江海洋大学海洋科学与技术学院,浙江舟山 316022;3.中国水产科学研究院东海水产研究所,上海 200090;4.舟山出入境检验检疫局综合技术服务中心,浙江舟山 316021)
赤潮(harmful algal blooms,HABs)是全球性海洋生态灾害及重大环境问题[1],其可引发麻痹性贝类毒素(paralytic shellfish poisoning,PSP)等多种生物毒素并通过食物链传递而严重危害人体生命健康[2]。现有研究表明,部分海洋甲藻、淡水蓝藻及海洋细菌均可产生PSP,但其来源问题尚 无 定 论[3]。藻 菌 关 系 (algae-bacterial interaction)是揭示PSP产生机制的关键,而藻际(phycosphere)及藻内定植着独特的细菌群落并与藻间形成了复杂的微生态关系,藻共附生菌群多样性信息的揭示及其可培养菌株的获得是解析藻菌关系的首要前提[4]。微小亚历山大藻(Alexandrium minutum)是一种全球广布性的代表性赤潮原因藻[5],亦是产生石房蛤毒素(saxitoxin,STX)等多种PSP的主要海洋甲藻,但目前对其共附生菌群尚缺乏系统性研究[6-7]。本文通过高通量测序首次解析了产PSP微小亚历山大藻amtk-4共附生菌群的物种种类及其相对丰度,比较了不同生长时期amtk-4的可培养细菌种类及数量差异,对其中获得的产毒新种Z1-D的PSP合成基因sxtA1进行了基因进化分析,以期为后续顺利开展藻菌关系研究、阐析PSP来源奠定基础。
1 材料与方法
1.1 藻培养
微小亚历山大藻amtk-4由台湾大学周宏农教授提供,分离自中国台湾东南海域[8]。使用f/2培养基培养,光照强度:4 500~5 000 lx,光照周期:12L/12D,培养温度25℃。待藻细胞培养至对数生长期,取50 mL藻液于6 000 r·min-1离心收集藻细胞,使用50 mL PBS缓冲液(pH 7.2)洗涤细胞沉淀3次后备用[9-10]。
1.2 基因组DNA抽提及PCR扩增
使用 Stool DNA Kit试剂盒(美国OMEGA)提取样品总基因组DNA,具体操作参照试剂盒说明书进行[11]。对提取到的样品基因组DNA用质量分数为1%的琼脂糖凝胶电泳检测。PCR扩增:针对细菌16S rRNA基因V3-V4区设计含barcode特异性引物338F/806R,引物序列分别为338F:5′ACTCCTACGGGAGGCAGCAG3′,806R:5′GGACTACHVGGGTWTCTAAT3′。PCR扩增反应参照文献[9-10]进行,将所获得的PCR产物通过2%琼脂糖凝胶电泳进行检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物。
1.3 Illumina MiSeq高通量测序
将回收后的PCR产物送样至上海美吉生物,进行Illumina Miseq文库构建及高通量测序。测序数据质量控制参照文献[10]进行:根据PE读长之间相互重叠关系进行序列拼接,同时对读长质量和拼接效果进行质控分析。过滤读长尾端质量值小于20的碱基;最小重叠长度10 bp;拼接序列重叠区允许最大错配比率0.2;根据序列两端DNA条形码及引物进行样品区分;软件:FLASH及Trimmomatic。
1.4 测序数据分析
对获得的非重复序列进行操作分类学单元(operational taxonomic units,OTU)聚类分析以获得OTU代表序列,从中选取与代表序列相似度大于97%的序列产生OTU数据表。通过贝叶斯分类算法(ribosomal database project,RDP)对 OTU数据表进行分类学分析,分别在不同分类水平上进行样本群落组成统计分析[9-11]。选取 Silva、RDP、Greengene为细菌 16S比对数据库,使用Qiime平台与RDPClassifier分别作为计算软件及算法,设定0.7为置信度阈值。群落丰富度指数(community richness)采用 Chao指数和 ACE指数;群落多样性指数(community diversity)采用Shannon指数与Simpson指数。利用不同测序深度时微生物多样性指数构建测序样品的稀释曲线(rarefaction curve)[12]。
1.5 Amtk-4可培养菌株分离及分子鉴定
取1 mL各个生长周期amtk-4藻培养液,6 000 r·min-1离心收集藻细胞,细胞沉淀用无菌海水重悬,置于冰浴中通过超声波仪(Fisher Scientific 50,Thermo Fisher)60%功率超声 30 s,用无菌海水依次进行10倍梯度稀释,取100μL稀释液均匀涂布于不同选择性培养基平板上,细菌选择性分离培养基包括:2216E、ISP 4号培养基、M2甘油培养基及HV培养基,置于15~28℃培养5~10 d。待生长出细菌菌落后,挑取单菌落进行划线分离与纯化。细菌形态的透射电镜观察参考文献[9-11]进行。
将5 mL对数生长期细菌培养物按照DNA提取试剂盒说明书步骤[9]进行细菌DNA的提取。使用细菌通用引物27F及1492R,PCR扩增参照文献[9-11]进行。PCR产物进行1%琼脂糖凝胶电泳检测[10]。PCR产物送样至上海美吉进行测序,将获得的16S rRNA基因序列通过Ezbiocloud在线数据库进行细菌模式种16SrRNA基因序列同源性比对[9-10]。
1.6 菌株sxtA1基因进化分析
利用Glimmer 3.02软件对Z1-D基因组数据中的功能基因进行预测[13],获得预测基因注释信息。利用NCBI-Blast程序对目的基因序列进行同源性搜索及比对,利用MEGA7.1软件构建其系统发育树[9-11]。
1.7 PSP毒素提取及LC-MS分析
参照文献[9-11],取对数生长期发酵液1 L,6 000 r·min-1离心5 min获得细胞,获得的细胞沉淀放入-80℃冰箱冻融3次,用pH2.0的80%乙醇溶液超声提取3次,合并提取液,使用旋转蒸发仪蒸干后,用30%甲酸铵溶液和70%酸化乙腈溶解,参照文献[7]进行PSP的LC-MS分析。分析条件:色谱分析柱:TSK-Gel Amide-80,2.0 mm×250 mm,5μm粒径;流动相 A:甲酸铵缓冲溶液,B:酸化乙腈,梯度洗脱;流速:0.25 mL·min-1;柱温:30℃;进样量:20μL;质谱条件:离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测;喷雾电压:4 500 V;离子传输毛细管温度:300℃;锥孔电压:-10 V;雾化气流速:11.7 L·min-1;辅助气流速:1.7 L·min-1;碰撞气压力:1.5 m Torr。PSP标准品石房蛤毒素(STX)购自加拿大海洋生物研究所。
2 结果与分析
2.1 Amtk-4共附生菌多样性分析
微小亚历山大藻amtk-4共附生菌多样性高通量测序质控结果如表1所示。由样品多样性指数包括ACE指数、Chao指数、Shannon指数及Simpson指数数据可见,amtk-4测序样品包含丰富的共附生菌多样性。由样品稀释曲线(图1-a)及Shannon-Wiener曲线(图1-b)可见,随测序数据量的增加,曲线斜率逐渐降低并趋向平坦,表明测序数据量合理,样品测序质量较好。
高通量测序结果表明,微小亚历山大藻amtk-4共附生菌包括85个OTU,其中包括10个门、20个纲、40个目、59个科及87个属。基于OTU的系统发育进化树见图2。在门水平包括变形菌 (60.0%)、硬壁菌 (14.4%)、拟杆菌(11.1%)、浮霉状菌(4.4%)、放线菌(4.4%)、绿弯 菌 (2.2%)、芽 单 胞 菌 (1.1%)与Verrucomicrobia SHA-109(1.1%)。纲水平以 α-变形菌(35.6%)、γ-变形菌(22.2%)和芽孢杆菌(13.3%)占优势,而 β-变形菌(4.6%)、纤维粘网菌(4.4%)、放线菌(4.4%)、Flavobacteriia(3.3%)及浮霉状菌(2.2%)所占比例较低。目水平以红细菌(11.1%)、根瘤菌(8.7%)、芽孢杆菌(8.7%)、红螺菌(7.8%)及交替单胞菌(7.8%)占优势。科水平以红杆菌(10.9%)、红螺菌(7.6%)及交替单胞菌(7.6%)占优势。
其中优势属(>5%)6个,包括Phycisphaeraceae科未鉴定属(11.8%)、Muricauda属(10.3%)、腐螺旋菌科未鉴定属(9.1%)、Hyphomonadaceae科未鉴定属(8.9%)、Haliea属(5.7%)及红杆菌科未鉴定属(5.1%)(图3)。amtk-4来源共附生菌群中的未鉴定属比例高达53.4%,表明微小亚历山大藻amtk-4具有发现藻际生境微生物新种(属)的巨大潜力,非常值得对其进行进一步深入发掘研究。

表1 测序样品的多样性指数数据统计表Tab.1 Alpha-diversity data of high-throughput sequencing samples

图1 测序样品稀释曲线(a)与Shannon-Wiener曲线(b)图Fig.1 Rarefaction(a)and Shannon-Wiener curves(b)of the sample
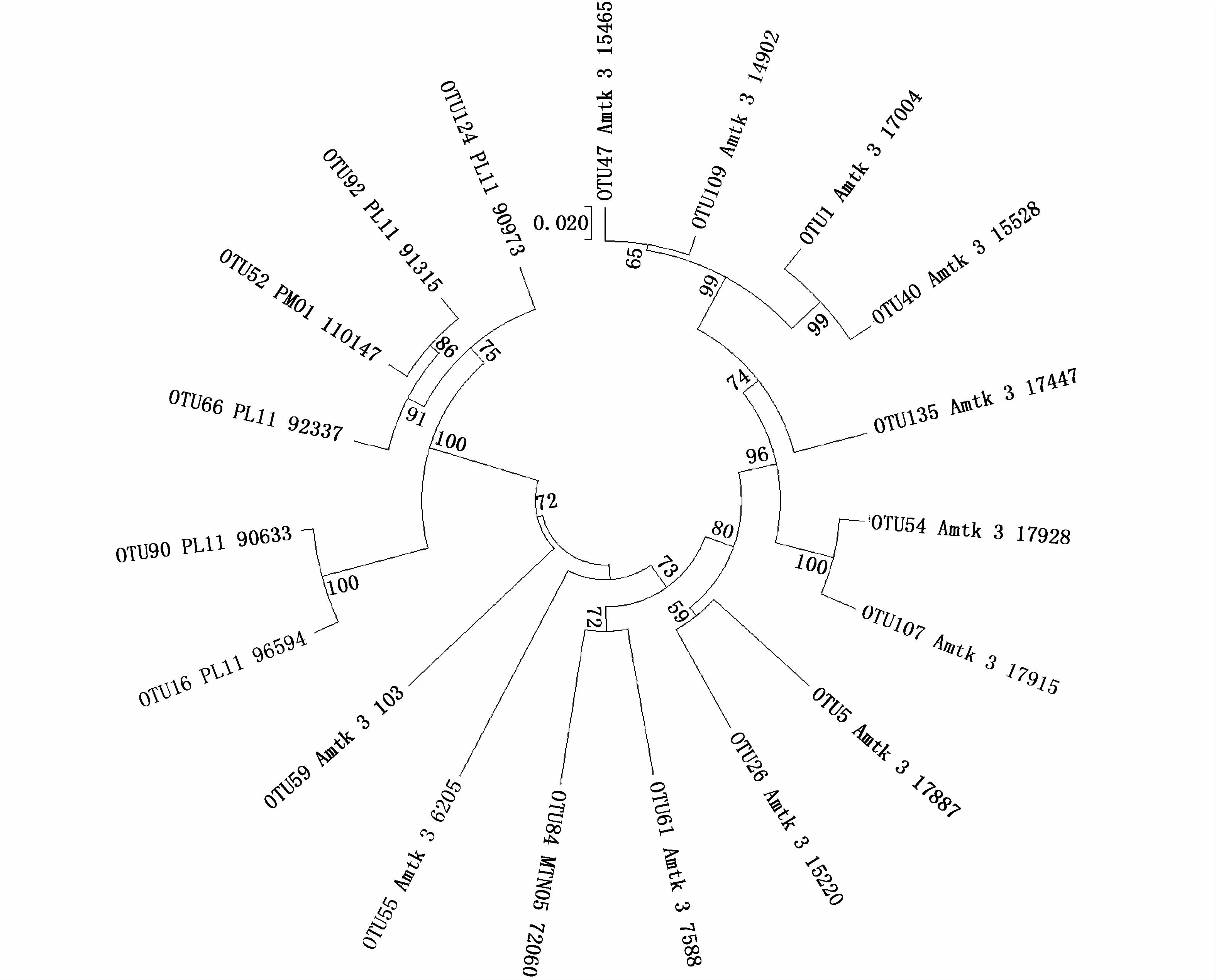
图2 基于OTU的微小亚历山大藻amtk-4共附生菌群系统发育进化树Fig.2 Phylogenetic tree of the bacterial community associated with A.minutum amtk-4 based on OTU
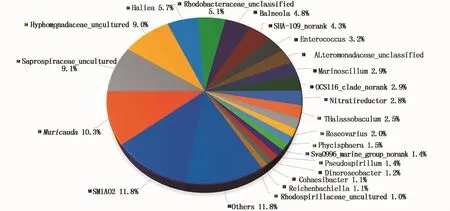
图3 微小亚历山大藻amtk-4共附生菌群多样性的属水平分布图Fig.3 Microbial distribution at genus level of the associated bacterial community of A.minutum amtk-4
2.2 amtk-4可培养菌株16S r RNA系统发育分析
从微小亚历山大藻amtk-4不同生长期所分离的细菌数量比较数据见表2。由表2可见,藻生长延缓期所获得细菌种类及数量较少;进入对数生长期后,细菌数量及种类增加;稳定期细菌种类最多;进入衰亡期后,细菌数量及种类均减少。对14株可培养细菌经排重后,发现包括5株细菌,分别为 Thalassobaculum sp.、Muricauda sp.、Mesorhizobium sp.、亚硫酸杆菌(Sulfitobacter)及Microbacterium sp.,其中菌株Z1-D及Z1-4的16S rRNA基因序列与已有模式种的同源性最高值分别为97.8%及97.3%,其16S rRNA基因邻接法(neighbor-joining)系统发育树见图4,将其分别鉴定为亚硫酸杆菌属及Mesorhizobium属新种。对Z1-D菌株的发酵代谢产物进行了LC-MS分析(图5),发现其可产生约 12.6 ng·mL-1石房蛤毒素(STX)产物。
2.3 sxtA1基因进化分析
SxtA是催化STX生物合成的关键起始基因,包括4个结构域(sxtAZ1-4,图6),其中 sxtA1为腺苷甲硫氨酸依赖性甲基转移酶(Methyltransferase,MTF)[5]。通过 GenBank Blast分析对Z1-D菌株的全基因组序列进行了比对。结果表明,该菌株基因组中含有sxtA1同源基因片段(orf-01498)并构建了其sxtA1基因系统发育进化树(图6)。表明orf-01498基因片段与水华束丝藻属(Aphanizomenon)、拟柱胞藻属(Cylindrospermopsis)等蓝藻进化距离较近。暗示sxtA1基因在微小亚历山大藻amtk-4共附生菌株Z1-D及部分蓝藻之间可能存在着共同进化[13-14]。

表2 不同生长期微小亚历山大藻amtk-4所获得细菌数量比较Tab.2 Comparison of number of bacterial strains isolated from A.minutum amtk-4 at different growth phases
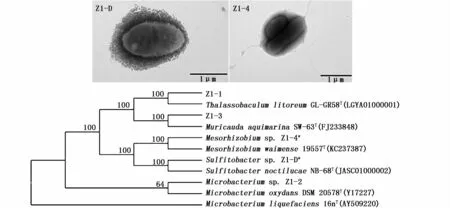
图4 微小亚历山大藻amtk-4来源可培养细菌的系统发育进化树Fig.4 Phylogenetic tree of 16S r RNA gene sequences of cultivable bacterial strains from A.minutum amtk-4

图5 细菌新种Z1-D发酵产PSP的LC-MS分析图谱Fig.5 LC-MSanalysis of PSP toxins from fermentation products of the novel species strain,Z1-D isolated from A.minutum amtk-4

图6 新种Z1-D的sxtA1基因系统发育进化树Fig.6 Phylogenetic tree of sxtA1 genes of strain Z1-D
3 讨论
微小亚历山大藻及链状亚历山大藻是亚历山大藻属两种主要产PSP赤潮甲藻。前期对东海链状亚历山大藻LZ09共附生菌多样性进行了高通量测序分析[15]。两种亚历山大藻共附生菌多样性差异比较结果显示,微小亚历山大藻amtk-4及链状亚历山大藻LZ09共附生菌群中变形菌比例均超过50%,为两种藻的共附生菌绝对优势门,其中α-变形菌纲所占比例分别为35.6%和21.4%。两种藻细菌群落多样性在科及属水平上差异较大。红杆菌(Rhodobacteraceae)、红螺菌 (Rhodospirillaceae)及 Alteromonadaceae在amtk-4中为优势科,而在LZ09中比例均低于10%。amtk-4共附生菌包括87个属,其中以Phycisphaeraceae科未鉴定属、Muricauda属、腐螺旋菌科未鉴定属、Hyphomonadaceae科未鉴定属、Haliea属及红细菌科未鉴定属为优势属。而amtk-4共附生菌包括 34个属,其中Cryomorphaceae科和Cyanobacteria科未鉴定属、糖螺菌属、红细菌科未鉴定属及Maricaulis属为优势属。两株藻共附生菌群的共有优势属为红细菌科未知属。本研究取得的数据可为后续开展amtk-4可培养共附生菌株分离策略的优化提供科学参考。
值得关注的是,微小亚历山大藻amtk-4及链状亚历山大藻LZ09中未鉴定属细菌比例均高于50%,表明这两株产PSP亚历山大藻蕴含从中发现功能未知微生物新种(属)的巨大潜力。本文从微小亚历山大藻amtk-4分离获得的2株细菌Z1-D及Z1-4经鉴定其分别为亚硫酸杆菌属(Sulfitobacter)及Mesorhizobium属新种。亚硫酸杆菌属于变形菌门红杆菌科(Rhodobacteraceae),现包括18个模式种,在海洋物质循环中扮演重要角色。其分离来源多样,包括海洋动植物如海星(Stellaster equestris)、海草(Zostera marina)、海水及有毒海洋硅藻[16],而在海洋甲藻中尚未见相关报道。Mesorhizobium属于1997年首次报道[17],为专性共生菌,通常在豆科植物根部形成固氮固结物。该属是继根瘤菌之后的第二大类植物根瘤共生菌,目前包括39个模式种,但尚未在海洋甲藻中得到报道。本文所获的新的研究结果表明,微小亚历山大藻amtk-4蕴含独特的共生菌新物种资源,非常值得对其进行进一步深入挖掘研究。
高通量测序结果揭示了微小亚历山大藻amtk-4具有丰富共附生菌物种多样性信息,但通过纯培养(culture-dependent)分离目前仅获得数株可培养细菌菌株,远未体现出其丰富物种多样性原貌。究其原因,绝大多数海洋微生物种群为活的不可培养状态(viable but none-cultivable,VBNC),而微生物可培养性 (microbial cultivability)是海洋微生物研究的一个关键瓶颈[18]。因此,若要最大限度还原海洋复杂生态体系细菌群落生态学功能原貌,必须组合利用宏基因组学、新兴单细胞基因组学(single cell genomics,SCG)等免培养(culture-independent)研究技术[19],以突破传统微生物培养方法的局限,为解析复杂海洋特殊生境微生物菌群多样性及其生态学功能提供研究新思路[20-21]。
海洋甲藻包括亚历山大藻属(Alexandrium)、裸甲藻属(Gymnodinium)及 Pyrodinium属等;淡水浮丝藻属(Planktothrix)及蓝藻(cyanobacteria)包 括 Cylindrospermopsis raciborskii、Anabaena circinalis、Aphanizomenon、Raphidiopsis brookii及Lyngbya wollei等均可产生PSP[22-24]。除上述产毒藻以外,存在于自然海水、藻际(phycosphere)及藻内细菌包括如弧菌(Vibrio)、对极鞭毛菌(Alteromonas)、毗邻单胞菌(Plesiomonas)、假单胞菌(Pseudomonas)、变形菌(Proteus)、莫拉氏菌(Moraxella)等,同样可产生 PSP[25]。甲藻、蓝藻及细菌产PSP的跨界分布(cross-kingdom)是否蕴含某种内在规律?而藻共附生菌群在PSP产生机制中究竟扮演何种角色?具有哪些潜在应用价值?这些问题的解答目前均缺乏足够研究数据积累,亟待系统发掘。藻内共生菌在长期自然选择进化过程中,与甲藻形成了复杂的生态体系,构建了复杂的化学防御系统[25-26]。藻共附生菌群与甲藻之间既存在多种代谢产物(化学防御物质、群体感应物质、营养物质、生长因子等)相互交流,亦有重要遗传物质(包括PSP合成基因)在不同物种及种属间的基因水平转移与融合[26]。本研究发现,分离自微小亚历山大藻amtk-4可产生STX细菌新种Z1-D的sxtA1基因与产毒水华束丝藻属、拟柱胞藻属等蓝藻聚类,推测其可能存在着共同进化[22-26]。
