CIN 2+患者高危型HPV感染情况及治疗方法分析
2019-07-01李建华李迎耿文荣李莉郭克
李建华,李迎,耿文荣,李莉,郭克
1滨州市妇幼保健院妇女保健科,山东 滨州256600
2滨州市滨城区区直机关医院特殊疾病门诊,山东 滨州2566000
宫颈癌是严重威胁女性生命健康的恶性肿瘤,与发达国家发病率呈下降趋势相反,中国宫颈癌发病率大幅上升[1]。宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)属于宫颈癌的癌前病变,多数低级别CIN可自然消退,少数可进展为高级别的CIN,容易发生癌变[2],而高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染是CIN患者进展为宫颈癌的独立危险因素[3]。研究表明,定期宫颈脱落细胞学检查有助于早期发现CIN或宫颈癌,患者预后良好并可能达到治愈[2-4]。目前,环形电切术(loop electrosurgical excision procedure,LEEP)是CIN和部分早期宫颈癌患者可保留生育能力的治疗手段,部分术后患者高危型HPV感染可自然转阴,但仍有部分患者存在持续感染,其复发或进展为浸润性宫颈癌的风险明显高于自然转阴和健康人群[5]。因此,本研究探讨高危型HPV持续感染的危险因素及其治疗方法,以期为LEEP术后高危型HPV持续感染的治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年9月至2016年9月滨州市妇幼保健院收治的CIN2级及以上(CIN2+)患者。纳入标准:①均接受LEEP治疗,术后病理证实为CIN2+;②手术前后均接受高危型HPV亚型检测,临床和随访资料完整;③有1年以上性生活史。排除标准:合并自身免疫性疾病或正在服用免疫抑制剂或激素。依据纳入和排除标准,本研究共纳入249例CIN2+患者,平均年龄为(36.12±7.29)岁;吸烟9例,不吸烟240例;切缘阳性33例,切缘阴性216例;性伴侣人数:1人158例,≥2人91例;避孕方式:避孕套97例,其他方式152例;人工流产次数:<3次104例,≥3次145例;CIN分级:CIN2级146例,CIN3级97例,宫颈原位癌6例。依据LEEP术后1年高危型HPV检测是否转阴分为术后转阴组(n=160)和持续感染组(n=89)。依据治疗方式将89例持续感染组患者分为对照组(n=41)和联合组(n=48)。对照组患者接受重组人干扰素α2b阴道泡腾片治疗,联合组患者在此基础上联合保妇康栓治疗。
1.2 治疗方法
249例CIN2+患者均接受了LEEP治疗,手术方法参考《宫颈癌及癌前病变规范化诊疗指南(试行)》[6]。采用UM-150A型环形电刀进行LEEP手术,患者取膀胱截石位,碘伏消毒手术区域,采用1.5%卢戈氏碘液标记病灶范围,根据病灶大小选择相应的环形电极切刀,沿宫颈着色范围5 mm外环形切割,CIN2级患者的切割深度约1.5 cm,CIN3级患者的切割深度约2.5 cm。有生育要求的宫颈原位癌患者行冷刀宫颈锥形切除术,无生育要求的宫颈原位癌患者行子宫全切术。对照组患者术后应用重组人干扰素α2b阴道泡腾片,用药前清洗外阴,于睡前将药栓置于阴道后穹窿处,每次1粒,隔日1次,9次为1个疗程,经期停药,连用3个疗程。联合组患者采用重组人干扰素α2b阴道泡腾片联合保妇康栓治疗,保妇康栓用药前清洗外阴,每次1粒,隔天1次,与重组人干扰素α2b阴道泡腾片交替使用,10次为1个疗程,连用3个疗程。
1.3 观察指标和评价标准
分别在术前,术后3、6、9、12个月,采用聚合酶链反应(polymerase chain reaction,PCR)荧光探针法检测术后转阴组和持续感染组患者高危型HPV感染情况,期间若高危型HPV转阴则停止检测,该方法可以检测13种高危型HPV亚型,包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68,多重感染指同一患者检测到两种及以上亚型的高危型HPV。收集术后转阴组和持续感染组患者年龄、吸烟情况、切缘情况、性伴侣人数、避孕方式、人工流产次数、CIN分级情况和多重高危型HPV感染情况等临床特征,探讨可能影响术后持续感染的因素。
1.4 统计学方法
采用SPSS 22.0软件对所有数据进行统计分析。非正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,组间比较采用 Wilcoxon秩和检验;计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前术后转阴组和持续感染组患者高危型HPV亚型分布情况比较
持续感染组患者术前多重感染率为24.72%(22/89),高于术后转阴组患者的21.88%(35/160),但差异无统计学意义(χ2=0.262,P>0.05)。持续感染组和术后转阴组患者高危型HPV亚型均以HPV16和HPV58为主,两组患者各高危型HPV亚型分布情况比较,差异均无统计学意义(P>0.05)。(表 1)
2.2 术后转阴组和持续感染组CIN 2+患者临床特征的比较
持续感染组和术后转阴组CIN2+患者年龄、吸烟情况和多重高危型HPV感染情况比较,差异均无统计学意义(P>0.05)。持续感染组和术后转阴组CIN2+患者切缘情况、性伴侣人数、避孕方式、人工流产次数和CIN分级情况比较,差异均有统计学意义(P<0.01)。(表2)
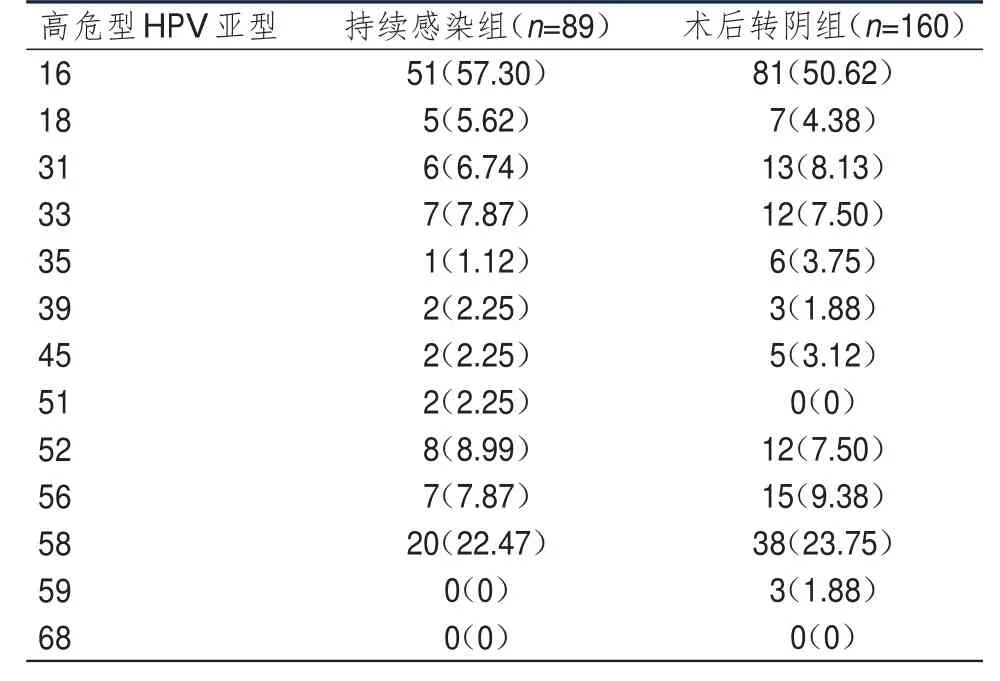
表1 治疗前术后转阴组和持续感染组患者高危型HPV亚型的分布情况[ n(%)]
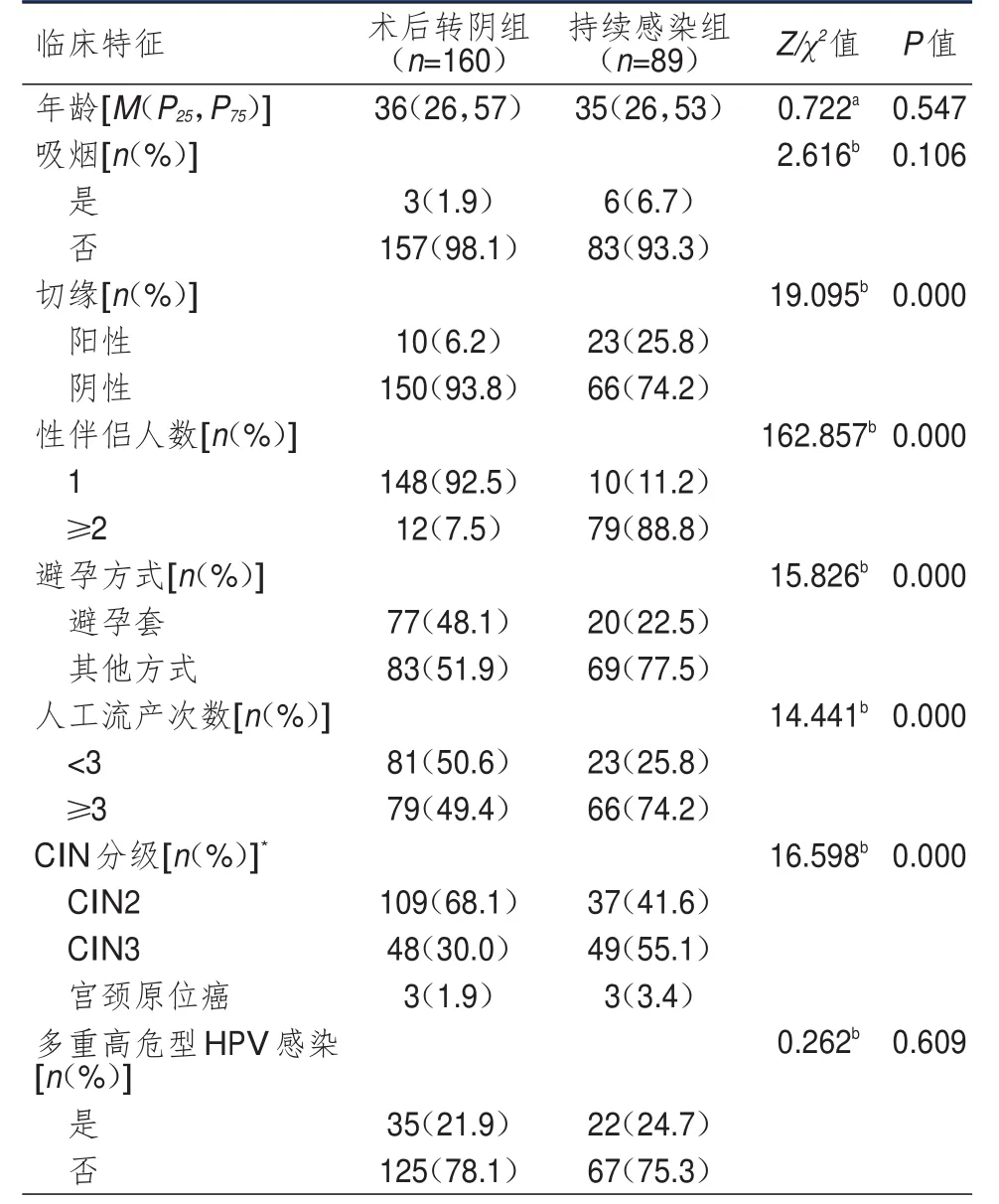
表2 术后转阴组和持续感染组CIN 2+患者临床特征的比较
2.3 对照组和联合组患者治疗后高危型HPV感染转阴情况比较
治疗后,联合组患者高危型HPV感染转阴率为79.17%(38/48),高于对照组患者的58.54%(24/41),差异有统计学意义(χ2=4.453,P<0.05)。
3 讨论
一般情况下,高危型HPV感染多为一过性,病毒经数月至1年时间,可以被正常的免疫系统清除,不会导致CIN[7]。但约20%的患者高危型HPV感染将持续存在,导致CIN的发生,进而发展为浸润性宫颈癌[8]。本研究患者经LEEP治疗后,仍有89例(35.7%)高危型HPV感染持续存在。Siebers等[9]研究发现,接受LEEP治疗后,CIN2+患者复发并进展至宫颈癌的风险比一般女性高5倍,因此,CIN和宫颈原位癌LEEP术后患者继续接受抗病毒治疗和随访仍是必要的。
HPV亚型是根据其DNA的L2区杂交及酶谱分析结果确定的,目前已知的亚型超过200种,但能够感染人类并导致疾病的有42种[10]。世界卫生组织(WHO)国际癌症研究机构根据HPV亚型致病危险性的高低,将其分为高危型、中危型和低危型,其中高危型HPV干扰主要包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68亚型[11]。不同国家、地区和种族感染的HPV亚型也不尽相同[12]。Singh等[13]研究表明,中国上海妇女感染高危型HPV的主要亚型为HPV52、16、58;秦江萍等[14]调查结果显示,中国新疆妇女感染高危型HPV主要亚型为HPV16和HPV52;Vera-Uehara等[15]研究表明,墨西哥女大学生感染高危型HPV的主要亚型为HPV16和HPV39。本研究结果显示,持续感染组和术后转阴组患者高危型HPV亚型均以HPV16和HPV58为主,表明滨州地区女性接种HPV疫苗应重点针对HPV16和HPV58型。
研究表明,高危型HPV持续感染与宫颈癌的发生发展密切相关[2-3,8-9],因此,明确高危型HPV持续感染的危险因素有助于早期预防宫颈癌[16]。本研究结果显示,持续感染组和术后转阴组CIN2+患者性伴侣人数、避孕方式、人工流产次数比较,差异均有统计学意义(P<0.01)。这可能是因为性伴侣人数较多,避孕套使用率低增加了高危型HPV感染和反复感染的机会[17],而多次人工流产会刺激或损伤宫颈,导致宫颈持续炎性反应[18]。Meng等[19]研究结果显示,宫颈持续炎性反应是高危型HPV持续感染的危险因素。因此,使用避孕套避孕、减少性伴侣数量和人工流产次数等预防宫颈炎性反应的行为有助于预防宫颈高危型HPV的持续感染。此外,本研究结果显示,持续感染组患者切缘阳性率高于术后转阴组患者,与Pirtea等[20]的研究结果一致。Amorim等[21]研究显示,阴道细菌性炎症、衣原体和单纯疱疹感染等均可累及宫颈,产生炎症和溃疡,破坏宫颈黏膜屏障,有利于高危型HPV颗粒侵入宫颈上皮基底层细胞,导致宫颈高危型HPV持续感染的发生。
保妇康栓是纯中药制剂,主要成分为莪术油和冰片,有行气破瘀、生肌止痛的功效,还具有免疫调节作用,通过提高局部白细胞计数和白细胞吞噬能力,增强患者自我清除病毒颗粒的能力[22]。本研究结果显示,联合组患者高危型HPV感染转阴率为79.17%,高于对照组患者的58.54%,表明保妇康栓联合重组人干扰素α2b阴道泡腾片可能会提高HPV持续感染患者的治疗效果。但本研究病例较少,仍需要大样本临床研究进行证实。
综上所述,应加强对有不健康性行为史、宫颈锥切术切缘阳性、高级别CIN患者的术后随访,预防高危型HPV的持续感染,发现持续感染应及时行抗病毒治疗。保妇康栓联合重组人干扰素α2b阴道泡腾片可能使接受LEEP手术的CIN2+合并HPV持续感染的患者获益。
