SERCA2表达对哮喘大鼠气道平滑肌细胞分泌IL-8的影响
2019-06-24俞珍惜沈剑黄先玫李小莉刘占利蒋春明
俞珍惜 沈剑 黄先玫 李小莉 刘占利 蒋春明
气道平滑肌细胞(ASMCs)在哮喘的病理生理过程中发挥着重要作用,其生理功能受到细胞内Ca2+浓度([Ca2+] i)的影响,[Ca2+] i的变化与哮喘气道高反应性(AHR)有关[1]。肌浆/内质网 Ca2+-ATP 酶(SERCA)介导的肌浆网(SR)钙摄取储存是调控[Ca2+] i稳定的重要机制,SERCA活性下降所导致的SR钙摄取储存功能受损可能显著影响钙依赖的平滑肌功能[2]。哺乳动物3个SERCA家族成员中的SERCA2在平滑肌中高度表达[3]。IL-8作为CXC趋化因子家族的一员,可趋化中性粒细胞、单核细胞及嗜酸性粒细胞向炎症、损伤及感染部位迁移,引发呼吸爆发,超氧负离子和过氧化氢释放。Digiovine等[4]证实在移植后闭塞性细支气管炎患者中,ASMCs是IL-8的最重要来源。但目前导致ASMCs分泌IL-8异常的机制仍未探明。
Pang等[5]发现缓激肽(BK)以浓度和时间依赖的方式增强ASMCs的IL-8释放,由于BK是SERCA2的抑制剂,本实验假设哮喘ASMCs中IL-8分泌亢进可能与SERCA2表达减少有关,通过从正常大鼠和经卵清蛋白(OVA)诱导的哮喘大鼠分离原代ASMCs,检测SERCA2表达、[Ca2+] i和IL-8水平,并利用siRNA技术下调SERCA2,探讨哮喘ASMCs中SERCA2表达与IL-8分泌的关系,旨在为研究哮喘ASMCs的细胞炎症机制提供一定的实验依据,现报道如下。
1 材料和方法
1.1 实验动物及材料 SPF级SD雄性大鼠30只,体重120~160g,6~8周龄,由上海斯莱克实验动物中心提供。主要材料试剂如下:OVA、BK、吡咯烷二硫氨基甲酸(PDTC)及毒胡萝卜素(TSG)均购于美国Sigma公司,D-MEM培养基、牛血清蛋白(BSA)、RIPA缓冲液均购于美国Thermo公司,胎牛血清(PBS)购于美国Invitrogen公司,抗α-平滑肌肌动蛋白(α-actin)单克隆抗体购于美国DakoCytomation公司,Dharma FECT2 siRNA转染试剂盒、SERCA2 siRNAs及错义序列siRNA均购于美国Dharmacon公司,RNeasy mini试剂盒购于德国Qiagen公司,GoScriptTM逆转录系统购于美国Promega公司,SYBR®Premix Ex TaqTM购于日本TaKaRa公司,PVDF膜及核蛋白提取试剂盒购于美国Millpore公司,Fura PE-3/AM购于美国Santa cruz公司,ECL试剂盒购于英国Amersham公司,大鼠重组IL-17购于美国R&D公司,IL-8 ELISA试剂盒购于比利时Biosource SA公司,单抗 SERCA2(ab137020)及单抗 GAPDH(ab181603)购于英国 Abcam公司,单抗IP3R1(NBP1-95155)购于美国Novus公司,BCA蛋白定量试剂盒及HRP-偶联二抗购于上海碧云天生物科技有限公司,单抗IκBα(9242)、单抗 NF-κB p65(4764)及单抗 β-actin(4970)均购于美国Cell Signaling Technology公司,SERCA2、三磷酸肌醇受体(IP3R1)、IL-8和 β-actin引物自行设计后由上海生工公司合成。
1.2 方法
1.2.1 大鼠哮喘模型构建及处理 按照随机数字表法将30只大鼠分成哮喘1组、哮喘2组和正常组,每组10只。哮喘模型制作参照文献[6] 略作调整,哮喘1组和哮喘2组:第1天和第8天将1ml含1mg OVA和100mg氢氧化铝混合液进行腹腔注射致敏,在第17~21天分别用1%和2%OVA盐水经空气压缩雾化器每日雾化吸入30min。正常组:用生理盐水进行相同的处理。所有大鼠在第23天处死。
1.2.2 原代大鼠ASMCs分离和培养 取出气管组织放入预冷无菌磷酸缓冲液PBS中,去除内外膜及软骨,剩余平滑肌组织置入37℃含2mg/ml BSA、2mg/mlⅠ型胶原酶和20U/mlⅣ型弹力蛋白酶的缓冲液中消化1h。将得到的细胞混悬液离心,去除碎片,并在含L-谷氨酰胺(2mM)、青霉素(100U/ml)、链霉素(100μg/ml)、两性霉素 B(1.25μg/ml)和 10%FBS的 D-MEM 培养基中再混悬,置于37℃、5%CO2孵箱培养。本实验所用的原代细胞经抗α-actin染色鉴定显示>95%。
1.2.4 qRT-PCR测定mRNA表达 利用RNeasy迷你试剂盒从约1×106个细胞裂解液中提取总RNA,采用GoScriptTM逆转录系统获得cDNA,然后根据SYBR®Premix Ex TaqTM试剂盒说明进行PCR定量检测,使用引物序列如下:SERCA2,上游:5′-CCC TGT ACA GTT TGC TTA-3′,下游:5′-GCT GTG AGG AAC TGA ACC-3′;IP3R1,上游:5′-AGC CAT GTT AGA GGC TCA CAC GTT-3′,下游:5′-CCT GGG AGA TGA CAC TGA CTG GT-3′;IL-8,上游:5′-GAG CAA CCC ATA CCC ATC GA-3′,下游:5′-TGG TCC CAC CAT ATC TTC TTA ATC T-3′;β-actin,上游:5′-TGG CCT CAC TGT CCA CCT TCC A-3′,下游:5′-CGC AGC TCA GTA ACA GTC CGC C-3′。β-actin作为内参,反应条件:95℃预变性15min,94℃变性 15s,56℃退火 20s,72℃延伸 20s,共 45个循环。反应系统按照厂商建议构建,利用2-ΔΔCt法计算相对基因表达量。每组实验重复3次。
1.2.5 Western blotting测定蛋白含量 将细胞裂解于含蛋白酶和磷酸酶抑制剂的RIPA缓冲液,再利用核蛋白提取试剂盒收集总蛋白,利用BCA蛋白定量试剂盒对获得的总蛋白浓度检测后进行电泳并将其转至PVDF膜上,用含5%脱脂乳Tris缓冲液进行封闭1h,分别加入兔抗 SERCA2、IP3R1、IκBα、NF-κB p65、β-actin(浓度 1∶1 000)或 GAPDH(浓度 1∶10 000),4℃过夜,再加入 HRP-偶联二抗(浓度 1∶3 000),室温孵育 1h,利用ECL试剂盒显现印记,蛋白带光密度由Image J软件进行定量。
1.2.6 Fura PE-3/AM测定[Ca2+] i 用1μM BK刺激ASMCs诱导SR钙释放,参照文献[8] ,将盖玻片上的ASMCs(约1×103/片)在加有0.5μM钙离子荧光指示剂Fura PE-3/AM的Hepes缓冲生理盐水中避光室温孵育90min,置于倒置显微镜下选好测定的细胞,以510nm为发射波长,以340 nm和380 nm为激发波长进行测定,负载Fura PE-3/AM细胞的荧光比值(R340/380)用于表示[Ca2+] i。
1.2.7 ELISA法测定IL-8水平 从正常或哮喘大鼠分离得到的ASMCs,经SERCA2 siRNA或错义序列siRNA转染,通过Western blotting确定SERCA2是否被下调后,置于含或不含10μM PDTC、含或不含0.1ng/ml重组大鼠IL-17的37℃、5%CO2孵箱培养[9],24h后收集上清液,利用ELISA试剂盒检测IL-8水平。
1.3 统计学处理 采用GraphPad统计软件,计量资料以表示,组间两两比较采用Student’st检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组SERCA2和IP3R1表达的比较 见表1。
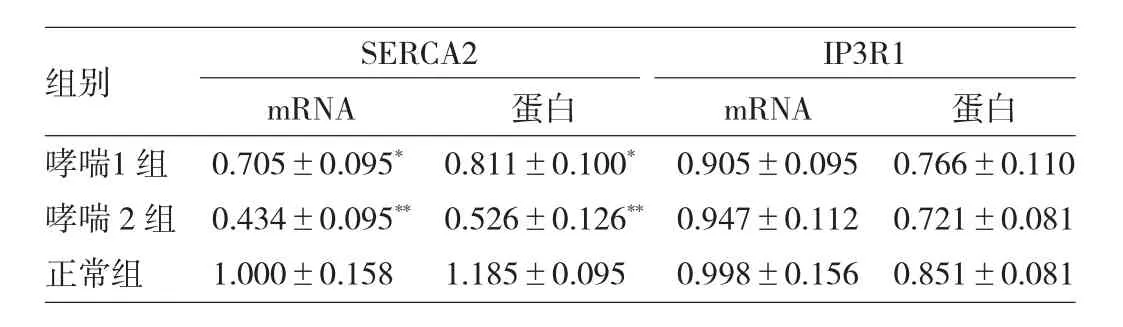
表1 各组SERCA2和IP3R1表达的比较
由表1可见,与正常组相比,哮喘组SERCA2 mRNA及蛋白表达均减少(P<0.05或0.01),哮喘2组减少则更显著(均P<0.01),而哮喘组IP3R1 mRNA及蛋白的表达与正常组比较,差异均无统计学意义(均P>0.05)。
2.2 各组[Ca2+] i的比较 见图1。
20世纪80年代,全球化进程进一步加快,世界各国间的交流日益频繁,许多翻译学者逐渐摆脱翻译研究的局限性,开始对翻译进行多角度宏观研究,大大拓展了翻译研究的内涵和外延意义。操控理论便是在此背景下形成和发展起来的。
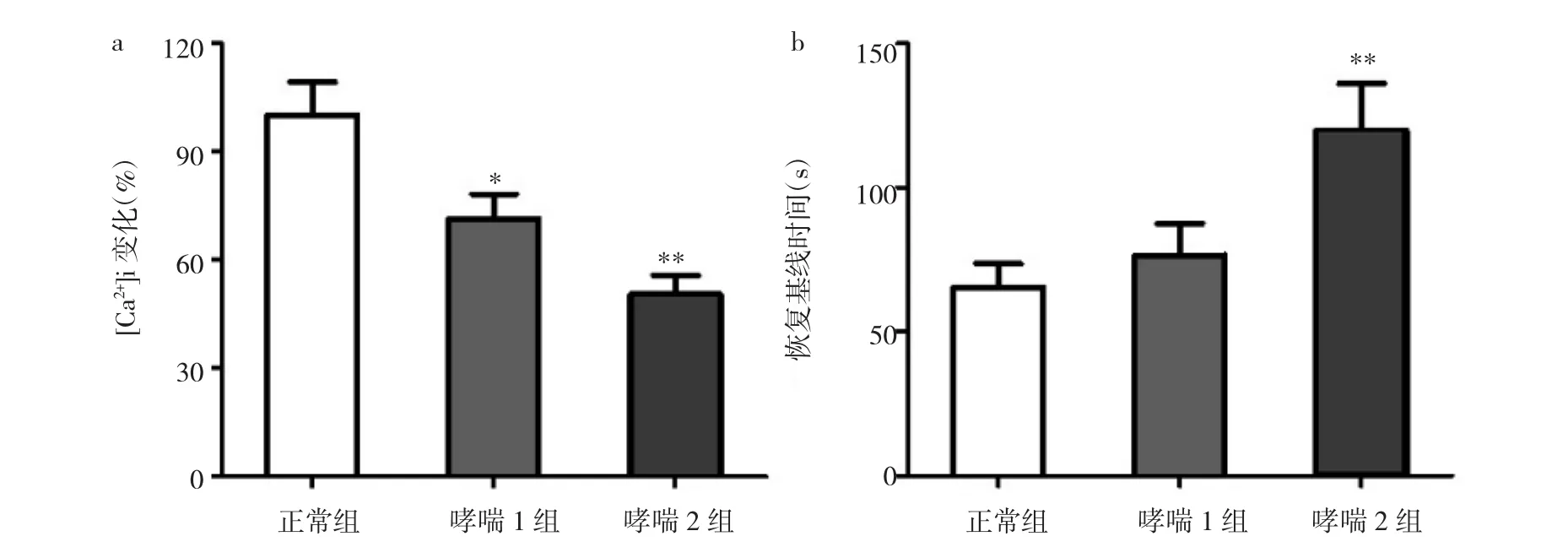
图1 各组[Ca2+] i的比较(a:经BK诱导后的钙瞬变峰值水平;b:钙峰恢复至基线所需时间;与正常组比较,*P<0.05,**P<0.01)
由图1可见,与正常组比较,哮喘组对BK诱导的钙瞬变峰值下降(P<0.05或0.01);哮喘2组需要更长时间重新摄取钙使[Ca2+] i恢复至基线水平(P<0.01)。
2.3 各组IL-8 mRNA表达和分泌的比较 见表2。
由表2可见,哮喘组IL-8 mRNA基础值和经IL-17刺激后的诱导值均较正常组增加(P<0.05或0.01),IL-8的分泌显著增加(均P<0.01)。

表2 各组IL-8 mRNA表达和分泌的比较
2.4 经siRNA转染后各组IL-8 mRNA表达和分泌的比较 见图2、表3。

图2 明确基因下调组中SERCA2基因被下调(与阴性对照组及正常对照组比较,**P<0.01)

表3 经siRNA转染后各组IL-8 mRNA表达和分泌的比较
由图2、表3可见,在明确SERCA2基因被下调后,无论有无IL-17刺激,基因下调组IL-8 mRNA表达和分泌均显著增加(均P<0.01),而与哮喘对照组比较,差异均无统计学意义(均P>0.05)。
2.5 各组NF-κB的活化及改变 见图3。
由图3可见,哮喘组IκBα磷酸化和NF-κB p65核转位较正常组均增加(P<0.05或0.01),基因下调组和TSG抑制组的NF-κB p65核转位亦增加(P<0.05或0.01)。
2.6 经PDTC处理后各组IL-8 mRNA表达和分泌的比较 见表4。
由表4可见,基因下调组、哮喘对照组和正常对照组在IL-17刺激下,经PDTC处理后,IL-8 mRNA表达和分泌均减少(P<0.05或0.01)。

图3 各组NF-κB的活化及改变(a:各组NF-κB的活化,包括IκBα磷酸化和NF-κB p65核转位;b:基因下调组和TSG抑制组NF-κB p65核转位的改变;与正常组及阴性对照组相比,*P<0.05,**P<0.01)
3 讨论
ASMCs的生物活性是通过[Ca2+] i变化来完成的[10]。[Ca2+] i升高导致细胞膜Ca2+通道和钠/钙交换(NCX)的活化,促进钙内流,进而引发IP3R或兰尼受体(RyR)介导的SR进一步释放储存钙,细胞内钙信号的终止主要通过NCX和细胞膜Ca2+-ATP酶(PMCA)使细胞外钙浓度下降,以及SERCA快速摄取钙至SR储存使[Ca2+] i恢复正常来调控[11]。Mahn等[8]研究发现,哮喘患者ASMCs的SERCA2表达减少,经BK诱导后的[Ca2+] i峰值较正常人减弱,并且在恢复基线水平能力被延迟了大约50%,由于内钙稳态恢复能力下降引起的[Ca2+] i持续增高,导致细胞增殖和分泌功能增强,而通过siRNA技术下调正常人群来源的ASMCs中SERCA2基因表达,可呈现类似哮喘ASMCs的扩展、增殖和eotaxin-1释放增强,因而认为在哮喘患者ASMCs中SERCA2表达缺陷可导致细胞高分泌和高增殖表型,ASMCs钙调控异常可能在气道重塑中有重要作用。本实验发现,哮喘组SERCA2的转录和翻译均减少,且与病情严重程度相关。基于IP3R为SR上的一种钙释放通道,正常组和哮喘组IP3R1的表达并无差异,提示哮喘大鼠SERCA2的异常改变并不是因为在总SR数量上的减少[8]。另外,哮喘组对BK诱导的钙瞬变峰值下降,钙峰恢复至基线水平所需的时间亦更长,提示哮喘大鼠ASMCs中SR的钙储存及再摄取功能受损,SERCA2在哮喘大鼠ASMCs钙稳态失衡中发挥着重要的作用。
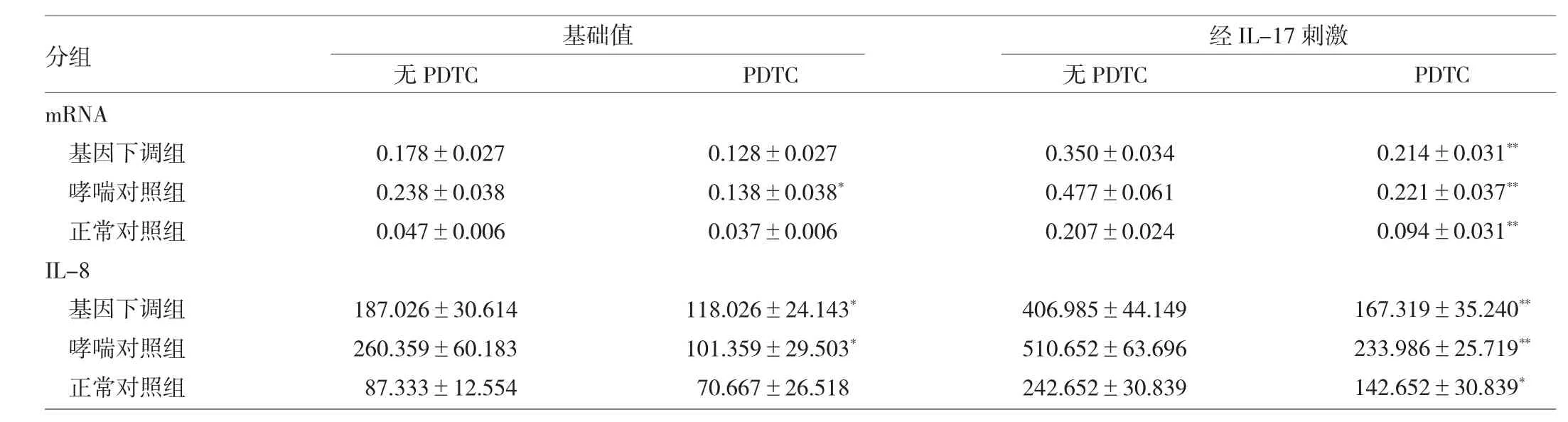
表4 经PDTC处理后各组IL-8 mRNA表达和分泌的比较
哮喘的发生、发展由庞大的细胞因子群参与,其中IL-8是目前已知活性最强的中性粒细胞趋化因子。Hosoki等[12]在对BALF中48种细胞因子的分析中发现,中性粒细胞和IL-8是唯一能区分控制性哮喘和未控制性哮喘的炎性成分。IL-8可能通过特定的CXC受体激活ASMCs引起其收缩和迁移,导致气道过度狭窄和重塑[13]。本实验发现,哮喘组IL-8的基础值及经IL-17刺激后的诱导值均较正常组增加,而基因下调组IL-8的mRNA表达和分泌亦显著增加,类似哮喘组中IL-8的变化,因此认为哮喘大鼠ASMCs中SERCA2表达的减少可导致IL-8分泌亢进。
细胞内Ca2+作为重要的第二信使具有一种特殊的运动形式,即钙振荡,是Ca2+在细胞膜两侧和细胞器膜两侧的运转共同形成的[14]。吸入β受体激动剂即是通过降低ASMCs钙振荡波幅来缓解平滑肌的痉挛[15]。既往研究表明细胞内钙调节与NF-κB活化和炎症信号反应有关[16]。NF-κB作为一种核转录因子,广泛参与免疫应答及炎症反应,致敏原、臭氧、病毒感染等哮喘诱发因素均可刺激NF-κB活化,且糖皮质激素作为哮喘主要控制药物则是NF-κB活化的有效阻滞剂[17]。哮喘患者气道中NF-κB活化明显高于正常,在抑制细胞的NF-κB活化后,气道炎症明显减轻,相关炎性因子表达亦下调[18]。镍离子作为一种广谱Ca2+通道阻滞剂可减少Ca2+内流,能消除人ASMCs中CD-40诱导的NF-κB活化[19]。本实验发现,哮喘组NF-κB活化较正常组增加,正常ASMCs经SERCA2基因下调或者利用TSG抑制SERCA2功能后均可促进NF-κB活化,提示ASMCs中SERCA2表达或功能不足时可影响NF-κB的活化。在应用NF-κB活化的特异性抑制剂PDTC后[20],无论SERCA2表达或功能是否受损,IL-17刺激诱导后IL-8 mRNA表达和分泌均减少,因此推测在哮喘大鼠ASMCs中因SERCA2表达的减少导致了钙振荡的改变,使NF-κB活化增强,经IL-17介导使得IL-8的产生增加。综上所述,哮喘大鼠ASMCs中SERCA2的不足,可导致钙稳态的改变,可能通过增强的NF-κB活性介导IL-8分泌亢进,进而加重哮喘气道炎症及重塑,SERCA2也许可能作为一个哮喘防治的新靶点。
