siRNA沉默CD44表达对人胆囊癌细胞增殖、侵袭和迁移的影响
2019-06-24蔡炜龙余胜汪伟民许洪宝楼能
蔡炜龙 余胜 汪伟民 许洪宝 楼能
胆囊癌是胆道系统最常见的恶性肿瘤,其恶性程度高,5年生存率低于5%[1]。由于胆囊癌早期症状并不显著,易被忽略,且胆囊癌的进展较快,易发生远处转移,发现时多处于晚期,失去治疗的机会[2-3]。CD44是一种透明质酸受体,参与细胞黏附、淋巴细胞迁移、归巢等过程[4]。近年来越来越多的研究开始关注CD44的功能,研究发现CD44在前列腺癌、三阴性乳腺癌、胰腺癌等多种恶性肿瘤中异常高表达,并且CD44的异常表达与恶性肿瘤的预后相关[5-8]。而CD44在胆囊癌中的表达及其作用研究报道较少。本研究拟通过观察CD44对人胆囊癌细胞株EH-GB1和GBC-SD增殖、侵袭和迁移的影响,探讨CD44对胆囊癌细胞的作用,为防治胆囊癌寻找可能有效的治疗靶标。
1 材料和方法
1.1 细胞培养 人胆囊癌细胞株EH-GB1和GBC-SD由中国科学院上海生命研究院细胞资源中心提供。用10%DMEM培养基并加入1%的链霉素和青霉素,置于5%CO2培养箱、37°C 培养。
1.2 试剂与耗材 CD44抗体、兔二抗购自美国CST公司,培养基购自美国Gibico公司,CCK8试剂盒、结晶紫、BCA试剂盒等购自上海碧云天生物科技有限公司,siCD44购自上海拓然生物科技有限公司。
1.3 方法
1.3.1 分组和转染siRNA 分别将EH-GB1和GBCSD细胞分为阴性对照组(si-NC组)和siRNA干扰技术沉默CD44实验组(si-CD44组),si-NC组转染si-NC,si-CD44组转染si-CD44。分别将GBC-SD和EH-GB1铺于6孔板内,24h后,根据说明书,用Lipofectamine 2000转染胆囊癌细胞,每6孔板内转染50nmol siRNA,转染6h后,更换培养基继续培养。待48h后收集胆囊癌细胞进行后续实验。
1.3.2 CCK8细胞生长实验 将转染后的细胞常规消化、离心、重悬后计数,将细胞接种于96孔板内,每孔细胞数1 000个,每组处理细胞设置4个复孔,放于细胞培养箱内孵育。分别于6h、第1、2、3、4、5天加入10%CCK8,37°C避光孵育2h后,用酶标仪检测450nm时的吸光度(OD)值。以上实验重复3次。
1.3.3 Transwell侵袭、迁移实验 Transwell小室实验分为迁移小室实验和侵袭小室实验,前者无基质胶而后者有基质胶。实验前将Transwell侵袭小室置于24孔培养基内水化。将转染后的细胞常规消化、离心,用无血清DMEM培养基重悬后计数。在Transwell小室上室内加入 200μl(2万个细胞)培养基,下室加入 500μl 10%DMEM,孵育24h。取出Transwell小室,吸走小室内培养基,向下室加入多聚甲醛,室温固定20min,然后加入0.1%结晶紫染色,室温染色20min,擦掉未迁移的细胞后晾干,显微镜下计数5个不同视野的细胞数。
1.3.4 Western blot实验 胆囊癌细胞经过转染si-CD44 48h后,弃上清液,用PBS清洗2次,加入RIPA细胞裂解液裂解20min,进行离心。利用BCA试剂盒检测蛋白浓度。样品加入6×蛋白上样缓冲液煮沸变性。聚丙烯酰胺凝胶电泳进行电泳,随后进行转膜。转膜结束后,用5%脱脂奶费常温封闭1h,随后在一抗4℃孵育过夜,第2天用TBST进行洗膜,孵育二抗1h。结束后,用电化学发光仪进行显影、曝光。
1.4 统计学处理 采用SPSS22.0统计软件,所有实验数据均为3次重复实验的平均值,计量资料以表示,两组比较用采用Student’t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染si-CD44后两组细胞内CD44的表达情况见图1。
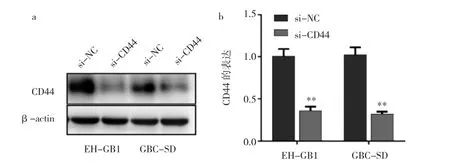
图1 转染si-CD44后两组细胞CD44表达情况比较(a:蛋白表达电泳图;b:RT-PCR结果比较,与si-NC组比较,**P<0.01)
由图1可见,与si-NC组相比,si-CD44组的条带明显变细,表明其CD44蛋白表达量明显降低,siRNA基因沉默效果好(图1a);通过RT-PCR再次验证,si-CD44组中CD44表达量明显低于si-NC组,差异有统计学意义(P<0.01),进一步表明si-CD44组基因沉默效果好(图1b)。
2.2 转染si-CD44后两组细胞增殖情况 见表1、2及图2。
由表1、2及图2可见,EH-GB1和GBC-SD细胞转染si-CD44后,CCK8增殖实验表明,与si-NC组相比,si-CD44组的增殖无明显变化,差异均无统计学意义(均P>0.05)。
2.3 转染si-CD44后两组细胞迁移情况 见图3。
由图3可见,Transwell小室细胞迁移实验显示,在人胆囊癌细胞系EH-GB1中,si-NC组的穿膜细胞数为(193.7±3.9)个,明显大于 si-CD44 组的(88.7±5.8)个(t=15.12,P<0.05);在人胆囊癌细胞系 GBC-SD 中,si-NC组的穿膜细胞数为(193.7±7.8)个,明显大于si-CD44组的(110.3±5.5)个(t=10.42,P<0.05);si-CD44 组与si-NC组相比,迁移细胞数目明显减少。
2.4 转染si-CD44后两组细胞侵袭情况 见图4。
由图4可见,Transwell小室细胞侵袭实验显示,在人胆囊癌细胞系EH-GB1中,si-NC组的穿膜细胞数为(175.3±7.5)个,明显大于 si-CD44组的(85.3±3.7)个(t=10.74,P<0.05);在人胆囊癌细胞系 GBC-SD 中,si-NC组的穿膜细胞数为(188.0±9.0)个,明显大于si-CD44 组的(73.0±3.6)个(t=11.84,P<0.05);si-CD44 组与si-NC组相比,侵袭细胞数目明显减少。
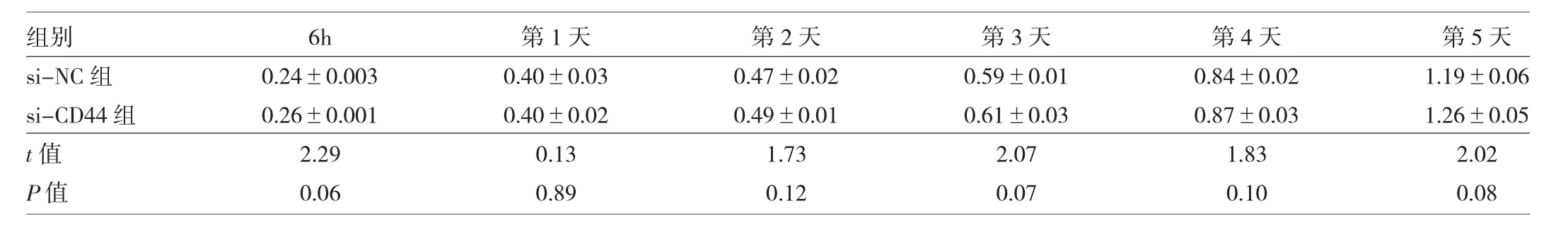
表1 EH-GB1转染si-CD44后两组细胞OD值比较
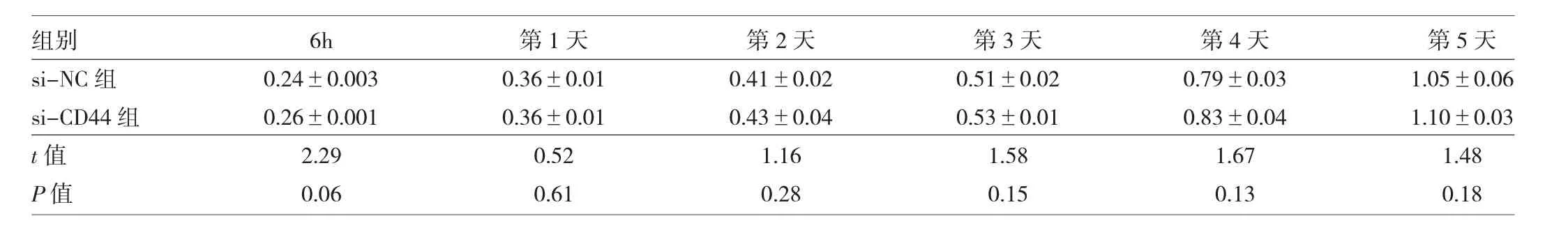
表2 GBC-SD转染si-CD44后两组细胞OD值比较

图2 CCK8增殖实验的细胞生长曲线
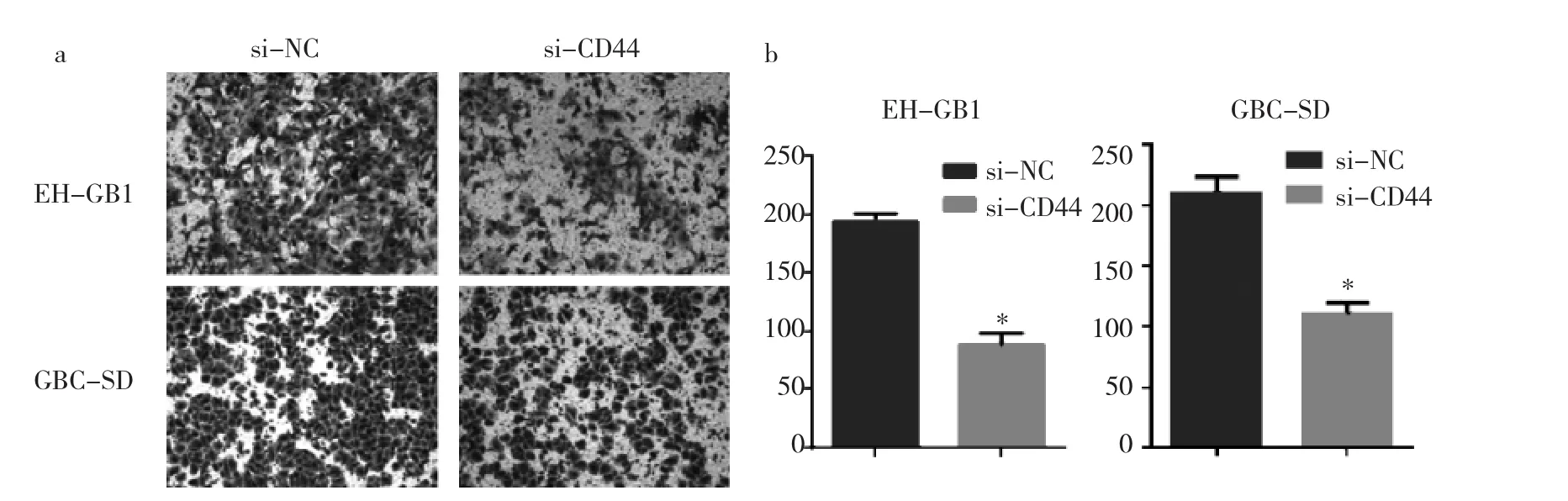
图3 转染si-CD44后EH-GB1和GBC-SD细胞迁移情况(a:两组细胞结晶紫染色示意图,×200;b:两组穿膜细胞数比较,与si-NC组比较,*P<0.05)
3 讨论
胆囊癌作为胆道系统最常见的恶性肿瘤,恶性程度较高,易侵犯周围脏器及向淋巴结等器官转移,寻找有效的标志物在胆囊癌疾病诊断和治疗中具有重要意义。CD44是一种膜整合蛋白,是跨膜透明质酸的主要受体,是一种多功能的蛋白,介导细胞与细胞间、细胞与基质间的接触和结合,参与了很多重要的生物学过程[7],其阳性表达对多种恶性肿瘤的不良结局起重要作用。Hsu等[8]发现CD44在胰腺癌组织中高表达,并与胰腺癌的不良预后相关,Wood等[9]报道CD44与胰腺癌的侵袭和转移相关。Gao等[10]利用慢病毒介导的siRNA敲低肝细胞系中CD44表达后发现上皮间质转化表型被逆转,从而使癌细胞在体外迁移及侵袭能力减弱,Yang等[11]发现伴CD44高表达的肝细胞肝癌中血管内皮生长因子(VEGF)也同时升高,并且组织中微血管密度(MVD)明显上升,与肿瘤血管生成、复发及转移有关。此外,CD44能够促进结肠癌和乳腺癌的侵袭、迁移,可能是肿瘤细胞内CD44的异常高表达通过增加其与细胞外基质配体透明质酸的亲和力,增强了肿瘤的侵袭性[12-13]。还有研究表明,siRNA介导的CD44下调可显著减弱骨肉瘤细胞的迁移、侵袭和生存能力,这可能是通过CD44与透明质酸的相互作用增加严重联合免疫缺陷(SCID)小鼠骨肉瘤肺转移的形成[14]。另有研究认为,CD44可以作为临床早期诊断结直肠癌肝转移的生物学指标[15]。CD44通过与透明质酸结合,对细胞存活、抗凋亡蛋白的活化有一定的影响,从而导致肝癌和肺癌的肿瘤细胞增殖和肿瘤发生[16-17]。此外,CD44的表达也被认为是预测骨肉瘤、卵巢癌和胃癌化疗敏感性的重要生物标志物[14,18-19]。这些结果均表明CD44作为恶性肿瘤生物靶标的可能性。
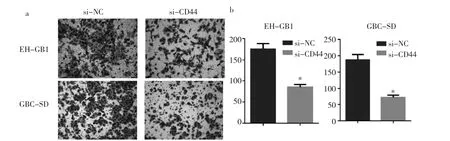
图4 转染si-CD44后EH-GB1和GBC-SD细胞侵袭情况(a:两组细胞结晶紫染色示意图,×200;b:两组穿膜细胞数比较,与si-NC组比较,*P<0.05)
人胆囊癌细胞系GBC-SD来源于低分化胆囊癌患者原位瘤组织,能反映原肿瘤细胞特性,而EH-GB1取材于胆囊癌患者的腹壁转移灶,能反映出胆囊癌的高转移活性,因此,同时以它们作为载体,可以较准确的反映胆囊癌的生物学特性。本研究中笔者运用RNA干扰技术在胆囊癌细胞中敲低CD44的表达,Western blot及RT-PCR均显示,EH-GB1和GBC-SD细胞中CD44蛋白表达量均明显降低。通过CCK8增殖实验发现,敲低CD44后对体外胆囊癌细胞EH-GB1和GBC-SD的增殖能力均无明显影响;而迁移和侵袭实验显示,si-NC组24h的穿膜细胞数明显少于si-CD44组,提示沉默CD44基因后,人胆囊癌细胞株EH-GB1和GBC-SD迁移和侵袭能力均明显受到抑制,表明CD44可能通过影响胆囊癌细胞的侵袭迁移能力从而促进胆囊癌的发生、发展,这可能由于CD44作为多功能细胞表面黏附分子,通过对胆囊癌细胞及细胞外基质的结合产生影响,而促进肿瘤细胞的侵袭、转移,但其具体机制仍待进一步研究。我们的实验结果与以往研究结果一致[20]。这些结果表明CD44可能作为胆囊癌治疗的新靶点,通过抑制CD44的表达,可能有效防止胆囊癌的侵袭及转移,为胆囊癌的治疗提供了新的思路。
综上所述,CD44在胆囊癌中表达与人胆囊癌细胞EH-GB1和GBC-SD的侵袭及迁移密切相关,沉默EH-GB1和GBC-SD中CD44的表达,可显著抑制其侵袭、转移活性,这可能会为胆囊癌的治疗提供新的分子靶点,但是CD44调控胆囊癌的侵袭迁移能力的具体机制仍待进一步探索。
