AT1-AAs和α1-AAs与血压正常人群动脉硬化进展的关系分析
2019-06-24姚涛王翠芳张琦徐露崔琴彭勃高岩李刚
姚涛 王翠芳 张琦 徐露 崔琴 彭勃 高岩 李刚
动脉硬化程度是脑卒中、急性心肌梗死、心力衰竭等心血管事件的危险因素[1-2],能够预测正常人群和慢性肾病患者心血管病死亡率及全因死亡率[3-4]。临床用于评估动脉硬化的方法有多种,颈-股动脉脉搏波传导速度(carotid-femoral pulse wave velocity,cfPWV)是用作衡量动脉硬化水平的重要指标[5-8]。除高血压、吸烟、高脂血症、糖尿病等常见心脑血管疾病危险因素能导致动脉硬化外,研究发现炎症及免疫机制在动脉硬化的进展中也具有重要的作用[9-11]。血管紧张素Ⅱ1型受体自体抗体(autoantibodies againstangiotensinⅡ type 1 receptor,AT1-AAs)和α1-肾上腺素受体自体抗体(au-toantibodies against alpha1-adrenergic receptor,α1-AAs)作为自身免疫反应的产物,能够导致血管损伤和心室重构[12-13],与高血压病发病密切相关[14]。在血压正常者中,AT1-AAs和α1-AAs能否通过相关机制致使血管重构、动脉硬化,从而导致发生高血压,目前还没有较多研究。因此,本研究对血压正常人群进行AT1-AAs和α1-AAs水平检测并进行5年时间的随访,探讨AT1-AAs和α1-AAs这两种自体抗体与动脉硬化进展的关系。
1 对象和方法
1.1 对象 根据世界卫生组织的指南,选择2010年9月至2011年3月于湖北省中医院进行健康体检者1 148例,纳入标准:(1)正常血压(收缩压<140mmHg和舒张压<90mmHg);(2)18 周岁以上。排除标准:(1)患有心力衰竭、心肌病、冠心病以及其他器质性心脏病者;(2)患脑血管病、外周动脉疾病、糖尿病者。在2010年12月至2016年4月期间,电话随访每3个月1次,门诊随访每年1次,失访332例,完成5年随访816例(71.1%),男476例,女340例,年龄(39.1±7.8)岁。
1.2 研究方法
1.2.1 一般指标收集 记录研究对象的年龄、性别、既往史、吸烟、收缩压、舒张压、身高、体重等临床资料,并计算 BMI;记录研究对象空腹 TG、TC、LDL-C、HDL-C、空腹血糖、血肌酐(Cr)等生化指标。记录随访过程中确诊高血压者高血压的发病时间(入组时至随访中确诊高血压的时间)。
1.2.2 cfPWV检测 采用澳大利亚AtCor Medical的SphygmoCor仪于上午 8:00~10:00,室温控制在 22~25℃时测量研究对象的cfPWV。受试者在检测室内安静休息 5min后取仰卧位连接心电图,将压力记录探头放置于其右颈动脉及股动脉体表采样点。使用皮尺测量颈动脉至股动脉体表采样点之间的距离,记录心电图波形校正的颈动脉及股动脉波形并计算两者之间的时间差,连续记录10次两种波形时间差并计算平均值。cfPWV(m/s)=两个采样点之间的距离间的距离(m)/两个波形时间差平均值(s)。对每位受试者重复测量3次,每次间隔5 min,取 3次的平均值为最后结果。入组时和5年后随访时各检测1次,两次cfPWV结果分别记录为基线cfPWV和随访cfPWV。定义 ΔcfPWV(m/s)=随访 cfPWV-基线 cfPWV(m/s),年平均 ΔcfPWV=ΔcfPWV/5(m/s);将研究对象基线 cfPWV≤10m/s且随访时cfPWV>12m/s定义为动脉硬化进展。
1.3 统计学处理 采用SPSS18.0统计软件,符合正态分布的计量资料以表示,多组间比较采用方差分析;计数资料以百分率表示,组间比较采用χ2检验。变量之间的相关性分析采用Pearson相关系数,将性别及单因素分析P<0.1的变量纳入多因素线性回归分析;采用Cox回归模型分析AT1-AAs和α1-AAs不同表达类型者动脉硬化进展及高血压患病风险。P<0.05为差异有统计学意义。
2 结果
2.1 AT1-AAs和α1-AAs水平检测 结果与分组根据研究对象的两种抗体水平将其分为 4 组:AT1(-)、α1(-)为 A 组;AT1(+)、α1(-)为 B 组;AT1(-)、α1(+)为 C组;AT1(+)、α1(+)为 D 组,分别为 521、132、97、66 例。
2.2 研究对象一般资料 入组的816例研究对象基线收缩压为(125.9±9.4)mmHg,舒张压(75.2±7.1)mmHg,脉压差(50.7±9.5)mmHg,平均动脉压(92.1±6.5)mmHg;基线cfPWV为(9.90±0.84)m/s,5年后随访时 cfPWV 为(10.51±1.12)m/s。年平均 cfPWV 变化值(ΔcfPWV)为(0.12±0.08)m·s-1·y-1。随访结束时,研究对象确诊高血压129例,出现动脉硬化进展144例。不同自体抗体表达类型4组基线资料比较见表1。
由表1可见,A组的年龄、BMI、心率低于其它3
1.2.3 检测AT1-AAs和α1-AAs表达 采用Zhao等[15]在研究中的使用的方法合成多肽以及检测血清AT1-AAs和α1-AAs表达。首先,使用日本岛津公司的PSSM-8型多肽自动合成仪合成具有抗原决定簇的AT1-受体和α1-受体细胞外第二环多肽片段;再将AT1-受体和α1-受体多肽片段溶解于0.1mmol/L的碳酸缓冲液中(pH=9.6),配成 100μg/ml和 50μg/ml的抗原包被液,以每100μl的量包被反应孔,4℃冰箱过夜。加1%FBS白蛋白并PBS封闭,37℃温浴2h,用PBS缓冲液洗涤3次,加入稀释血清,37℃温浴2h,PBS洗涤 3次,加入 1∶2 000辣根过氧化物酶酶标抗体(珠海海泰公司),37℃温浴 1h,再加入双氧水和 TMB温浴放置,充分显色后加入2mol/L硫酸终止反应,在酶标仪上以450nm波长测定光密度(A值)。实验中设置空白对照和阳性、阴性对照,测 A值时以空白对照凋零,以保证检测结果可靠性。以健康人群为参考血清,取A值超出对照健康人群2倍标准差的患者血清标本作为阳性对照血清。研究血清与阴性血清的吸光度之比[(标本A值-空白对照A值)/(阴性对照A值-空白对照A值)] >2.1倍者判为抗体检测阳性。个组,差异均有统计学意义(均P<0.05);而4组间性别、吸烟、空腹血糖、收缩压、舒张压、脉压差、平均动脉压、TC、TG、LDL-C、HDL-C 及 Cr比较,差异均无统计学意义(均P>0.05)。
2.3 不同自体抗体表达类型4组动脉硬化进展及高血压患病情况的比较 见表2。
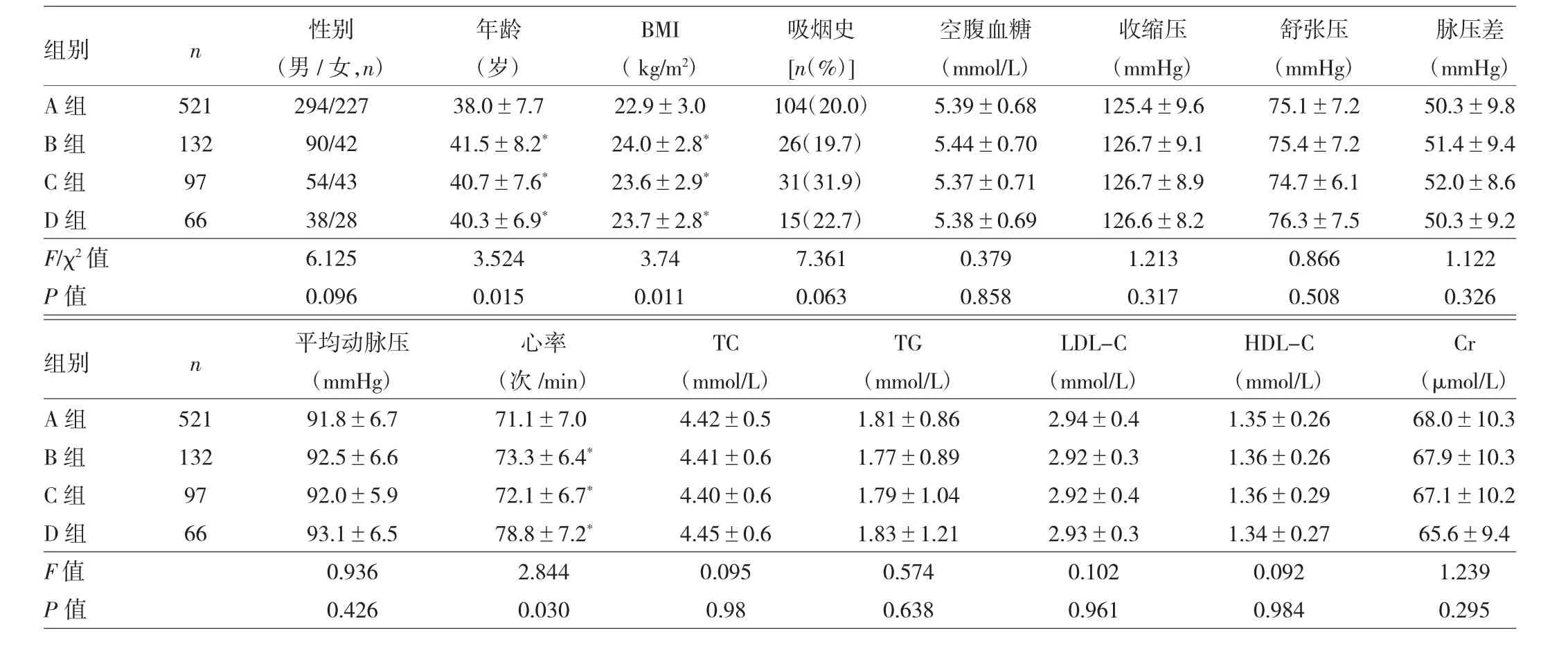
表1 不同自体抗体表达类型4组基线资料比较
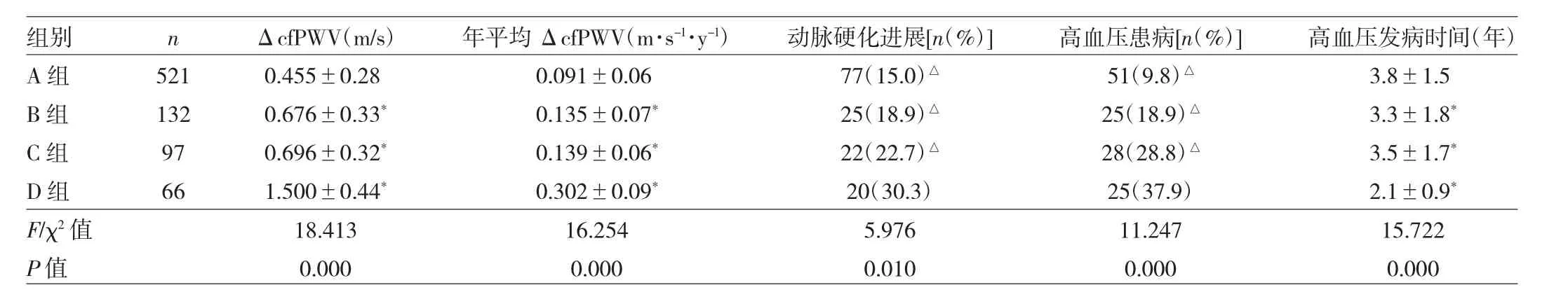
表2 不同自体抗体表达类型4组动脉硬化进展及高血压患病情况的比较
由表 2可见,B、C、D 组 ΔcfPWV、年平均 ΔcfPWV均短于A组,而高血压的发病时间小于A组,差异均有统计学意义(均P<0.05)。D组的动脉硬化进展以及高血压患病比率显著高于其它3组,差异均有统计学意义(均P<0.05)。
2.4 基线指标与动脉硬化进展的关系 分析144例出现动脉硬化进展者的基线指标,它们与动脉硬化进展的关系见表3。
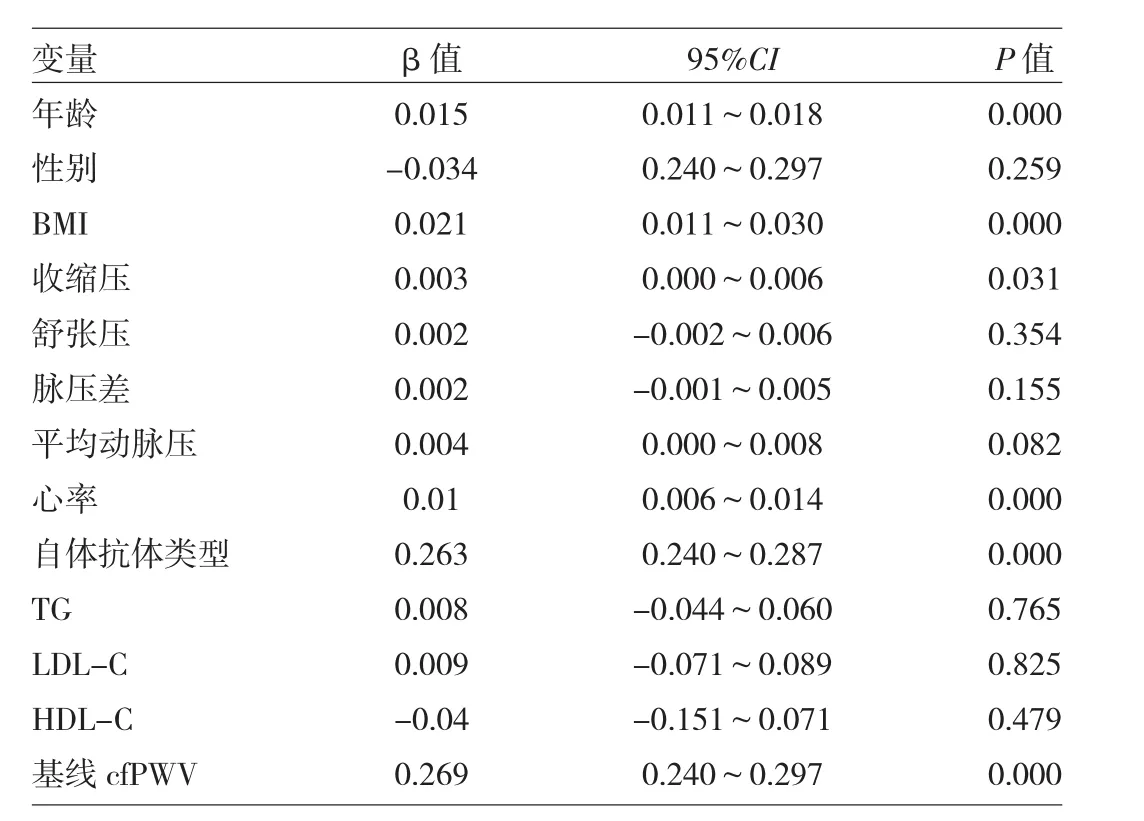
表3 基线指标与动脉硬化进展的关系
由表3可见,单因素相关分析结果显示,年龄、BMI、收缩压、心率、基线自体抗体类型以及基线cfPWV与动脉硬化进展相关(均P<0.05)。
2.5 基线自体抗体与ΔcfPWV、年平均ΔcfPWV的关系 在调整年龄、性别、BMI、收缩压、平均动脉压、心率、基线cfPWV、TC、吸烟因素后,多因素线性回归分析结果显示,基线自体抗体是影响ΔcfPWV和年平均ΔcfPWV的独立危险因素,见表4。

表4 基线自体抗体与ΔcfPWV、年平均ΔcfPWV的关系
2.6 不同自体抗体表达类型与动脉硬化进展和高血压患病的关系 见表5。
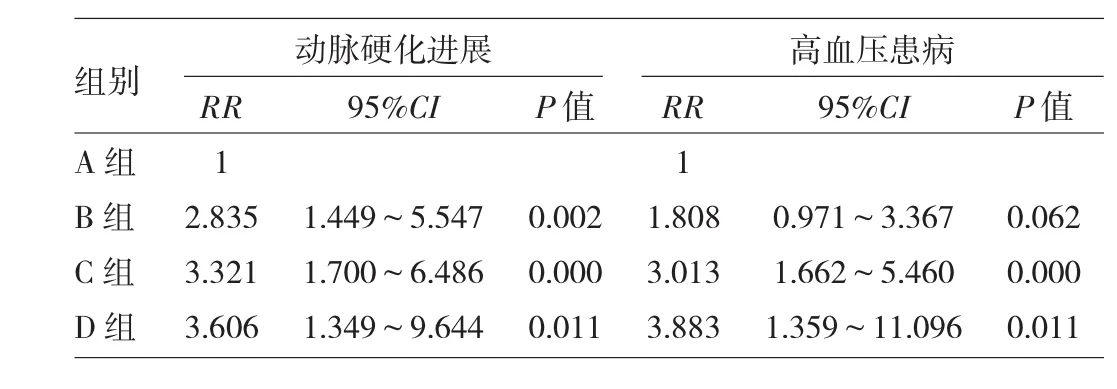
表5 不同自体抗体表达类型与动脉硬化进展和高血压患病的关系
由表5可见,在调整年龄、性别、BMI、收缩压、平均动脉压、心率和基线cfPWV因素后,Cox回归模型分析结果显示,D组动脉硬化进展和高血压患病风险明显高于A组,差异均有统计学意义(均P<0.05)。
3 讨论
本研究对816例血压正常研究对象进行平均5年的随访,研究发现AT1-AAs和α1-AAs是动脉硬化进展独立的危险因素。不同类型的抗体阳性其动脉硬化进展的程度也不相同,在调整自变量影响后,AT1-AAs和α1-AAs均为阳性者其动脉硬化的进展程度要显著的高于单一抗体阳性或两个抗体均为阳性者。AT1-AAs和α1-AAs阳性者原发性高血压的患病风险要显著的高于抗体阴性者。
国内外大量研究发现,免疫及炎症在心血管疾病发病机制中具有重要的作用。
Schiffrind 等[16]、Caillon 等[17]研究表明,免疫炎症机制参与了动脉硬化及高血压的病理进程。自1999年Wallukat等[18]首次在先兆子痫患者的血清中发现了AT1-AAs以来,该自体抗体被证实存在于高血压、动脉硬化、心力衰竭等多种心血管疾病患者的血清中,随后对AT1-AAs的心血管效应、作用机制和临床意义的研究已引起了广泛关注。2004年Wallukat等[18]研究发现该自体抗体能增加乳鼠心肌细胞的收缩能力和频率,发挥着与AngⅡ类似的激动剂效应。在我们的研究人群中,AT1-AAs阳性患者的心率较阴性患者显著增加。此外,AngⅡ可作用于血管平滑肌细胞(vascular smooth muscle cell,VSMC)的 AT1R,促进内层平滑肌细胞增殖,并迁移至血管内膜,导致血管壁增厚,管腔狭窄,从而引起血管重塑[19]。AT1-AAs在各级血管中也具有激动剂样效应。Jin等[20]采用主动免疫法建立AT1R-AA阳性大鼠模型,结果显示实验组大鼠的主动脉内膜出现不同程度的增厚,内膜VSMC排列失序,VSMC的增殖使得外周血管发生结构和功能重塑,进而导致动脉硬化的发生。Li等[21]也发现AT1-AAs通过作用于内皮细胞的AT1受体,通过炎症及免疫调节导致内皮细胞功能障碍、单核细胞集聚以及炎症增生,从而参与动脉硬化的发生、发展。大量研究的结果显示,AT1-AAs与血管内皮细胞损伤和功能障碍密切相关,我们推测这可能是AT1-AAs参与动脉硬化以及心血管疾病的机制之一。α1-AAs为IgM或IgG型免疫球蛋白,具有去甲肾上腺素样作用。Zhou等[22]研究发现α1-AAs可通过上调c-jun的表达,刺激VSMC的增殖、心肌细胞的搏动频率,导致心脏和血管重塑。Yan等[23]通过对大鼠模型8个月的观察研究,发现大鼠血管内长时间存在α1-AAs的可以导致血管内皮功能减退,通过巨噬细胞增生后逐步引起血管损伤及内皮增生。我们推测α1-AAs引起VSMC的增殖和血管内皮细胞的损伤增生,是导致动脉硬化的病理基础。本研究中,α1-AAs阳性者的心率较抗体阴性者差异无统计学意义,但动脉硬化进展和高血压的发病率则显著的增加。免疫和炎症机制也参与了高血压的发病过程[16,23],其中AT1-AAs和α1-AAs通过刺激血管收缩、调节钙离子通道以及血管炎症反应从而影响正常血压[24-25]。Lei等[26]最新的一项荟萃分析结果显示,AT1-AAs与高血压病尤其是先兆子痫密切相关,并可以用于预测先兆子痫患者的预后结局。我们首次在大规模的血压正常人群中对这两种抗体进行了检测,虽然AT1-AAs和α1-AAs抗体同时存在人群较少(8.1%),但他们的动脉硬化进展和高血压发病率均显著的高于单抗阳性或双抗体阴性人群。我们推测AT1-AAs和α1-AAs分别模拟了AngⅡ和去甲肾上腺素激动样作用,因此导致两个抗体均为阳性人群的RAAS和交感系统被同时激活,最终造成了这部分人群心率显著增加、血管重塑加剧以及心室重构,最终导致动脉硬化和高血压显著进展。
本研究结果表明,AT1-AAs和α1-AAs这两种自体抗体是血压正常人群动脉硬化进展的独立危险因素。在AT1-AAs和α1-AAs均为阳性的研究对象中,原发性高血压发病率及动脉硬化进展明显增加。这两种抗体来有可能作为动脉硬化和高血压的治疗靶点,有待进一步的研究。
