质粒介导多黏菌素耐药基因mcr的研究进展
2019-06-18刘艳华综述钟桥石胡龙华审校
刘艳华 综述,钟桥石,胡龙华 审校
(南昌大学第二附属医院检验科,江西省医学检验重点实验室,江西南昌330006)
多黏菌素(polymyxin/colistin)是属于窄谱类抗生素的聚阳离子抗菌肽,对大多数革兰阴性菌有较强较快的杀菌作用,特别是对大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌等细菌有良好的抗菌活性。多黏菌素抗菌机理是其能与革兰阴性菌细胞膜的磷脂中带负电荷的类脂A结合,造成细胞外膜通透性改变,导致细菌核酸、氨基酸等重要物质外漏,从而抑制细菌生长或导致细菌死亡[1]。近年来,随着抗菌药物的广泛使用,临床经常能分离到多重耐药甚至泛耐药的菌株。2014年,WHO发布的首份全球细菌耐药监测报告显示,2013年全球直接死于耐药菌感染的人数超过100万,并预计照此趋势到2020年全球每年将有1000万人死于多重耐药菌感染,死亡人数将超过癌症,全球学者强调了目前细菌耐药性的严重威胁,警告如不采取进一步措施,无药可用的“抗生素后时代”即将来临[2]。近十年中国CHINET监测数据研究表明,革兰阴性杆菌临床分离株多重耐药性严重,对临床常用抗菌药物耐药率上升明显,尤其值得注意的是,近几年耐碳青霉烯类肠杆菌科细菌 (Carbapenem-resistant Enterobacteriaceae,CRE)上升趋势明显,2015年CRE检出率高达8%[3]。Nordmann等研究也表明CRE检出率显著升高,且其能在临床上快速传播[4,5]。更糟糕的是,携带耐碳青霉烯类耐药基因如KPC-2和NDM-1肠杆菌科细菌的快速增加使临床治疗此类菌感染面临严峻的挑战[6,7]。对于CRE的严重感染,临床可选用的抗菌药物非常有限,面对如此严重的细菌耐药性,新抗菌药物的研发速度远远满足不了临床的需求,老药新用受到重视,多黏菌素是目前国际上推荐用于治疗多重耐药革兰阴性杆菌感染的“最后一道防线”[8-11]。
多黏菌素是20世纪六七十年代用于治疗革兰阴性杆菌所致的全身感染,但因其具有较大的肾毒性和神经毒性而弃用。面对多重耐药革兰阴性杆菌感染的广泛流行,多黏菌素作为最后选择而被重新用于临床。过往虽然人类抗感染较少使用多黏菌素,但一些国家在养殖业一直广泛使用多黏菌素以用于动物疫病的预防和治疗。随着多黏菌素广泛使用,其耐药性的报道越来越多。革兰阴性菌对多黏菌素耐药机制复杂多样,分为先天性耐药和获得性耐药,大量研究发现,质粒介导是其耐药率快速上升的重要原因。
1 质粒介导黏菌素耐药基因mcr及其各亚型的特点
2015年底我国学者[12]首次报道了从人和动物分离的大肠埃希菌中分离到质粒介导的多黏菌素耐药基因 mcr-1(mobile colistin resistance,mcr-1),随后在越来越多的CRE菌株中检出mcr基因,其极大地增加了感染患者的治疗难度,使临床治疗面临着严峻的挑战。更为值得关注的是,短时间内,不断有新的mcr基因型别被发现,且其分布菌种较广,目前多种mcr基因型别被报道(包括mcr-2[13]、mcr-3[14]、mcr-4[15]、mcr-5[16]、mcr-6[17]、mcr-7[18]、mcr-8[19])。这些耐药基因的突变率很高,每种类型又可细分为若干亚型,迄今为止,mcr-1和mcr-3被报道的亚型最多,且均达十余种亚型。这种多样性是细菌适应外界抗生素压力的结果,可能会导致多黏菌素耐药水平的增高和传播能力的增强。
1.1 mcr-1 mcr-1位于IncI2型质粒上,它是存在于质粒上的一段基因,全长1626bp,GC含量49%,该基因上游有一个编码转移酶的基因ISApl1,下游有一个hp假设蛋白。mcr-1基因产物是mcr-1蛋白,它属于磷酸乙醇胺转移酶家族,mcr-1蛋白降低了多黏菌素与细胞外膜脂多糖上类脂A的亲和力,从而导致细菌对多黏菌素不敏感。mcr-1含有5个跨膜的a螺旋并具有2个催化结构域,跨膜结构域可以将催化结构域锚定到细胞质膜的表面,完成对类脂A的共价修饰。到目前为止,已在多个国家的人类和食源动物的多种肠杆菌科细菌中检测到mcr-1基因,携带mcr-1基因的细菌可以很好地适应各种宿主,并在动物和(或)人类之间传播。mcr-1基因已在肠杆菌科的多个种属中发现,包括大肠埃希菌、产气肠杆菌、阴沟肠杆菌、阪崎肠杆菌、宋内志贺菌、布氏柠檬酸杆菌、弗氏柠檬酸杆菌、克雷伯菌属和沙门菌属等细菌,携带mcr-1基因的菌株、质粒及其侧翼序列都具有很高的多样性[20]。更为令人担扰的是,近年来,相继在世界各地发现 mcr-1.1[21]、mcr-1.2[22]、mcr-1.3[23]、mcr-1.4[24]、mcr-1.5[25]、mcr-1.6[26]、mcr-1.7[24]、mcr-1.8、mcr-1.9[27]、mcr-1.10[17]、mcr-1.11、mcr-1.12 等亚型,目前已经发现了mcr-1各亚型已达10余种 (表)。Perry等[29]研究证实质粒水平转移已成为mcr基因的主要传播途径。从表中可知,Inc X4、Inc 12、Inc H11、IncH12、Inc F、Inc P 等质粒都可携带 mcr-1及各亚型,其中 Inc X4和Inc 12质粒是最主要的传播质粒,携带mcr-1及各亚型的菌株最多的是大肠埃希菌,且大多数菌株为多重耐药细菌。
1.2 mcr-2 Xavier等[13]从猪和牛中分离获得的的耐多黏菌素大肠埃希菌中发现了一种新的质粒介导的多黏菌素耐药基因mcr-2,该基因位于IncX4质粒上,与mcr-1的核苷酸和氨基酸序列分别有76.7%和81.0%的同源性。此研究发现mcr-2表达的蛋白具有两个结构域,其中结构域1(残基1~229)是一种二级膜转运蛋白,具有将溶质转移到膜上的功能,结构域2(残基230~538)是脂寡糖磷酸乙醇胺转移酶结构域;该研究系统发育树分析发现mcr-2可能起源于莫拉菌属,因mcr-2与脂质磷酸酶基因位于质粒同一遗传元件IS1595中,该脂质磷酸酶基因与莫拉菌属的磷酸酶具有高度的同源性。该研究还发现,在比利时,从猪身上分离获得的多粘菌素耐药大肠杆菌中mcr-2的流行率远高于mcr-1,因此,当地卫生行政部门应加强耐多黏菌素革兰阴性杆菌中mcr-2筛查的分子流行病学监测。Abuoun等[17]在莫拉菌属还发现了mcr-2.1和mcr-2.2突变亚型,mcr-2.1与来自大肠埃希菌中的mcr-2具有98.5%氨基酸的同源性,仅有8个氨基酸变异;然而mcr-2.2却有65个氨基酸发生了突变,突变率较高,随后经Abuoun等研究证实,mcr-2.2(1617 bp)即为 mcr-6。
1.3 mcr-3 mcr-3最早是在我国山东省发现的,Yin等[14]在健康猪粪便分离的大肠埃希菌中发现了可移动质粒介导的耐药基因mcr-3,该基因与18个额外的耐药决定簇共存于大小为261119bp IncHI2型质粒中。mcr-3基因全长为1626bp,其与mcr-1和mcr-2的差异较大,其中核苷酸序列与mcr-1和mcr-2只有45.0%和47.0%的同源性,氨基酸序列与mcr-1和mcr-2也只有32.5%和31.7%的相似性。然而,mcr-3氨基酸序列与其他肠杆菌科细菌和10种气单胞菌属细菌的磷酸乙醇胺转移酶的同源性分别为99.8%~100%和75.6%~94.8%。mcr-3蛋白具有两个结构域,结构域1(残基1-172)含有5个跨膜β-螺旋,而结构域2(残基173-541)是包含催化中心的周质结构域。该研究发现的mcr-3与在GenBank数据库中主要在东南亚和北美发现的肠杆菌科和气单胞菌中的其他磷酸乙醇胺转移酶相似,表明移动的耐多粘菌素耐药基因mcr-3可能已经广泛传播。有研究[30]也报道发现4株来自泰国的大肠埃希菌分离株携带mcr-3基因,其中3株含为mcr-3.1基因,1株具有编码单个氨基酸变异的mcr-3.2基因。到目前为止,mcr-3是突变类型复杂(其突变亚型仅次于mcr-1,也已达十余种),涉及菌种较多,传播范围较广的黏菌素耐药基因。
1.4 mcr-4 Alessandra等[15]首次在意大利猪的盲肠内容物中分离的一种耐多黏菌素鼠伤寒沙门菌R3445中发现了mcr-4基因,该基因位于8749bp的ColE10质粒 (命名为pMCR)上,pMCR编码RepB复制酶、MobA/L动员蛋白和毒素RelE,并与泛菌属细菌pPSP_ee2质粒显示99%的核苷酸同源性。在pMCR中,IS5元件侧翼区域(即mcr-4蛋白)与希瓦菌属中包含的磷酸乙醇胺转移酶有82.0%~99.0%的氨基酸序列同源性,并且分别与mcr-1,mcr-2和mcr-3具有34.0%,35.0%和49.0%氨基酸序列同源性。此研究中的11个mcr-4阳性菌株ColE10复制酶呈阳性,对多黏菌素显示MIC≥4mg/L。质粒ColE是具有广泛宿主范围的质粒,可在不同菌种之间播散。因此,在欧洲,对来自人类和食用动物的沙门菌和大肠埃希菌,需要立即实施包括新基因mcr-4在内的mcr基因筛选。之后,mcr-4亚型mcr-4.2、mcr-4.3、mcr-4.4等相继在不同菌株中被发现。
1.5 mcr-5 2017年,有学者[16]在 2011-2016年间分离获得的414株乙型副伤寒沙门菌的14株mcr-1-、mcr-2-和mcr-3阴性的耐黏菌素d-酒石酸发酵乙型副伤寒沙门菌亚种(Salmonella Paratyphi B dTa+)中,通过全基因组测序发现一种新的与转座子相关的磷酸乙醇胺转移酶基因mcr-5,其基因全长1644bp,它是Tn3家族7337bp转座子的一部分,该基因通常位于多拷贝ColE型质粒上。此外,来自哥伦比亚的大肠埃希菌菌株也显示携带mcr-5基因[15],mcr-5含有3个结构域,即1个跨膜结构域,1个硫酸酯酶结构域和一个未知功能的结构域 (DUFl705)。 mcr-5 与 mcr-1、mcr-2、mcr-3、mcr-4氨基酸序列差异较大,分别只有36.11%、35.29%、34.72%和33.71%的同源性,mcr-5是由小型多拷贝ColE型质粒携带的,与之前发现的型别不同,其不携带任何参与质粒接合相关的转移基因。然而,在mcr-5硫酸酯酶结构域C末端中包含5 个保守残基 (E248、T286、H389、D458 和 H459),其与 mcr-1、mcr-2、mcr-3 和 mcr-4 中的残基相同。迄今为止,mcr-5也已发现有几种突变亚型。
1.6 mcr-6mcr-6的GenBank登记号为NG-055781,研究发现[17],它与来自大肠埃希菌的mcr-2显示87.9%的氨基酸同源性,具有65个氨基酸变异,与来自莫拉菌的mcr-2.1显示87.8%氨基酸同源性,具有66个氨基酸变异;携带mcr-6的莫拉菌属质粒与携带mcr-2的大肠埃希菌质粒具有85.6%同源性,仅有一小部分(86bp)的PAP2基因在大肠埃希菌中被保留;有趣的是,在含有mcr-6的质粒中并没有找到属于IS1595系列的插入元件ISEc69。
1.7 mcr-7 Yang等[18]首次从中国小鸡分离的3株肺炎克雷伯菌中发现一种新的质粒介导的多黏菌素耐药基因mcr-7.1,该基因位于大小为65631bp且包含87个开放阅读框 (ORFs)的IncI2质粒(pSC20141012)上,与mcr-3基因具有70%的氨基酸同源性。推导出的mcr-7.1基因产物的氨基酸序列具有539个氨基酸,为磷酸乙醇胺转移酶。mcr-7.1 蛋白质序列与 mcr-1,mcr-2,mcr-3,mcr-4,mcr-5和mcr-6的氨基酸同源性分别为35%,34%,70%,45%,36%和33%。mcr-7.1的结构可分为两个结构域,分别为磷酸乙醇胺转移酶(硫酸酯酶)(氨基酸231~516)的结构域和跨膜模块的结构域,其与mcr-3表现出类似的结构。该研究系统发育树分析显示mcr-7.1与mcr-3样序列具有紧密的遗传关系。值得注意的是,几乎所有mcr-7.1的mcr-3样序列都来源于气单胞菌属。此外,发现pSC20141012中mcr-7.1上游的ORFs与维氏气单胞菌中的磷酸二酯酶基因相似。这些发现表明,就像mcr-3一样,mcr-7.1起源于气单胞菌属。
1.8 mcr-8最新研究[19]来自于猪粪的耐碳青霉烯类肺炎克雷伯菌分离株中发现了一种新的移动多黏菌素抗性基因mcr-8,其位于大小为95983bp的Inc-FII型质粒上。此mcr-8氨基酸序列与mcr-1,mcr-2,mcr-3,mcr-4,mcr-5,mcr-6 和 mcr-7 的同源性分别 为 31.08% ,30.26% ,39.96% ,37.85% ,33.51% ,30.43%和37.46%,功能性克隆研究表明,携带有mcr-8基因的大肠埃希菌和肺炎克雷伯菌均对多黏菌素耐药。mcr-8含有两个结构域,结构域1(残基1~234)含有5个跨膜α-螺旋,而结构域2(残基235~565)位于催化中心。该研究显示,新型mcr-8基因在肺炎克雷伯菌中传播,更糟糕的是,肺炎克雷伯菌中mcr-8和blaNDM耐药基因的共存和流行可能通过食物链或环境途径进一步威胁公众健康。
2 防控策略
抗生素耐药性被认为是21世纪对人类健康最严重的全球性威胁之一,尤以CRE最为显著[31,32]。在多黏菌素耐药机制中,除染色体和质粒介导其耐药外,外排泵系统、荚膜多糖和细胞外膜蛋白OprH过度表达及细菌形成生物膜等均可能造成细菌对多黏菌素耐药[33]。由于质粒作为可移动DNA相较于染色体DNA更易复制,且能在不同细菌之间水平传播,故革兰阴性细菌中编码磷酸乙醇胺转移酶的质粒携带的mcr基因及其亚型是导致多黏菌素耐药性的重要机制。迄今为止,八种不同移动的质粒介导的多黏菌素耐药基因mcr型别分 别 为 mcr-1(1626bp)、mcr-2(1617bp)、mcr-3(1626bp)、mcr-4(1626bp)、mcr-5(1644bp)、mcr-6(1617bp)、mcr-7(1620bp)和 mcr-8(1698bp)及 其 亚型已在GenBank数据库中登记并注释。尽管目前大多数菌株对多黏菌素处于低水平耐药 (2~16ug/ml),但大量研究结果仍提示mcr基因类型复杂,突变速度较快,且其与其他耐药基因如blaNDM和blaKPC等共存形成的高度多重耐药细菌,将极大地威胁全球公共卫生安全,很可能使临床治疗陷入“无药可用”的境地[34]。因此,迫切需要采取以下策略进行防控[35,36]:①应大规模对人类和食源性动物进行多黏菌素耐药基因mcr的筛查,以便了解其流行情况和传播规律,并评价其对人类健康产生的风险。②监管部门应加强监督管理畜牧养殖业抗生素的使用,定期监测,警惕黏菌素耐药基因的广泛传播。③临床应合理使用抗生素,积极采用多种新型组合疗法来治疗多重耐药菌引起的感染,以减少临床对多黏菌素的使用。
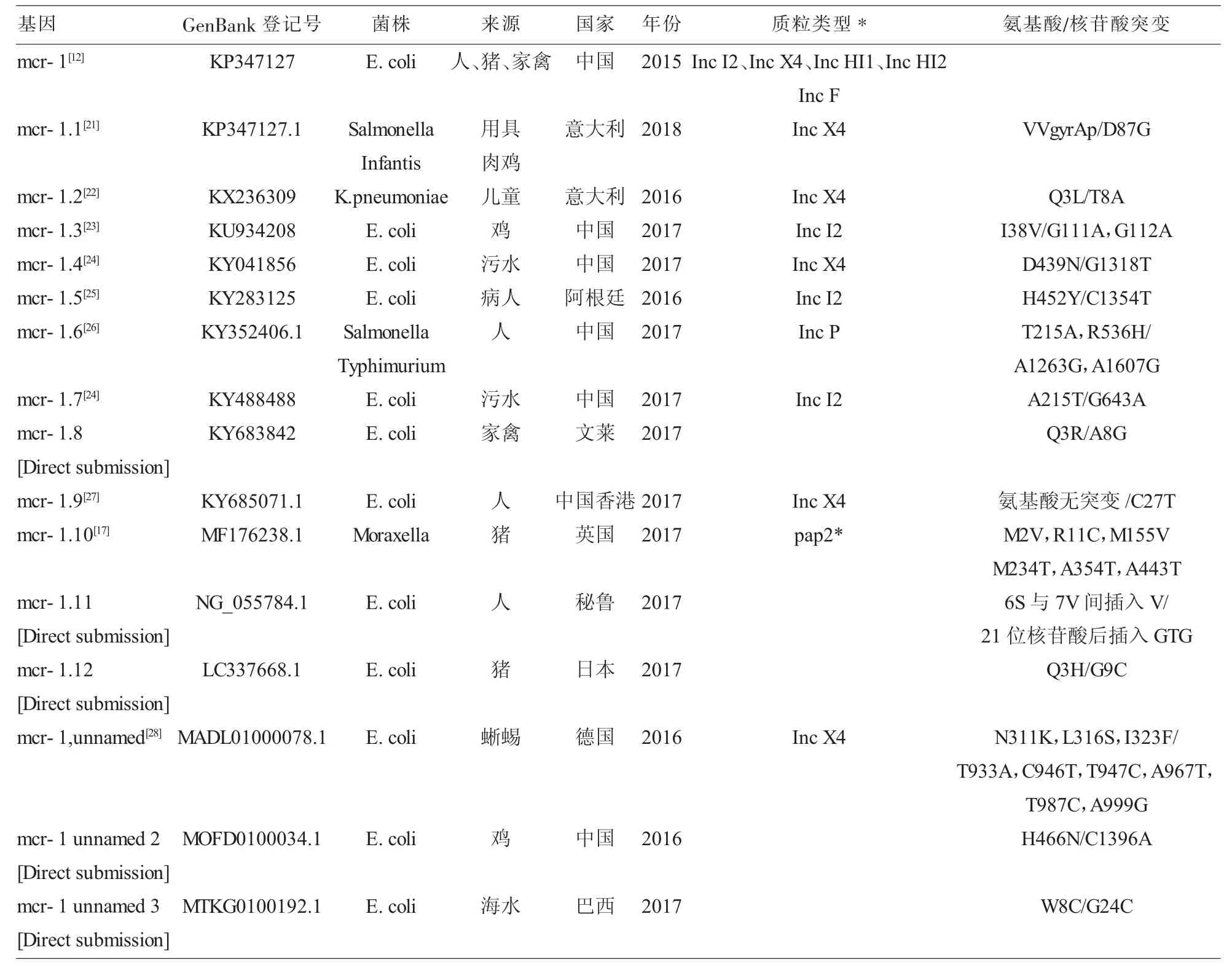
表1 多黏菌素耐药基因mcr-1各亚型的特征
