miR-155对SD大鼠晶状体上皮凋亡抑制作用的初步研究
2019-06-12王多梅
宋 梦,王多梅,汪 枫,2,周 青,汪 渊
晶状体上皮细胞是位于晶状体前囊膜最外层的单层细胞,在晶状体的物质代谢及损伤修复中发挥很大的作用,进而影响整个晶状体的通透性和内环境的稳定性[1]。在日常生活中,晶状体极易受到损伤,如紫外线照射、血糖增高、氧化反应、药物不良反应以及年龄老化等原因均可能损害晶状体上皮细胞的功能,导致晶状体上皮细胞凋亡现象发生。微小核糖核酸micro RNA(miR)是长度为19~25个核苷酸的非编码单链[2]。近期,miR-155作为动脉粥样硬化发病机制的关键因素出现,并且miR-155可以在不同细胞中调节炎症相关性信号通路基因的表达水平[3]。在日常生活中,糖尿病(diabetes,DM)是一种很普遍的疾病,在DM的发生发展过程中伴随着相关并发症的发生,其中晶状体随着时间延长和病情加重会逐渐浑浊,进而影响视力。该研究观察miR-155对高糖诱导晶状体浑浊的影响并初步探讨其机制。
1 材料与方法
1.1 材料
1.1.1实验细胞和动物及生长环境 人晶状体囊膜上皮细胞(human lens epithelial cells,HLEpiC)购自美国ScienCell公司。20只普通级雄性SD大鼠购自安徽医科大学实验动物中心,体质量(270±30)g,眼睛正常无损伤。实验大鼠均饲养在适合环境中,温度为20~27 ℃,相对湿度为50%~70%,正常作息光照,自由活动饮水饮食。实验过程完全符合《实验动物伦理条例》的规定。
1.1.2药品及试剂 miR-155购自上海GenePharma公司,-20 ℃保存;胎牛血清购自美国CLARK Bioscience 公司,-20 ℃保存,使用前室温回温;DMEM低糖培养基购自美国Gibco公司(DMEM培养基粉末一袋,谷氨酰胺0.58 g,丙酮酸钠0.11 g,碳酸氢钠3.7 g,青霉素160 U/ml,链霉素100 U/ml,溶于超纯水中,混匀后定容至1 L,0.22 μm无菌滤膜过滤除菌,储存于4 ℃备用);磷酸盐缓冲液(PBS,无Ca2+、Mg2+):称取NaCl 8.0 g 、KCl 0.2 g、KH2PO40.2 g、Na2HPO42 g,超纯水溶解混匀后定容至1 L,经高温高压灭菌(121 ℃、20 min),冷却后放4 ℃储存备用。二甲基亚砜(DMSO)购自美国Sigma公司,无菌过滤嘴过滤后,1.5 ml EP管储存备用。0.25%胰酶:称取0.25 g胰酶溶于PBS,磁力搅拌器搅匀后定容100 ml,过滤除菌,-20 ℃冰箱储存。
1.1.3实验相关仪器 CO2/O2三气水套式细胞培养箱、低温离心机和酶标仪(1510)购自美国Thermo Scientific公司;低速离心机购自长沙湘仪离心机仪器有限公司;-80 ℃冰箱购自日本sanyo公司;Milli-Q Direct-8纯水仪购自美国Millipore公司;电泳仪和垂直电泳槽购自北京六一仪器厂;制冰机(SCOTSMAN)和倒置、正置荧光显微镜(Leica DM3000B、DM4000)购自德国Leica公司;79-1磁力加热搅拌器购自常州杰瑞尔电器有限公司;电子天平:JY10001,JY2002、精密pH计PHS-3C型购自上海雷磁仪器厂;安徽医科大学第一附属医院眼科提供眼科手术器械。
1.2 方法
1.2.1动物组织体外培养实验最佳用药浓度 取质量相同范围,状态良好的SD大鼠,4只一笼,正常的适应性饲养1周后取材。10%水合氯醛经腹腔注射麻醉后将鼠仰卧固定,用手指抵住老鼠眼部,将眼球凸出,用剪刀将眼球剪下,用手术镊子固定眼球,用眼科剪刀将眼球剪破,将晶状体取出。取出晶状体进行体外培养,加药处理,分组包括:低糖(low-glucose group, LG)培养基组、甘露醇组、高糖(high-glucose group, HG)培养基组、miR-155用药组(mimic)、药物对照组(control,CTm)。分别在48 h和72 h时收取冻存一份。
1.2.2细胞复苏、培养和分组 冻存的HLEpiC在37 ℃温水中快速复苏,接种于7 ml含10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2细胞培养箱培养,隔日换液。细胞长到密度为80%~90%时,开始1 ∶3分瓶传代,取对数生长期细胞进行实验。
1.2.3细胞和组织总蛋白的提取 采用Western blot法将不同实验组的细胞蛋白进行免疫印迹实验,组织蛋白的提取:配制裂解液,根据每组晶状体个数不同加入对应体积的裂解液,一个晶状体加500 μl,两个加1 ml,记录好。冰上充分研磨组织,研磨结束后的组织悬液直接放研磨器中置冰上30 min,使细胞充分裂解。用于BCA定量。HLEpiC细胞加药处理后,冰上操作,弃去培养基,预冷PBS洗3遍,每瓶加入配置好的裂解液200 μl,轻轻摇晃,使得裂解液覆盖在细胞表面,冰上放置20 min;取出1.5 ml离心管做好标记,冰上预冷;细胞刮刮下细胞层后,将细胞裂解液体吸入对应离心管,冰上静置30 min,-80 ℃、4 ℃反复冻融3次,于4 ℃、14 000 r/min离心30 min,取上清液至另一新EP管中,用于BCA定量。
1.2.4Western blot 配制聚丙烯酰胺凝胶,胶凝上样跑胶。准备转膜用具,装制转移“三明治”:海绵—3层滤纸—胶—PVDF膜—3层滤纸—海绵,整个操作在预冷的转移液中进行;转膜结束后用5%的脱脂奶粉室温封闭2 h。封闭结束后洗膜,放入其对应的一抗中孵育,孵育条件为4 ℃垂直摇床孵育过夜或者更长时间,一抗浓度为:Bax(1 ∶500)、Bcl-2(1 ∶500)、caspase-3(1 ∶250)、procaspase-9(1 ∶500),视情况而定。PVDF膜用TBST洗3次,TBS洗1次,每次8 min,放入其对应的辣根过氧化物酶标记的二抗(鼠抗浓度为1 ∶1 000,兔抗浓度为1 ∶500)中孵育2 h,。PVDF膜从二抗中取出后,TBST洗3次,TBS洗1次,每次8 min,进行机器显影;ECL反应液(A液和B液等体积混匀)现配现用,均匀涂在PVDF膜相应条带位置上。
1.2.5流式细胞术 流式凋亡试剂盒购自美国Invitrogen公司。取一瓶生长至80%的HLEpiC细胞,消化离心,接种于6孔板中,置于细胞培养箱中培养,培养条件为37 ℃、5% CO2。待细胞浓度长到60%后,将mimic和CTm加到培养基中混匀后,分别加到不同的孔中处理48 h。将上清和消化的细胞一起离心,1 000 r/min离心7 min弃上清液,加入2 ml PBS重悬再次离心,重复1遍。倾去上清液,加入稀释好的1×Annexin V buffer 100 μl重悬后,试管中加入核酸染料(7-amino-actinomycin D,7-AAD)与碘化丙啶(propidium iodide, PI)各2.5 μl混匀,室温避光反应15 min。每孔加入400 μl Ca2+依赖性磷脂结合蛋白缓冲液(Annexin V buffer)混匀后,上机检测,1 h内完成。
2 结果
2.1 mimic对SD大鼠晶状体蛋白中凋亡相关蛋白的影响用30 nmol/L的mimic和30 nmol/L的药物对照CTm体外培养SD大鼠晶状体48 h和72 h后收取组织,提取晶状体总蛋白做Western blot实验,观察不同处理组蛋白表达量的变化。48 h时,甘露醇仅作为大分子对照组,与高糖组比较,低糖培养组抗凋亡蛋白Bcl-2表达明显上升(F=59.721,P<0.05),与高糖组比较,mimic作为miR-155的激动剂,其抗凋亡蛋白Bcl-2表达量明显高于高糖培养组(F=37.313,P<0.05),与高糖组相比,药物对照CTm组Bcl-2表达量也呈上升趋势(F=36.113,P<0.05)。而促凋亡蛋白Bax在高糖培养组中表达最多,与高糖组比较,在低糖组Bax表达明显降低(F=33.09,P<0.05)且miR-155的激动剂mimic组Bax表达量明显减少(F=7.986,P<0.05),提示高糖培养能够促进晶体细胞凋亡的发生,而mimic能改变SD大鼠晶状体蛋白中凋亡蛋白的表达。各组中caspase 3表达量趋势与Bax表达量趋势相同,而procaspase 9表达量趋势与Bcl-2表达量趋势一致。见图1。72 h时,甘露醇仅仅作为大分子对照组。与高糖对照组比较,低糖培养组促凋亡蛋白Bax表达明显下降(F=21.758,P<0.05)。高糖培养组的促凋亡蛋白Bax表达量明显高于其他组,与高糖对照组比较,mimic作为miR-155的激动剂,其促凋亡蛋白Bax表达量明显降低,而其药物对照CTm组Bax表达量也有下降趋势(F=158.64,P<0.05)。而抗凋亡蛋白Bcl-2在高糖培养组中表达最少,与高糖对照组比较,在低糖组Bcl-2表达量明显增加(F=664.424,P<0.05)且miR-155的激动剂mimic组表达量明显上升(F=38.809,P<0.05),提示高糖培养能够促进晶状体细胞凋亡的发生,而mimic能改变SD大鼠晶体蛋白中凋亡蛋白的表达。见图2。
2.2 mimic对HLEpiC凋亡的影响前期的晶状体组织研究结果表明,当用药浓度为30 nmol/L时,mimic可以明显抑制晶状体凋亡现象的发生。流式细胞术分组有双标组,其中双标组含有碘化丙啶(propidium iodide, PI)和异硫氰酸荧光素(fluoresceine isothiocyanate,FITC);miR-155的激动剂mimic组,mimic的药物对照CTm组,低糖组,甘露醇组,高糖组。并且呈现同样的结果,各组早期凋亡率(第四象限)和晚期凋亡率(第一象限)之和分别为1.091%、5.756%、6.320%、5.800%、6.381%、16.713%。低糖对照组凋亡细胞明显很少,与低糖对照组相比,加药组凋亡细胞比例无太大变化而高糖对照组早期凋亡和晚期凋亡的细胞比例明显增加,总凋亡的细胞数超过10%。见图3。所有结果提示mimic用药浓度为30 nmol/L时可以抑制HLEpiC细胞发生凋亡。
2.3 mimic对HLEpiC中凋亡相关蛋白的影响用30 nmol/L的mimic和30 nmol/L的CTm处理HLEpiC细胞48 h后,提取细胞蛋白做Western blot实验,观察不同处理组蛋白表达量的变化。48 h时,甘露醇作为大分子对照组,与高糖组相比低糖培养组procaspase 9表达明显上升并且mimic作为miR-155的激动剂,其procaspase 9表达量明显升高(F=496.967,P<0.05)。而caspase 3在高糖培养组中表达最多,与高糖组相比,低糖组caspase 3表达量明显减少(F=760.859,P<0.05),并且miR-155的激动剂mimic组caspase 3表达量明显降低,提示高糖培养能够促进晶状体细胞凋亡的发生,而mimic能改变SD大鼠晶状体蛋白中凋亡蛋白的表达。结果与组织蛋白的结果图趋势相同。见图4。

图1 miR-155对凋亡相关蛋白表达水平的影响(48 h)

图2 miR-155对凋亡相关蛋白表达水平的影响(72 h)
A:Bax、Bcl-2蛋白表达;B:caspase-3、procaspase-9蛋白表达;1:低糖组;2:甘露醇组;3:高糖组;4:mimic组;5:CTm组;与高糖组比较:*P<0.05

图3 miR-155对HLEpiC细胞凋亡的影响
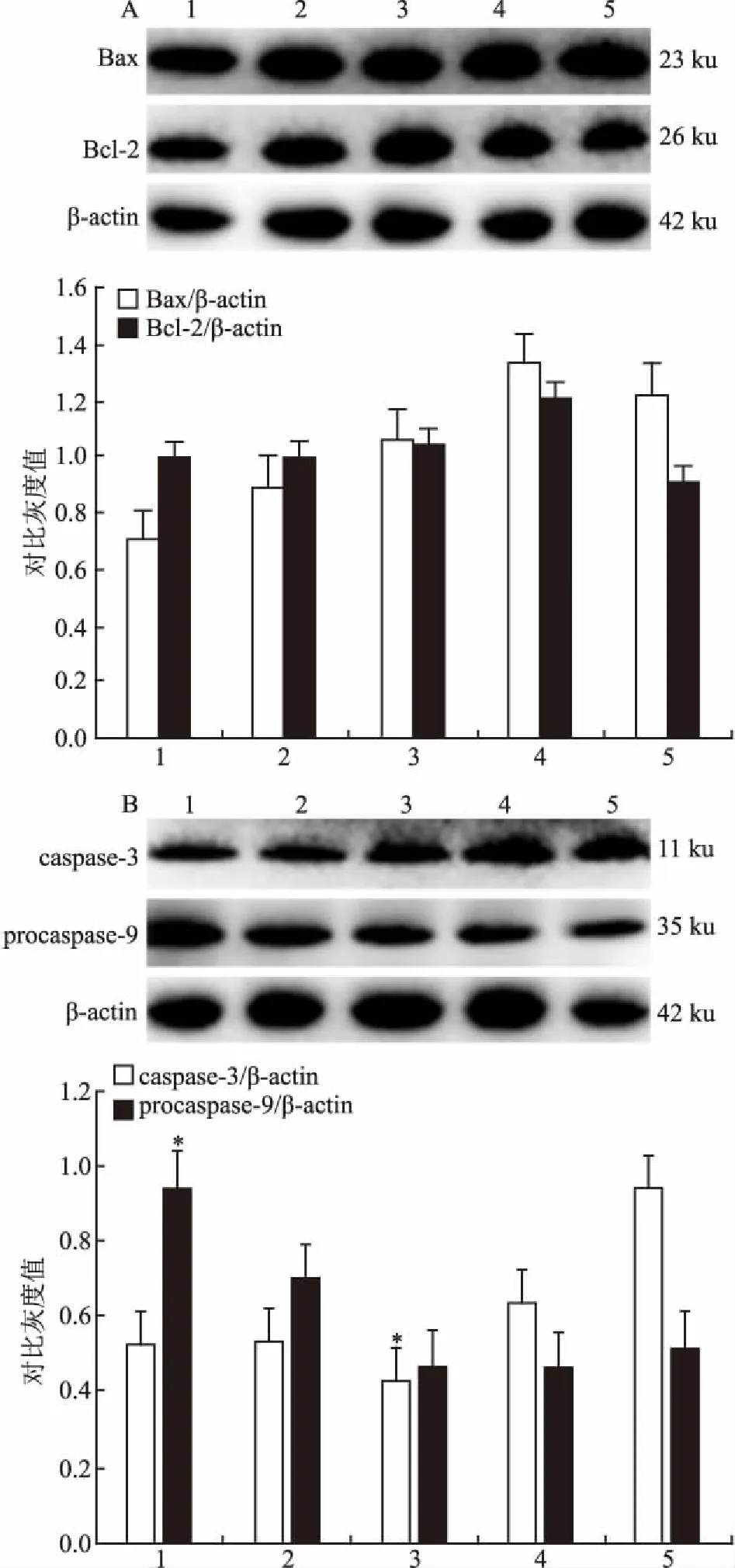
图4 miR-155对凋亡相关蛋白表达水平的影响
A:Bax、Bcl-2蛋白表达;B:caspase-3、procaspase-9蛋白表达;1:mimic组;2:CTm组;3:低糖组;4:甘露醇组;5:高糖组;与高糖组比较:*P<0.05
3 讨论
近年来发现DM是损害包括眼睛在内的全身性疾病。DM可以引起很多的并发症,包括视网膜病变、肾病综合征、神经病变和高昂的医疗保健费用[4]。DM患者与非糖尿病患者相比更容易得相应的并发症,DM患者与非糖尿病患者相比也更容易形成白内障[5-6]。为进一步研究糖尿病性白内障的发病机制以及miR-155在治疗白内障过程中的作用。本文采用体外造模的方式,操作相对简单,实验周期也相对较短,对于相似实验均可采用体外造模来验证。研究[7]显示miR-155通过下调间充质干细胞中抗氧化相关基因来诱导反应活性氧(reactive oxygen species,ROS)的产生,所以进一步验证其是否也可以影响晶状体的抗氧化基因,进而改变高糖对晶状体的损害作用。研究[8]显示葡萄糖浓度为20、30、40 mmol/L时,均可造成肺腺癌A549细胞DM相应并发症的现象,根据预实验结果选择葡萄糖浓度为25 mmol/L来进行体外造模实验,实验得到的结果表明此浓度的葡萄糖培养基与低糖培养基相比可以促使HLEpiC细胞发生凋亡。
近年来miR-155也广泛应用于各个疾病治疗中,研究[9]显示miR-155在食物过敏小鼠模型中的作用,可以通过抑制miR-155的表达来抑制小鼠食物过敏的发生,表明miR-155对食物过敏有潜在的治疗作用。也有研究[10]显示内源性miR-155控制死亡配体程序性死亡受体-配体1(programmed cell death-Ligand 1,PD-L1)诱导上调γ-干扰素(γ-interferon,I FN-γ)肿瘤坏死因子α(tumor necrosis factorα, TNF-α)的最大水平,在真皮纤维母细胞中也获得了类似的发现,证明IFN-γ/TNF-α/miR-155/PD-L1通道并不局限于人皮肤淋巴管内皮细胞,这些结果表明,miR-155在原发性细胞炎症引起的炎症反应中起到了至关重要的作用。通过参考文献,本文研究了miR-155对高糖诱导的体外培养的晶体是否有治疗作用。
本文首先做晶状体的体外培养实验,分别在48 h和72 h时提取组织蛋白,通过Western blot实验得出,高糖培养组在两个时间段中,促凋亡蛋白的表达量均明显高于其他组,并且加药组能够降低促凋亡蛋白的表达,提高抗凋亡蛋白的表达量。并且在细胞实验的流式细胞分析以及Western blot实验中得到了相同的结果。
本课题目的在于研究miR-155是否抑制由高糖引起的晶状体凋亡现象的发生,通过组织实验和细胞实验分别得到验证,miR-155浓度为30 nmol/L时,可以明显地抑制高糖引起的晶状体促凋亡蛋白Bax的表达以及促进其抗凋亡相关蛋白Bcl-2的表达,caspase家族蛋白caspase-3和procaspase-9也有相应的变化,证明高糖可以促进晶状体凋亡现象的发生。但miR-155是否对其他信号通路有影响尚且不明确,有待进一步研究。
