肝细胞生长因子活化JAK2/STAT3通路促进巨噬细胞M1型向M2型极化
2019-06-12顾奕玥胡泽平王云飞
顾奕玥,胡泽平,王云飞,周 青,汪 渊
肝细胞生长因子(hepatocyte growth factor, HGF)是一种多功能生长因子,与其特异性受体(c-Met)结合后,通过激活相关信号通路在调节炎症免疫等方面发挥重要功能[1]。动脉粥样硬化(atherosclerosis, AS)是由炎症介导的慢性血管疾病,AS斑块中,巨噬细胞通过分泌大量促炎因子,使AS斑块趋于不稳定[2-3]。研究[4]表明,AS斑块中的巨噬细胞因局部微环境的变化,可分化为经典活化促炎的M1型和替代活化抗炎M2型。在不稳定斑块的脂质核心M1型大量存在,促进AS进展;在稳定型斑块中M2型数量较高,促进斑块稳定。调控M1型巨噬细胞向M2型极化已成为抗AS治疗的重要靶点。HGF和受体c-Met广泛存在于心血管系统中,具有很强的抗炎作用。本课题组前期进行的动物实验和体外细胞实验[5]结果表明:HGF促进M2表型标志物精氨酸酶Ⅰ(Arg Ⅰ)的表达,抑制M1表型标志物一氧化氮合酶(iNOS)的表达,促进斑块稳定、抑制AS进展;HGF可能促进巨噬细胞M1型向M2型转化,但其具体分子机制并不明确。近年来研究[6-7]显示,信号转导和转录激活因子3(STAT3),作为HGF/c-Met轴的下游效应因子,与M2型巨噬细胞极化和抗炎因子产生密切相关。该研究旨在探讨HGF是否通过JAK2/STAT3信号通路促进巨噬细胞M1型向M2型极化。
1 材料与方法
1.1 细胞株和主要试剂RAW264.7细胞株为小鼠来源的巨噬细胞株,由中国科学技术大学生命科学院赠送。HGF、干扰素-γ(interferon-γ, IFN-γ)购自美国Peprotech公司;细菌脂多糖(lipopolysaccharide, LPS)、二甲基亚砜(dimethylsulfoxide, DMSO)购自美国Sigma公司;DMEM(高糖)培养基购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;Janus激酶2(JAK2)特异性抑制剂AG490购自美国Med Chem Express公司;iNOS、白细胞介素-6(IL-6)、Arg Ⅰ、白细胞介素-10(IL-10)、JAK2、STAT3、P-STAT3、β-actin抗体购自美国Sant Cruz Biotechnology公司;P-JAK2抗体购自美国abcam公司;二抗购自北京中杉金桥生物技术有限公司;Griess reagents试剂盒购自上海碧云天公司。
1.2 主要仪器和设备无菌细胞操作台(苏净安泰公司);CO2/O2三气水套式细胞培养箱、低温离心机(Thermo Scientific,美国);酶标仪(1510,Thermo Scientific,美国);电泳仪、垂直电泳槽(北京六一仪器厂);制冰机(SCOTSMAN)。
1.3 方法
1.3.1细胞培养和传代 37 ℃水温复苏RAW264.7细胞,用DMEM(高糖)完全培养基(10%胎牛血清、100 μg/ml青霉素、100 U/ml链霉素),将细胞瓶置入饱和湿度37 ℃、5% CO2培养箱中培养,每48 h更换培养基1次,待细胞长至80%~90%,用0.25%胰酶进行消化传代,用于以下实验。
1.3.2细胞诱导和分组 未极化的RAW264.7巨噬细胞为M0对照组;IFN-γ(20 ng/ml)和LPS(500 ng/ml)诱导RAW264.7巨噬细胞(M0型)12 h,使M0巨噬细胞极化呈M1型[8-9],为M1组。不同浓度的HGF(5、10、20 ng/ml)干预巨噬细胞M1型12 h,为5M1组、10M1组、20M1组;50 μmol/L AG490和10 ng/ml HGF共同干预巨噬细胞M1型12 h,为AG490+10M1组。
1.3.3CCK8检测法 取冲悬的RAW264.7巨噬细胞,按200 μl/孔(2×103个细胞)种于96孔板内,按1.3.1细胞培养方法,培养至细胞贴壁后,换用无血清培养基继续培养12 h,然后分别给予0、0.1、0.5、2.5、5、10、15、20 ng/ml浓度HGF干预12 h。每孔加入10 μl的CCK8试剂,37 ℃、5% CO2培养箱孵育4 h后,在酶标仪上,450 nm处检测各孔吸光度值。
1.3.4培养上清液亚硝酸盐浓度(NO%)的测定 分别收集M0、M1、5M1、10M1、20M1组细胞培养上清液。使用Griess reagents试剂盒检测各组培养上清中亚硝酸盐的分泌。使用全自动酶标仪在540 nm处读取吸光度值。
1.3.5Western blot法检测蛋白表达 上述方法分组处理好巨噬细胞后,用4 ℃的PBS清洗3次,每孔加入150 μl蛋白裂解液,静置冰上30 min,充分裂解后刮取细胞蛋白存于1.5 ml EP管中反复冻融3次,4 ℃、14 000 r/min离心30 min弃除上清液,用BCA法进行蛋白定量。配制SDS-PAGE凝胶,各组等量蛋白上样、电泳分离,电泳后将蛋白转移至PVDF膜上。室温下5%脱脂牛奶封闭PVDF膜2 h,分别用TBST、TBS清洗PVDF膜一次,相应的一抗(1 ∶1 000)孵膜,4 ℃过夜。TBST洗膜3次后用TBS洗膜1次,每次10 min。室温孵育二抗(1 ∶5 000)2 h,TBST洗膜3次后用TBS洗膜1次,ChemiQ4600mini化学发光成像系统显影,β-actin为内参,用 Quantity One系统进行灰度值分析。
1.4 统计学处理采用SPSS 16.0、GraphPad Prism 5软件进行数据统计分析,组间比较采用SNK-Q检验,P<0.05为差异有统计学意义。
2 结果
2.1 HGF对RAW264.7巨噬细胞增殖的影响用浓度在0~20 ng/ml之间的HGF预处理巨噬细胞12 h,与M0对照组比较,HGF对RAW264.7巨噬细胞无增殖作用(F=1.868,P=0.13)。选用HGF(5、10、20 ng/ml)进行后续实验。
2.2 HGF对M1型巨噬细胞培养上清液亚硝酸盐浓度的影响与M0对照组比较,M1组培养上清液亚硝酸盐浓度明显升高(F=7.129,P<0.05)。与M1组比较,各干预组培养上清液亚硝酸盐浓度较干预前明显下降(F=5.705,P<0.05),见图1。
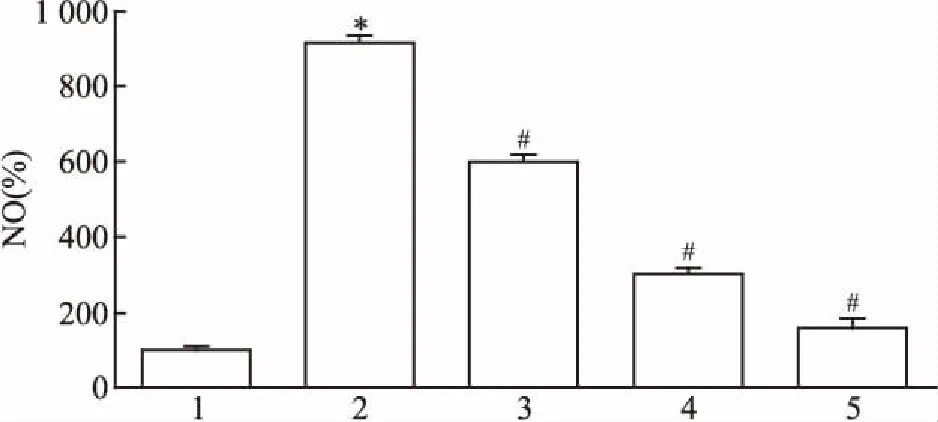
图1 HGF对巨噬细胞M1型培养上清液亚硝酸盐浓度的影响
1:M0对照组;2:M1组;3:5M1组;4:10M1组;5:20M1组;与M0组比较:*P<0.05;与M1组比较:#P<0.05
2.3 HGF对M1型巨噬细胞M1、M2表型标志物蛋白表达的影响与M0对照组比较,M1组巨噬细胞M1表型标志物iNOS、IL-6蛋白表达显著增加(F=3.326、316.529,P<0.05),见图2A;M1组巨噬细胞M2表型标志物Arg Ⅰ、IL-10蛋白表达明显减少(F=22.515、33.832,P<0.05),见图2B。与M1组比较,不同浓度HGF干预巨噬细胞M1型12 h后,各干预组M1表型标志物iNOS、IL-6蛋白表达呈剂量依赖性减少(F=284.711、568.634,P<0.05),见图2A;各干预组M2表型标志物Arg Ⅰ、IL-10蛋白表达呈剂量依赖性增加(F=431.018、1.302,P<0.05),见图2B。

图2 HGF对M1型巨噬细胞M1和M2表型标志物蛋白表达的影响
2.4 HGF对JAK2/STAT3信号通路的影响与M0对照组比较,M1组JAK2/STAT3通路相关蛋白JAK2、STAT3磷酸化水平较低(F=6.283、30.863,P<0.05),见图3;与M1组比较,不同浓度HGF干预M1巨噬细胞后,各干预组JAK2、STAT3磷酸化水平明显增强,呈剂量依赖性(F=130.709、22.480,P<0.05),见图3。使用JAK2特异性阻断剂AG490 50 μmol/L与10 ng/ml HGF干预巨噬细胞M1型12 h后,与10M1组比较,AG490+10M1组M2表型相关蛋白Arg Ⅰ表达水平明显下降(F=299.75,P<0.05),见图4。
3 讨论
HGF最初因其在肝脏再生中的促分裂作用被发现和研究。这种多功能生长因子由间质细胞分泌,与其特异性受体c-Met结合后,通过激活相关信号通路在细胞增殖、运动与迁移、抗凋亡、抗纤维化和调节炎症免疫等方面发挥重要的功能。近年来研究[10]表明,HGF与受体c-Met结合,可促进缺血心肌血管新生,并调节多种细胞信号转导通路,发挥其复杂多效的抗AS作用。

图3 HGF对JAK2/STAT3信号通路的影响
1:M0对照组;2:M1组;3:5M1组;4:10M1组;5:20M1组;与M0组比较:*P<0.05;与M1组比较:#P<0.05

图4 JAK2/STAT3通路被抑制后M2型相关蛋白表达
1:M0对照组;2:M1组;3:10M1组;4:AG490+10M1组;与M0比较:*P<0.05;与M1比较:#P<0.05;与10M1比较:△P<0.05
AS是一种慢性炎症性疾病,AS斑块中,巨噬细胞通过吞噬氧化的低密度脂蛋白(ox-LDL)形成泡沫细胞,并分泌大量促炎因子,导致斑块脂质核心增大,使AS斑块趋于不稳定。AS斑块中的巨噬细胞,根据局部微环境的差异,可进一步分化成不同的细胞亚型。并且,随着微环境的变化,不同的细胞亚型之间,可以相互转化,即为极化可塑性。目前,研究比较明确的巨噬细胞亚型包括经典活化促炎的M1型和替代活化抗炎M2型。在动脉粥样斑块中,M1型巨噬细胞增多时,生成和释放促炎性因子(iNOS、IL-6等),使斑块稳定性下降易于破裂,导致血栓形成,造成心血管事件的发生;当M2型巨噬细胞增多时,分泌IL-10、转化生长因子-β(TGF-β)等抑炎因子,可使斑块纤维帽增厚,增加斑块的稳定性。因此,诱导M1型巨噬细胞向M2型极化可以抑制斑块进展,促进斑块稳定。调控巨噬细胞极性可能成为临床治疗以AS为病理基础的心血管疾病的新策略。
本研究中,LPS和IFN-γ诱导的M1型巨噬细胞高度表达M1表型标志物iNOS、IL-6,并大量分泌亚硝酸盐。经HGF干预后,M1表型标志物iNOS、IL-6的表达和培养上清中亚硝酸盐的释放明显降低,M2表型标志物Arg Ⅰ、IL-10的表达明显增加。这些结果表明HGF促进M1向 M2表型极化。
JAK2是一种蛋白酪氨酸激酶,STAT3作为JAK2的直接底物,存在于细胞质中并调节相关靶基因的表达[11-12]。JAK2对STAT3的磷酸化,促进STAT3的核转位,并激活M2巨噬细胞相关抗炎因子IL-10、Arg-1的表达[13-14]。M2型巨噬细胞中,STAT3信号通路的激活程度,远高于M1型巨噬细胞。有研究[15]表明,HGF/c-Met可激活下游效应因子STAT3,调节免疫应答。本研究显示,与M0对照组或M1组相比,HGF干预LPS和IFN-γ诱导的M1型巨噬细胞后,可以显著活化JAK2/STAT3信号通路。通过在HGF干预的M1型巨噬细胞中加入JAK2特异性阻断剂,发现LPS和IFN-γ诱导的RAW264.7巨噬细胞(M1型)M2表型相关蛋白Arg I表达明显降低。这表明抑制JAK2可阻断HGF促进M2型巨噬细胞极化和产生抗炎因子Arg I的能力。这些结果表明,HGF促进M1型巨噬细胞向M2型巨噬细胞极化的分子机制可能与活化JAK2/STAT3信号通路相关。
体内大部分巨噬细胞在复杂的微环境中是处于M1型和M2型之间的某个状态。HGF促进M1向M2表型极化,调节了M1/M2型巨噬细胞分化的比例,可能成为治疗AS的新靶点。但HGF调控M1型巨噬细胞向M2型巨噬细胞极化,是否还涉及其他分子机制,有待进一步深入研究。
