TRAF-6调控TGF-β1-Smad2/Smad3信号通路在Graves病免疫发病机制中的作用①
2019-06-10郑晓雅
谭 燕 郑晓雅 李 莎 刘 纯
(重庆医科大学附属第一医院内分泌科,重庆400016)
Graves 病(Graves′ disease,GD)是一种常见的自身免疫性甲状腺疾病,可释放过量甲状腺激素而导致甲状腺功能亢进,进而引起多器官损害。目前,GD的发病机制尚不完全清楚。Th17细胞是一种新发现的CD4+T细胞亚群,能够分泌白介素-17A/F(Interleukine-17A/F,IL-17A/F)等多种效应细胞因子[1]。前期研究发现Th17细胞及其效应因子IL-17参与GD的发病过程[2]。维甲酸相关孤儿受体γt(Retinoid-related orphan receptor gamma t,RORγt) 是Th17细胞的特异性转录因子,诱导Th17细胞的分化和IL-17的表达。Treg细胞是CD4+T细胞的另一种细胞亚型,可以直接发挥免疫抑制作用,也可以通过分泌调节免疫的IL-10、转化生长因子-β(Transforming growth factor-β,TGF-β)抑制细胞免疫[3-7]。Treg细胞及其分泌的细胞因子在GD的发病过程中发挥免疫抑制的作用[8]。叉头蛋白P3(Forkhead box protein p3,Foxp3)是Treg细胞的特异性转录因子,控制Treg细胞的发育和功能。Th17细胞和Treg细胞的分化相互抑制,功能相互调节,在机体正常状况下保持平衡,而Th17/Treg细胞失衡参与多种自身免疫性疾病的发生[9,10],包括 GD[8]。然而,Th17/Treg细胞平衡的上游调控机制仍不清楚,有待进一步研究。研究发现,IL-2可作为分化信号诱导初始CD4+T细胞向Treg细胞分化,同时抑制Th17细胞的分化,进而调控Th17/Treg细胞平衡[11-15]。耿明霞等[16]的研究发现,IL-2在GD中表达降低,参与GD的发生过程。因此,IL-2可能通过调控Th17/Treg细胞平衡,进而阻碍GD的发生。IL-2的表达在各个水平上都受到精密调控,过高或过低均会引起机体免疫功能紊乱。
近来研究表明,除了介导免疫炎症,肿瘤坏死因子受体相关因子-6(Tumor necrosis factor receptor-associated factor-6,TRAF-6)在维持免疫耐受方面也具有重要意义[17-19]。新近研究发现,TRAF-6可能通过阻碍TGF-β介导的Smad2/Smad3磷酸化而上调IL-2的表达,进而抑制Th17细胞的分化,控制炎症的发生,发挥免疫耐受的作用[20]。同时,TRAF-6在维持Treg细胞的扩增和稳定性中发挥关键作用,并参与免疫耐受[21]。此外,TGF-β1在免疫系统中发挥重要作用,参与机体免疫调节[22]。因此,TRAF-6可能通过下调TGF-β1介导的Smad2/Smad3磷酸化,解除对IL-2表达的抑制,进而调控效应T细胞的分化,参与维持免疫耐受。前期研究发现,GD患者的外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)中TRAF-6的mRNA和蛋白的表达较对照组减少,且差异具有统计学意义[23],提示TRAF-6可能通过发挥免疫耐受的作用,参与GD的发病。然而,在GD的发病过程中,TRAF-6是否发挥免疫耐受的作用及其具体的作用机制目前尚不清楚。因此,本研究旨在探索TRAF-6是否通过影响TGF-β1-Smad2/Smad3的磷酸化,解除对IL-2表达的抑制,调控Th17/Treg细胞的分化平衡,进而在GD的发生中发挥免疫耐受的作用。
1 资料与方法
1.1资料
1.1.1研究对象 收集2016年11月至2017年6月在重庆医科大学附属第一医院内分泌科就诊的GD病患者和参加体检的健康人,将志愿者分为初诊GD组、甲状腺功能恢复正常的GD(eGD)组和对照组(NC)。根据2008年《中国甲状腺疾病诊治指南》[24],初诊GD组纳入标准:首次诊断为 GD 且未服用任何抗甲状腺药物的患者,伴有甲状腺功能亢进的症状和体征;均有不同程度弥漫性甲状腺肿大;血浆游离三碘甲状腺原氨酸(Free triiodothyronine,FT3)或游离甲状腺激素(Free thyroxine,FT4)升高及敏感促甲状腺激素(Ultra-sensitive thyroid stimulat-ing hormono,uTSH)降低;血浆抗促甲状腺素受体抗体(Thyrotrophin receptor antibody,TRAb)呈不同程度阳性。 GD组共30例患者,其中23例女性,7例男性。eGD组纳入标准:既往明确诊断为 GD 的患者,经抗甲状腺药物治疗时间≥1 年且甲状腺功能恢复正常,现甲巯咪唑(赛治) 维持治疗剂量5~10 mg/d的GD患者。eGD组共30例患者,其中19例女性,11例男性。NC组纳入标准:性别及年龄匹配的健康人。NC组共28例,其中16例女性,12例男性。所有入选对象均需排除患有1型糖尿病、系统性红斑狼疮、类风湿性关节炎、自身免疫性肝炎等常见的自身免疫性疾病、急性感染及慢性炎症性疾病等且过敏、妊娠、长期口服任何非甾体类或糖皮质激素类药物的患者。
1.1.2实验材料 人淋巴细胞分离液(天津TBD生物技术发展中心,中国);RNAiso Plus、逆转录试剂盒、PCR扩增试剂盒 (TaKaRa,日本);RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE配制凝胶试剂盒(碧云天,中国);预染蛋白Marker Ladder(Thermo,美国);磷酸酶抑制剂(Roche,美国);ECL试剂盒(Advansta,美国);兔抗人β-actin、兔抗人TRAF-6、兔抗人Smad2/Smad3、兔抗人磷酸化Smad2、兔抗人磷酸化Smad3抗体(CST,美国);辣根过氧化物酶标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,中国);脱脂奶粉(Bio-Rad,美国);PVDF膜(Millipore,美国);人IL-17、人IL-10、人IL-2、人TGF-β1 ELISA试剂盒(USCN,美国);甲状腺功能、甲状腺自身抗体试剂盒(贝克曼库尔特,美国)和检测仪器(Beckman Coulter UniCel DxI 800);荧光定量PCR仪(CFX 96 Real-Time System,Bio-Rad,美国)。
1.2方法
1.2.1样本采集 采集研究对象静脉血12 ml于EDTA抗凝真空采血管内,其中2 ml静脉血用于检测甲状腺功能和甲状腺自身抗体,余下10 ml静脉血用于PBMCs的提取。
1.2.2甲状腺功能和甲状腺自身抗体的检测 甲状腺功能(FT3,FT4,uTSH)以及自身抗体包括甲状腺球蛋白抗体(Thyroglobulin antibody,TGAb),甲状腺过氧化物酶抗体(Thyroid peroxidase antibody,TPOAb)和TRAb检测采用美国贝克曼库尔特测定仪及其试剂,利用化学发光免疫分析法,由本科室专职实验人员完成。甲状腺功能及其自身抗体的参考值:FT3为2.5~3.9 pg/ml;FT4为0.61~1.12 ng/dl;uTSH为0.35~3.5 uU/ml;TPOAb为0~9 U/ml;TGAb为0~4 U/ml;TRAb为0.3~1.8 U/L。
1.2.3PBMCs的分离 采用 Ficoll密度梯度离心法,分离的总PBMCs中将三分之一细胞(约3×106~4×106) 用于RNA提取,余下约三分之二PBMCs(约6×106~8×106)用于总蛋白提取。
1.2.4总RNA的提取和荧光定量RT-PCR法测定RORγt、Foxp3、IL-2和TRAF-6 mRNA的表达 细胞总RNA的提取按照RNAiso Plus的说明书进行。cDNA 按照 Prime-ScriptTMRT reagent Kit 的说明书进行逆转录合成。RORγt、Foxp3、IL-2和TRAF-6 mRNA的引物序列见表1。荧光定量 PCR反应条件为95℃、30 s;95℃、5 s,60℃、30 s,重复 40个循环。反应体系:cDNA 1.0 μl,上游引物0.4 μl,下游引物 0.4 μl,SYBE GREEN 5.0 μl,DEPC水3.2 μl。以NC组作对照,计算各组RORγt、Foxp3、IL-2和TRAF-6 mRNA的2-ΔΔCt,获取各组目的基因的相对表达量。
1.2.5ELISA 法测定 IL-17A、IL-10、IL-2、TGF-β1的表达 取患者和健康人血清,ELISA法测定IL-17A、IL-10、IL-2、TGF-β1的表达,具体操作严格按试剂盒说明书进行。
1.2.6Western blot测定总Smad2/Smad3、p-Smad2/Smad3和TRAF-6蛋白的表达 以细胞裂解液提取细胞总蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,等量的蛋白样品行聚丙烯酰胺凝胶电泳后转膜,电转移至 PVDF 膜。TBST 洗膜 3次,每次5 min,脱脂奶粉常温封闭4 h,TBST洗膜3次,每次5 min。加入兔抗人 p-Smad2单抗(1∶1 000)、兔抗人 p-Smad3单抗(1∶1 000)、兔抗人Smad2/Smad3单抗(1∶1 000)、兔抗人 TRAF-6单抗(1∶1 000)、兔抗人β-actin单抗(1∶ 3 000) ,4℃孵育过夜。TBST洗膜3次,每次10 min,将膜放入相应的辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000) ,室温孵育 1 h,TBST冲洗后,ECL法显色。Fusion凝胶成像系统扫描,并分析各阳性条带的吸光度值,设内参β-actin作为对照,目标蛋白的相对含量以目标蛋白/β-actin 比值来表示。
表1 RORγt、Foxp3、IL-2、TRAF-6、β-actin mRNA的引物序列
Tab.1 Primer sequences for RORγt,Foxp3,IL-2,TRAF-6,β-actin mRNA

PrimersSequencesbpRORγtF 5′GTGCTGGTTAGGATGTGCCG3′143R 5′GCAATCTCATCCTCGGAAAAGT3′Foxp3F 5′AGAAGGGCAGGGCACAATG3′151R 5′TCGGATGATGCCACAGATGAA3′IL-2F 5′GATGAACTTGGACCTCTGCGG3′184R 5′ATCTCCTCAGAAAGTCCACCACA3′TRAF-6F 5′GGATTCTACACTGGCAAACCCG3′137R 5′CCAAGGGAGGTGGCTGTCATA3′β-actinF 5′CCACGAAACTACCTTCAACTCC3′132R 5′GTGATCTCCTTCTGCATCCTGT3′
2 结果
2.1甲状腺功能和甲状腺自身抗体的表达水平 三组甲状腺功能和甲状腺自身抗体的表达水平见表2。
2.2三组RORγt、Foxp3、IL-2、TRAF-6的mRNA表达水平 与NC组相比,GD组中RORγt mRNA 的表达水平升高,差异具有统计学意义(P<0.05);与NC组相比,GD组中Foxp3和IL-2 mRNA表达水平降低,差异具有统计学意义(P<0.05);但RORγt、Foxp3、IL-2 mRNA表达水平在GD组和eGD组之间、eGD组和NC组之间差异均无统计学意义(P>0.05);GD组中TRAF-6 mRNA的表达水平与eGD组、NC组相比降低,差异均有统计学意义(P<0.05),但eGD组和NC组之间水平表达差异均无统计学意义(P>0.05),见图1。
2.3三组细胞因子IL-17A、IL-10、IL-2、TGF-β1的表达 GD组中IL-17A蛋白的表达水平较NC组增高,且差异有统计学意义(P<0.05);IL-10、IL-2和TGF-β1蛋白的表达水平较NC组降低,且差异有统计学意义(P<0.05);但这些差异在GD组和eGD组之间、eGD组和NC组之间均无统计学意义(P>0.05),见图2。
2.4PBMCs中p-Smad2/Smad3、TRAF-6蛋白的表达 GD组中p-Smad2/Smad3的蛋白表达水平均高于NC组,但差异无统计学意义(P>0.05),而GD组中TRAF-6蛋白的表达水平有一定的下降趋势,但差异无统计学意义(P>0.05);这些差异在GD组与eGD组之间、eGD组和NC组之间也均无统计学意义(P>0.05),见图3、4。
2.5相关性分析 GD组中,IL-2 mRNA与IL-17A蛋白之间的表达水平正相关(r=0.423,P=0.020),IL-2 mRNA分别与RORγt mRNA、Foxp3 mRNA、IL-10蛋白之间的表达水平均不相关(r=0.098,P=0.618;r=-0.177,P=0.351;r=-0.031,P=0.872)。IL-2蛋白分别与RORγt mRNA、IL-17A蛋白、Foxp3 mRNA、IL-10蛋白之间的表达水平均不相关(r=-0.122,P=0.535;r=-0.199,P=0.291;r=0.090,P=0.635;r=0.180,P=0.342)。GD组中p-Smad2蛋白与IL-2 mRNA之间的表达水平负相关(r=-0.631,P=0.000),p-Smad2蛋白与IL-2 蛋白之间的表达水平不相关(r=-0.217,P=0.249)。GD组中p-Smad3蛋白分别与IL-2 mRNA、IL-2蛋白之间的表达水平不相关(r=-0.250,P=0.183;r=-0.210,P=0.266)。GD组中,TRAF-6 mRNA分别与p-Smad2蛋白、p-Smad3蛋白之间的表达水平不相关(r=-0.275,P=0.141;r=-0.216,P=0.251)。TRAF-6 蛋白与p-Smad2蛋白之间表达水平正相关(r=0.382,P=0.037),TRAF-6蛋白与p-Smad3蛋白之间的表达水平不相关(r=0.108,P=0.570),见图5。
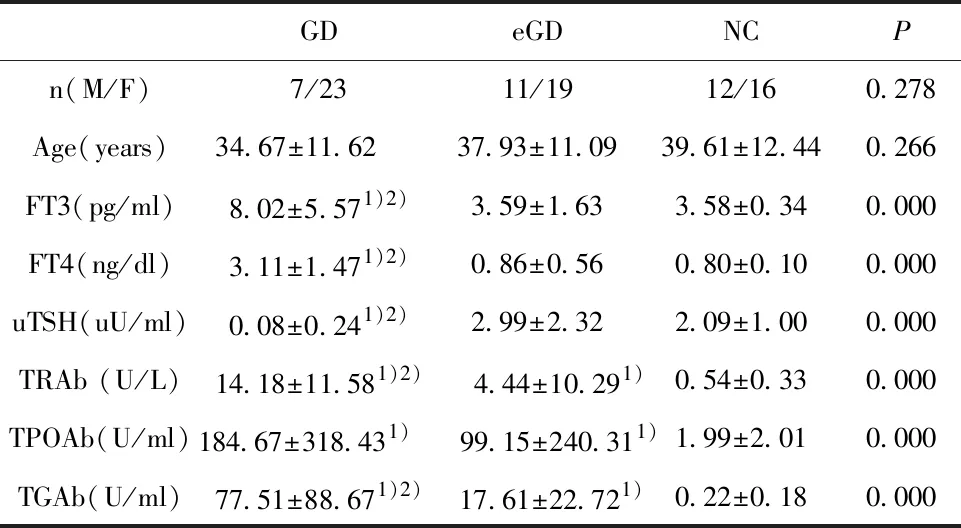
GDeGDNCPn(M/F)7/2311/1912/160.278Age(years)34.67±11.62 37.93±11.0939.61±12.440.266FT3(pg/ml)8.02±5.571)2)3.59±1.633.58±0.340.000FT4(ng/dl)3.11±1.471)2)0.86±0.560.80±0.100.000uTSH(uU/ml)0.08±0.241)2)2.99±2.322.09±1.000.000TRAb (U/L)14.18±11.581)2) 4.44±10.291)0.54±0.330.000TPOAb(U/ml)184.67±318.431) 99.15±240.311)1.99±2.010.000TGAb(U/ml)77.51±88.671)2) 17.61±22.721)0.22±0.180.000
Note:Compared with NC group,1)P<0.05;compared with eGD group,2)P<0.05.
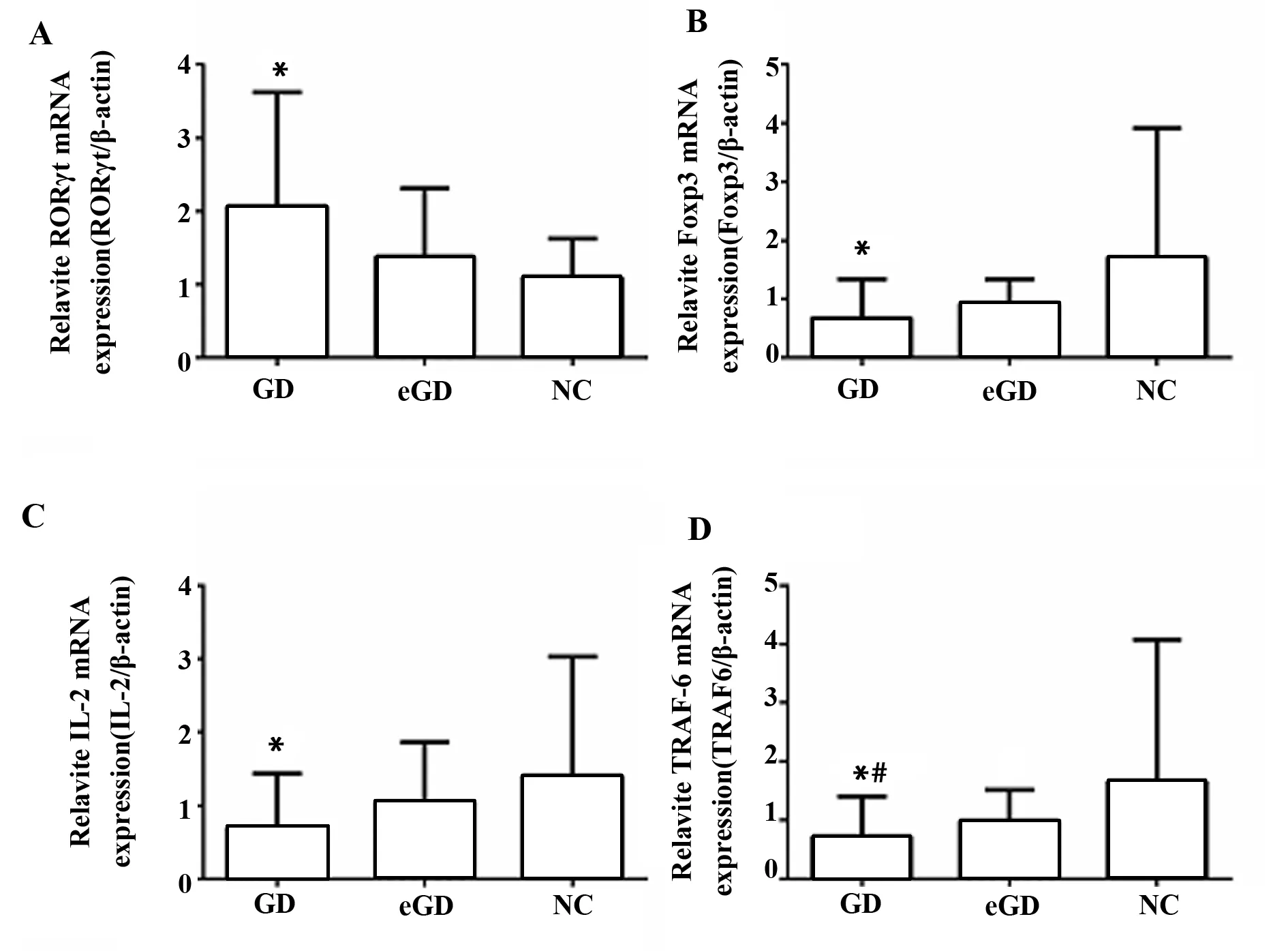
图1 三组RORγt、Foxp3、IL-2、TRAF-6 mRNA的表达水平Fig.1 mRNA expression of RORγt,Foxp3,IL-2 and TRAF-6 in three groupsNote: Compared with NC group,*.P<0.05;compared with eGD group,#.P<0.05.
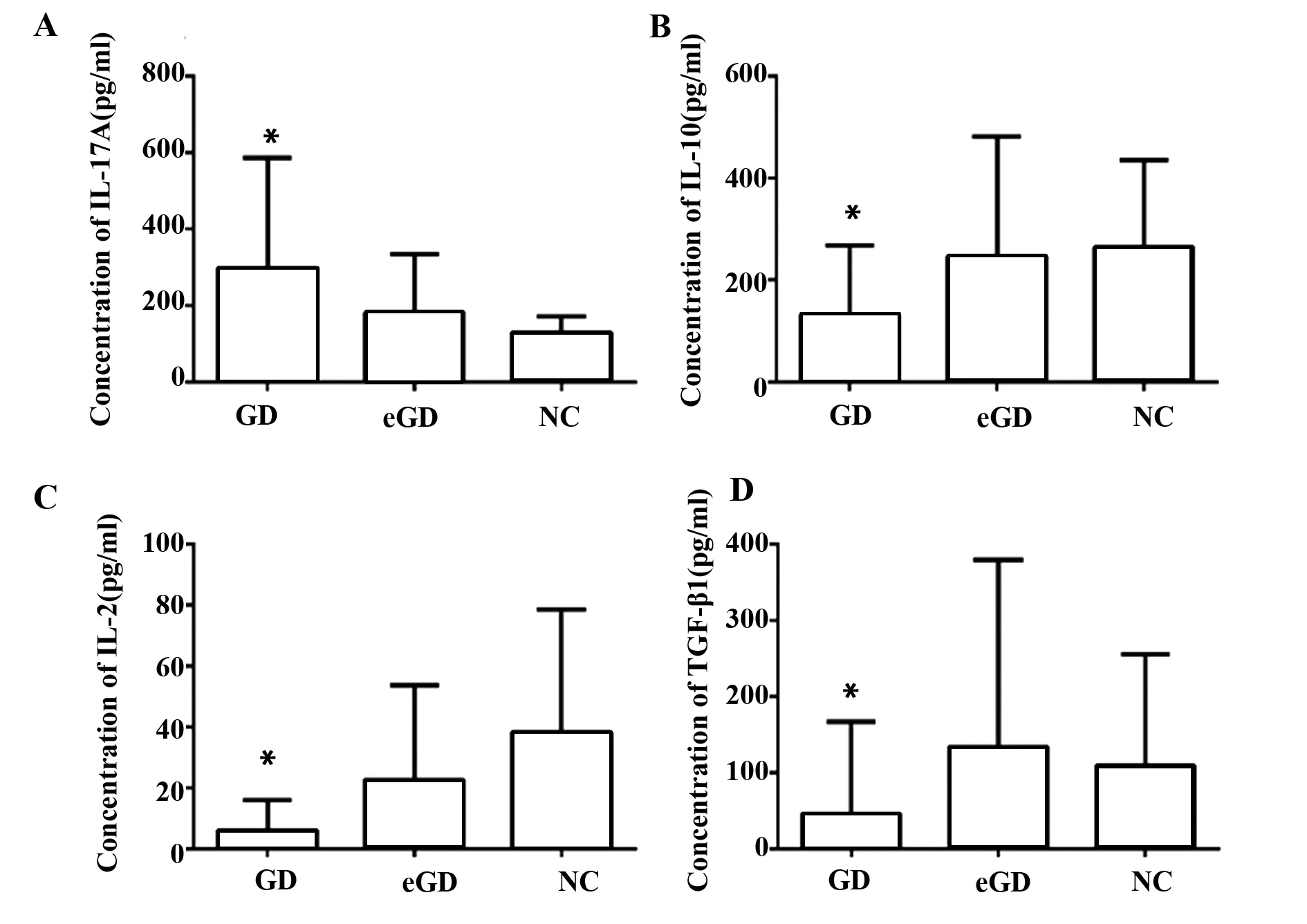
图2 三组细胞因子IL-17A、IL-10、IL-2、TGF-β1的表达水平Fig.2 Expression of IL-17A,IL-10,IL-2 and TGF-β1 in three groupsNote: Compared with NC group,*.P<0.05.
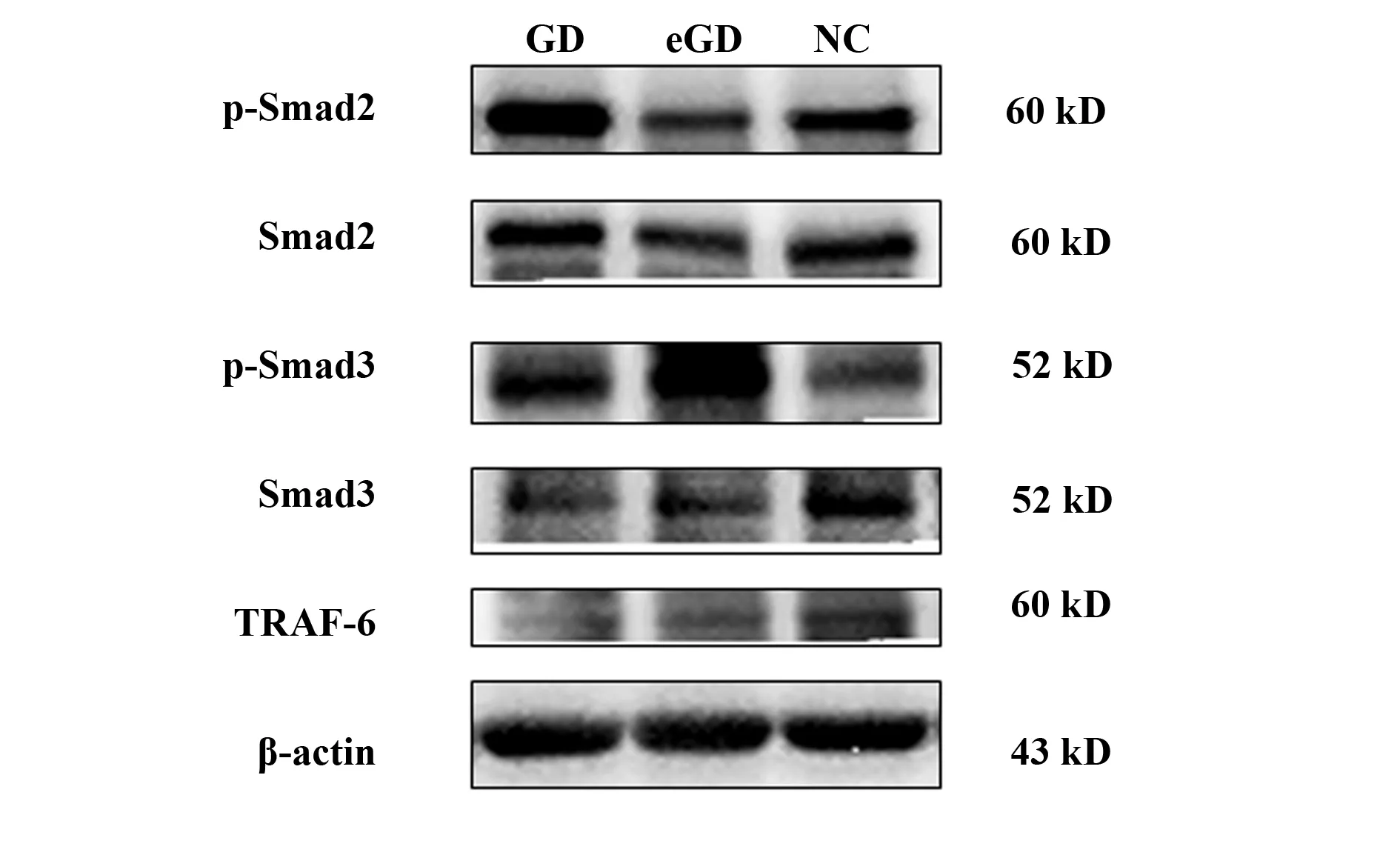
图3 三组中p-Smad2/Smad3、总Smad2/Smad3、TRAF-6蛋白的表达Fig.3 Protein expression of p-Smad2/Smad3,total Smad2/Smad3 and TRAF-6 detected by West-ern blot
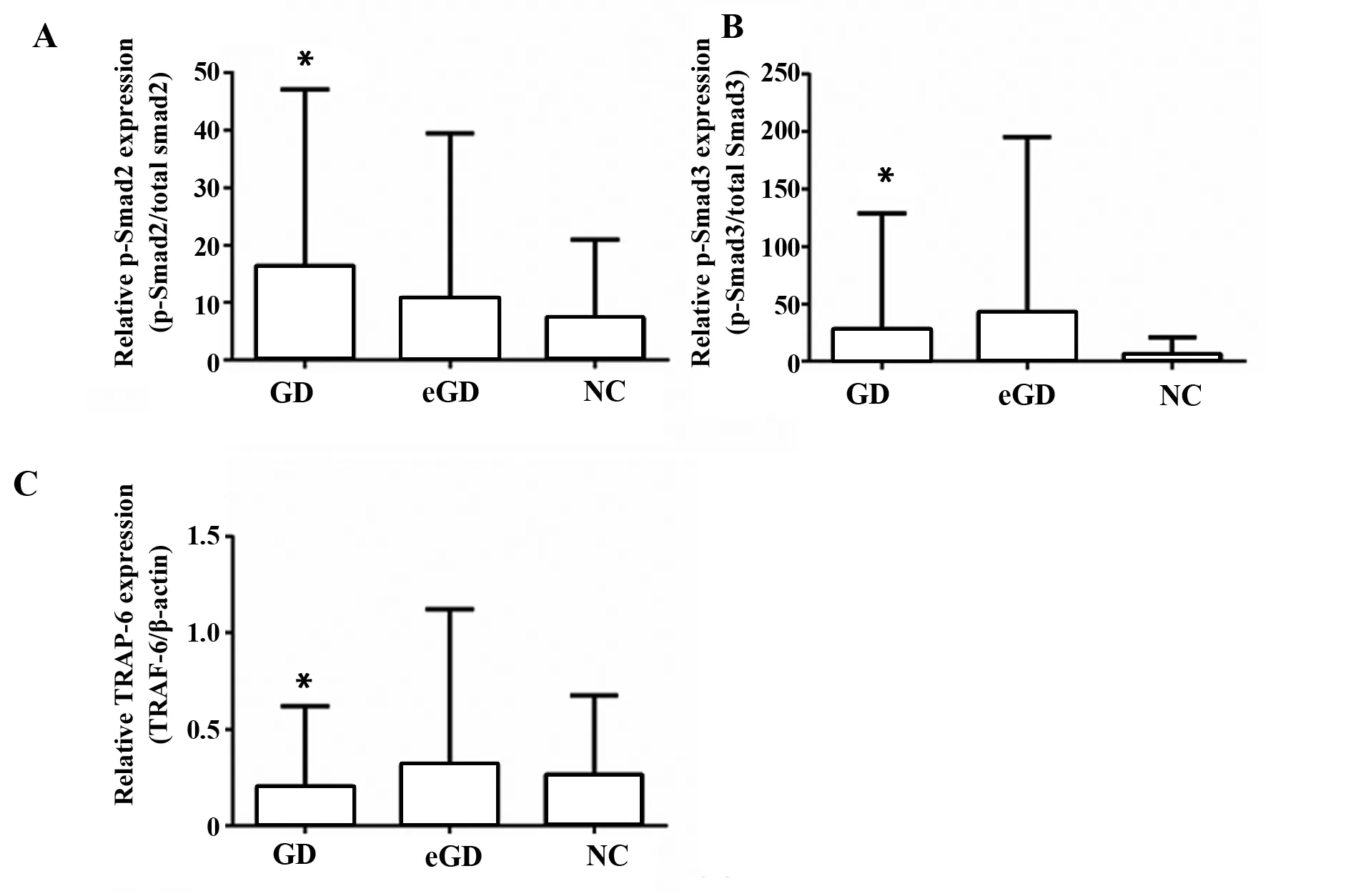
图4 定量分析p-Smad2/Smad3和TRAF-6蛋白在PBMCs中的表达Fig.4 Quantitative analysis of p-Smad2/Smad3 and TRAF-6 expression in PBMCsNote: Compared with NC group,*.P>0.05.

图5 GD患者相关指标的相关性分析Fig.5 Correlation between relevant indicators in Graves′ disease patientsNote: A-D.Correlation between IL-2 mRNA and RORγt mRNA,Foxp3 mRNA,IL-17A protein,IL-10 protein;E-H.Correlation between IL-2 protein and RORγt mRNA,Foxp3 mRNA,IL-17A protein,IL-10 protein;I-J.Correlation between p-Smad2 protein and IL-2 mRNA,IL-2 protein;K-L.Correlation between p-Smad3 protein and IL-2 mRNA,IL-2 protein;M-N.Correlation between TRAF-6 mRNA and p-Smad2 protein,p-Smad3 protein;O-P.Correlation between TRAF-6 protein and p-Smad2 protein,p-Smad3 protein.
3 讨论
GD的发病与效应性T细胞分化失衡有关,本研究旨在探讨效应T细胞分化失衡的上游免疫耐受调控机制。研究发现Th17细胞和Treg细胞均在GD的发生过程中发挥重要作用[2,8],在本实验中,GD组的RORγt mRNA和IL-17A蛋白的表达均较NC组增加。这与前期研究实验结果一致[2],提示Th17细胞的表达增加可能促进GD的发病。同时,GD组的Foxp3 mRNA和IL-10蛋白的表达均较NC组减少,提示Treg细胞的表达减少可能诱发GD的发生。这与杨渝等[25]的研究结果趋势一致。因此,Th17/Treg细胞平衡破环可能导致GD的发病。但调控Th17细胞、Treg细胞分化和功能的上游具体机制仍不完全清楚。
研究表明,IL-2作为分化信号作用于初始CD4+T细胞后,能通过STAT5信号通路抑制RORγt的表达和Th17细胞的分化,同时能促进Foxp3的表达和Treg细胞的分化[11-15,26],进而调控Th17/Treg细胞平衡。在本实验中,IL-2的mRNA和蛋白表达较NC组均减少,这与谢克俭等[27]的实验结果一致,提示IL-2的低表达可能促进GD的发病,但他们的研究仅探讨了IL-2表达降低与GD发生的关系,我们的研究探讨了IL-2通过调控Th17/Treg细胞分化平衡,进而参与GD的发病。以上研究结果充分说明了在GD的发生发展过程中,IL-2的低表达可能无法有效激活STAT5信号通路,导致RORγt 和Th17细胞的表达增加,分泌更多的IL-17效应炎症因子,同时抑制Foxp3和Treg细胞的表达,使免疫调节因子IL-10的表达减少,进而引起Th17/Treg细胞失衡。但是,如何导致IL-2的表达减少,进而引起Th17/Treg细胞失衡的免疫过程仍不清楚。
在本实验中,GD组的p-Smad2/Smad3蛋白表达较NC组虽然差异均没有统计学意义,但都展示出增加的趋势,这提示高表达的p-Smad2/Smad3蛋白可能导致GD的发生,而GD组与NC组之间蛋白表达的差异不具统计学意义,可能是由于GD中TGF-β1的表达减少,导致Smad2/Smad3磷酸化水平降低。GD组的TGF-β1表达较正常组更低,提示TGF-β1的异常表达可能参与GD的发生。这与王建国等[28]的实验结果一致,而与李红林等[29]的实验结果趋势相反。这可能由于本研究和李红林的实验所选实验对象群体不一致,或患者所处疾病发展阶段不一致。而GD组中TGF-β1的表达降低,可能是由于在GD的发生过程中,机体为维持免疫平衡进行自我调节,通过降低TGF-β1的表达来减少TGF-β1-p-Smad2/3途径诱导的Th17细胞分化。同时,GD组中TRAF-6的mRNA表达较NC组降低,差异有统计学意义,而GD组中的TRAF-6的蛋白表达较NC组有下降的趋势,但差异无统计学意义,这与前期研究结果趋势一致[23],提示低表达的TRAF-6可能促发GD。
在对GD组的数据进行相关性分析时,我们发现,p-Smad2蛋白与IL-2 mRNA之间的表达水平负相关,提示p-Smad2对IL-2表达的调控可能在GD的发生过程中发挥作用;然而其余相关性分析结果与本研究假设不相符,可能是由于本研究收集的样本量太少,这提示要深入探讨在GD的发生过程中,TRAF-6通过影响TGF-β1介导的Smad2/Smad3蛋白磷酸化,维持IL-2对Th17/Treg细胞平衡的调控作用,我们需要大量的样本进行验证。综上所述,GD患者中TRAF-6的低表达,可能不足以抑制TGF-β1介导的Smad2/3磷酸化,导致增多的Smad2/3磷酸化蛋白下调IL-2表达,进而诱导Th17细胞的分化,同时抑制Treg细胞的分化,使得机体不能维持免疫耐受,促进GD的发生。
然而,TRAF-6抑制TGF-β1介导的Smad2/Smad3磷酸化过程的具体途径目前尚无报道。研究发现,CD4+T细胞中,TGF-β通过跨膜丝氨酸(Ser)/苏氨酸(Thr)激酶受体家族转导信号,该家族主要通过Ⅰ型(TβRⅠ)、Ⅱ(TβRⅡ)型受体传导信号[30]。TGF-β先结合至TβRⅡ的胞外端,其胞内段的Ser/Thr激酶被活化,使 TβRⅠ因甘氨酸(Gly)-Ser-Gly-Ser-Gly-Ser结构域磷酸化而活化[31],磷酸化的TβRⅠ引起下游转录因子Smad2和Smad3的磷酸化,而磷酸化的Smad2和Smad3与Smad4协同将信号转导至细胞核[32-34],进而调控下游基因,包括IL-2的转录。因此,TRAF-6可能抑制TGF-β1结合至TβRⅡ的胞外端、阻碍胞内段的 Ser/Thr 激酶活化、抑制TβRⅠ的活化、阻碍磷酸化的TβRⅠ对Smad2和Smad3进化磷酸化,进而减少TGF-β1介导的Smad2/Smad3的磷酸化。然而,TRAF-6抑制TGF-β1介导的Smad2/Smad3的磷酸化过程的具体途径有待进一步探究。本实验结果显示的三组间甲状腺功能和甲状腺自身抗体水平变化,可能是由于eGD病人经过药物治疗后免疫炎症状态有所缓解,但还未达到正常人水平,也提示TRAF-6调控TGF-β1介导的Smad2/3磷酸化,进而调控Th17/Treg细胞平衡的机制在GD的发病过程中与免疫状态有关,而不依赖于甲状腺。
本研究探讨了GD中TRAF-6的免疫耐受作用及其可能的具体作用机制,为效应T细胞失衡的上游机制提供了新角度和新靶点,同时提供了GD免疫发病机制的新方向和针对GD发病机制的诊断与治疗的新靶点。