HIV抗体无创(口腔黏膜渗出液及尿液)检测试剂与有创(血液)检测试剂的性能比较
2019-06-04陈晓茹
叶 黎,陈晓茹,苏 玲,梁 姝,杨 洪,袁 丹,杨 文△
(1.四川省疾病预防控制中心,四川成都 610041;2.凉山州疾病预防控制中心,四川西昌 615000)
截至2017年11月30日全国报告现存活人类免疫缺陷病毒(HIV)感染者/获得性免疫缺陷综合征(AIDS)患者754 852例[1]。而地处川滇黔交界处的四川省凉山彝族自治州(简称凉山州)是我国AIDS的高流行区之一[2]。截至2015年12月凉山州累计报告的HIV/AIDS共计38 568例,居四川省第1位[3]。凉山州彝族地区艾滋病防治形势日益严峻,扩大HIV抗体的筛查是早发现、早治疗的基础,对控制艾滋病的传播和流行具有至关重要的作用。目前,检测HIV抗体最常用的方法是对血液样本进行初筛检测,再进行补充实验加以确认。但常规方法均需采集血液,为有创采样。部分高危人群或地处偏远山区的人群对有创采血接受度较低。在一定程度上影响了这类人群的检测意愿,不利于扩大检测范围。因此,理想的HIV检测方法应具有无损伤性、安全性、灵敏性等特点。有研究表明,HIV感染者尿液、唾液、精液、泪液均含有HIV抗体[4-6];口腔黏膜渗出液、尿液较易采集且采集过程无创,因此,HIV无创检测试剂的上市为扩大检测范围提供了新的选择[7-8]。《全国艾滋病检测技术规范》(2015年修订版)也将口腔黏膜渗出液及尿液作为了新的HIV检测样品种类。2017年中国疾病预防控制中心发布的全国HIV抗体诊断试剂临床质量评估报告显示,2015-2017年丽珠HIV抗体酶联免疫试剂的灵敏度均为100.00%、特异度为98.61%~100.00%[9]。因此,本研究将以丽珠HIV抗体酶联免疫试剂作为对比试剂,评估目前市面上常用的1种检测原理为免疫层析法的口腔黏膜渗出液试剂A、1种检测原理为免疫渗滤法口腔黏膜渗出液试剂B和1种检测原理为酶联免疫法尿液HIV抗体检测试剂C的检测性能,旨在为无创检测在HIV1/2抗体筛查中的推广应用提供依据。
1 资料与方法
1.1研究对象 2017年10月至2018年3月招募凉山州布拖县年龄6~65岁的HIV感染者100例,未知感染状态的体检者200例。不包括经期妇女。
1.2仪器与试剂
1.2.1评价试剂A HIV 1/2口腔黏膜渗出液检测试剂(免疫层析法),广州万孚生物技术有限公司生产,试剂批号:W06370730,有效期:2019-7-10。
1.2.2评价试剂B 口腔黏膜渗出液HIV1+2型抗体检测试剂(免疫渗滤法),北京万泰生物药业股份有限公司生产,试剂批号:ID20170602,有效期:2018-05。
1.2.3评价试剂C HIVⅠ型尿液抗体检测试剂(酶联免疫法),北京君禾药业有限公司生产,有效期:2018-5-14。
1.2.4对比试剂 HIV抗体酶联免疫检测试剂盒,珠海丽珠试剂股份有限公司生产,试剂批号:2018030812,有效期:20190313。
1.2.5确证试剂 HIV 1+2型抗体检测试剂盒(免疫印迹法),上海英旻泰生物技术有限公司生产,试剂批号:IMT 1612001,有效期:2018-12-07。
1.2.6仪器 酶标仪、洗板机、37 ℃孵箱、全自动免疫印迹仪、普通冰箱等。
1.3方法
1.3.1口腔黏膜渗出液样本的采集 医务人员在100例HIV感染者中随机选择55例采集,45例为医务人员指导受检者采集。
1.3.1.1口腔黏膜渗出液样本A 从评价试剂A包装中取出口腔取样器,用取样器的采样端沿受试者上、下齿龈轻轻来回擦拭,用时5~6 s。再翻转取样器,沿受试者上、下齿龈轻轻来回擦拭,用时5~6 s。将口腔取样器插入装有样本处理液的样本提取管内,紧贴提取管壁,上、下刮擦6~8次。从提取管中取出口腔取样器,完成取样。采集完成的样本于2~8 ℃保存待检。
1.3.1.2口腔黏膜渗出液样本B 从评价试剂B铝箔袋中取出无菌采集器,将采集器海绵端置于受检者舌下5 min,待海绵软化后将海绵在牙龈外周来回擦拭1~2 min。将采集器海绵端置挤压装置内,用力垂直挤压采集器手柄,并将挤出的液体收集于样品管中,完成取样。采集完成的样本于2~8 ℃保存待检。
1.3.2尿液标本C的采集 采集受检者清洁中段尿2~5 mL于一次性清洁尿杯内,检测人员使用无菌吸管吸取1.5 mL尿液至冻存管中,于2~8 ℃保存待检。
1.3.3血液标本的采集 采集受检者乙二胺四乙酸抗凝全血6~10 mL,轻轻颠倒混匀6~8次。于6 h内1 500 r/min离心15 min取上层血浆,于2~8 ℃保存待检。
1.3.4样本检测 口腔黏膜渗出液标本于采样完成后12 h内完成检测,血液、尿液标本于采样完成后1周内进行检测,所有样本的检测均严格按试剂盒说明书操作。尿液HIV-1抗体临界值为0.25,光密度(OD)值大于或等于0.25为阳性(+),<0.25为阴性(-)。血液标本使用丽珠酶联免疫法进行初筛,初筛阳性按检测技术规范进行复检,复检阳性者使用IMT HIV抗体确证检测试剂确认其感染状况。将3种评价试剂检测结果与对比试剂进行比较。
1.4统计学处理 采用SPSS17.0统计软件对数据进行分析,计数资料以率(%)表示,采用χ2检验;2种方法一致性比较用Kappa检验。根据边缘概率的计算,κ=-1~1。≥0.8 为二者具有高度一致性,0.8~0.4为二者具有中度一致性,<0.4为二者不一致。比较评价试剂与对比试剂的受试者工作特征(ROC)曲线下面积,检测其检验效能。对样本成功采样的定义为受检者愿意接受标本采集,且能收集到符合试剂盒说明书要求的样本量。采样成功率=成功采样数/采样人数。
2 结 果
2.1采样成功率分析 按试剂盒说明书的采样要求,不同样本采样成功率见表1。所有受试者均接受尿液和口腔黏膜渗出液的采集。尿液样本采集成功率为100.00%。口腔黏膜渗出液采集,按评价试剂A的采样要求,采集成功率为99.00%,失败的3例样本原因为语言沟通不畅,样本缺失;但按评价试剂B的采样要求,采集成功率仅为81.00%,失败原因均为未收集到试剂盒说明书要求的样本量。有6.00%的受试者(18/300)拒绝采集其血液样本。评价试剂A使用医务人员采样方式和医务人员指导受检者采样方式的采样成功率均为100%(45/45、55/55)。评价试剂B使用医务人员采样方式的采样成功率[96.36%(53/55)]高于医务人员指导受检者采样方式的采样成功率[86.67%(39/45)],但差异无统计学意义(χ2=3.162,P>0.05)。
2.2评价试剂A、B与对比试剂检测结果比较 评价试剂A与对比试剂均有结果者280份,其中110份血液样本对比试剂初筛阳性,后经IMT确认试剂确认均为阳性。评价试剂A的阳性符合率为98.21%[95%可信区间(95%CI):93.06~99.69],阴性符合率为98.81%(95%CI:95.32~99.79),总符合率为98.57%(95%CI:96.13~99.54)。评价试剂A与对比试剂一致性较好(κ=0.970)。评价试剂B与对比试剂均有结果者233份,其中89份血液样本对比试剂阳性,经IMT确认试剂确认均为阳性。评价试剂B的阳性符合率为90.82%(95%CI:82.84~95.45),阴性符合率为96.24%(95%CI:91.00~98.61),总符合率为93.94%(95%CI:89.82~96.52),阳性预测值为94.68%(95%CI:87.45~98.03),阴性预测值为93.43%(95%CI:87.53~96.76)。评价试剂B与对比试剂一致性较好(κ=0.875)。见表2。
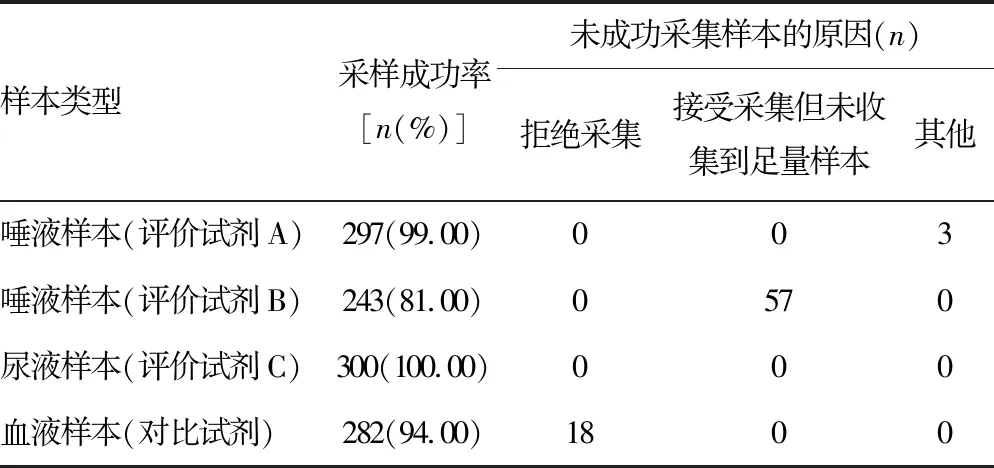
表1 4种样本采集情况比较(n=300)

表2 评价试剂A、B与对比试剂检测结果比较
2.3评价试剂C与对比试剂检测结果比较 评价试剂C与对比试剂均有结果者282份,其中112份血液样本参考试剂阳性,经IMT确认试剂确认均为阳性。评价试剂C的阳性符合率为97.32%(95%CI:91.79~99.31),阴性符合率为95.29%(95%CI:90.61~97.80),总符合率为96.10%(95%CI:92.93~97.94),阳性预测值为93.16%(95%CI:86.55~96.79),阴性预测值为98.18%[(95%CI:94.36~99.53)]。评价试剂C与对比试剂一致性较好(κ=0.919)。见表3。8例假阳性样本中OD值为0.250~0.500 6例。3例假阴性标本的OD值分别为0.090、0.060、0.135。见表4。
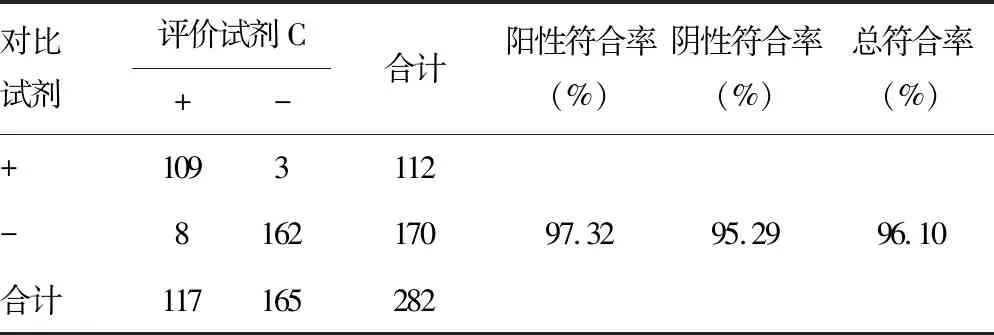
表3 评价试剂C与对比试剂检测结果比较
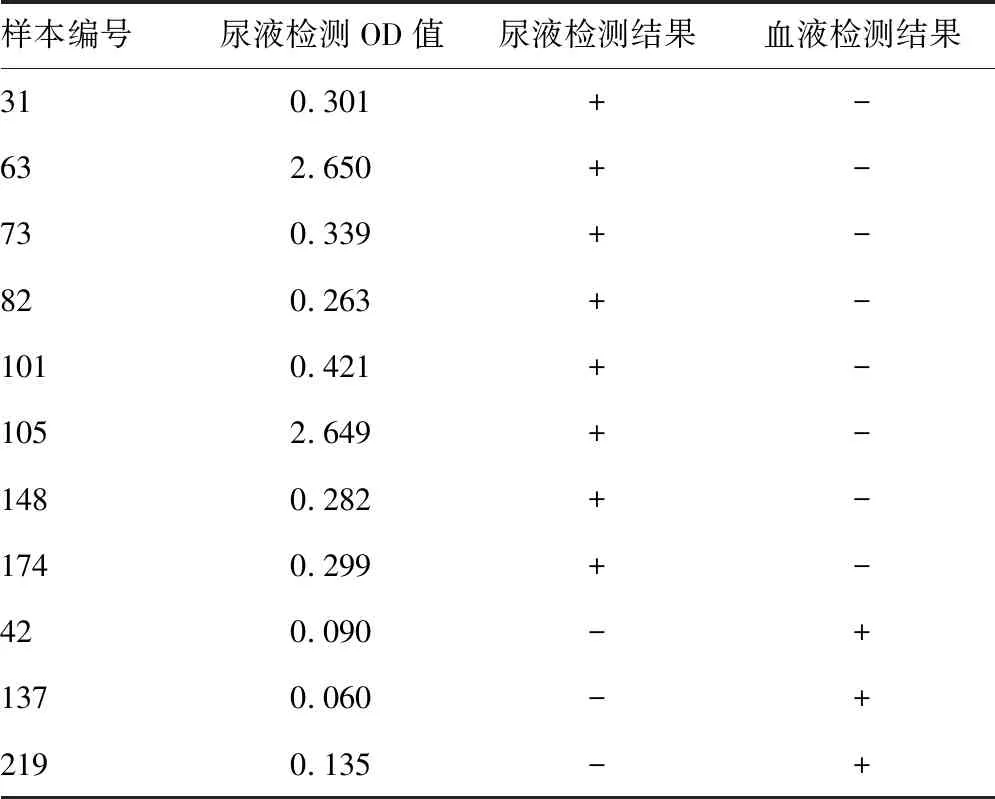
表4 11份尿液和血液标本检测结果不符合标本结果比较
2.4评价试剂检测HIV抗体的ROC曲线比较 评价试剂A、B、C检测HIV抗体的ROC曲线下面积分别为0.991、0.935、0.975(95%CI:0.977~1.000、0.897~0.973、0.951~0.998)。见图 1。提示3种无创检测试剂检测HIV抗体的准确性均较高。
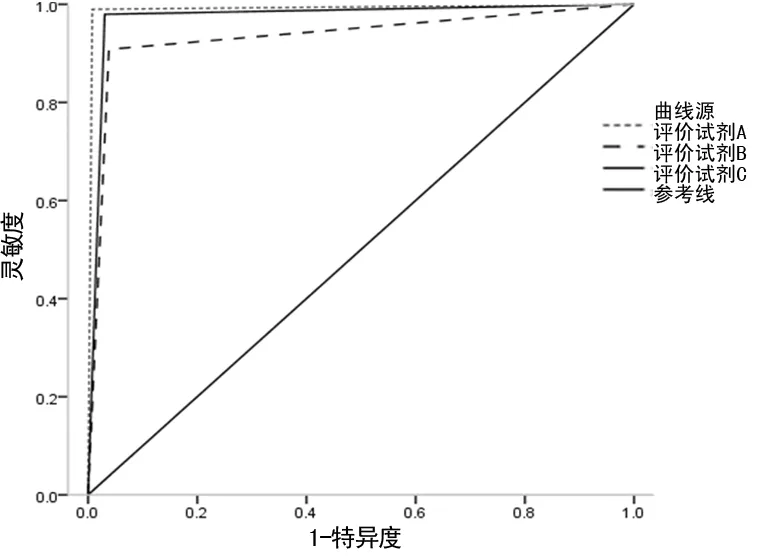
图1 评价试剂A、B、C检测HIV抗体的ROC曲线
3 讨 论
本研究招募的自愿接受检测服务的300例参试者均同意自行或由医务人员进行口腔黏膜渗出液及尿液的采集;但有6.00%(18/300)的参试者拒绝采集其血液进行检测。据文献报道,部分彝族群众对采血有恐惧心理,易造成晕针、晕血,甚至由此引发群体事件[10]。无创样本采集方式可接受度更高。
本研究结果显示,不同的无创检测样本采集的成功率有差异,尿液(自行采集)采集成功率为100.00%,口腔黏膜渗出液评价试剂B的采样成功率相对较低,为81.00%,分析原因可能为:(1)样本要求较高,受检者在口干的状态下无法成功采集。(2)评价试剂B的采样步骤相对于其他试剂稍显复杂,受检者需先将采集器的海绵端在舌下含软(约需5 min以上时间),再擦拭牙龈外周,用时稍长,部分受检者不能掌握正确的采样方式。口腔黏膜渗出液评价试剂A采样成功率较高,为99.00%,因其采集要求相对简单,需受检者配合的部分较少。另外,使用医务人员采样方式和医务人员指导受检者自行采样方式的口腔黏膜渗出液的采样成功率比较,差异无统计学意义(P>0.05)。说明经简单培训后受检者即可正确掌握无创检测样本的采样方式,提示为扩大HIV检测覆盖面,可推广无创检测或无创自检的检测模式。
据文献报道,口腔黏膜渗出液中免疫球蛋白G抗体浓度约相当于血清中的1/20[11];对口腔黏膜渗出液检测试剂的灵敏度提出了较高要求。本研究结果显示,口腔黏膜渗出液评价试剂A阳性符合率、阴性符合率均高于评价试剂B,是否由于2种试剂的采样方式和检测原理不同而导致的差异,目前尚无相关文献报道。
口腔黏膜渗出液中可能含有的其他物质如病毒、细菌、胆红素等,以及吸烟、服药、牙周炎等因素均可能导致出现假阳性或假阴性[12];一些经抗病毒治疗,病毒载量减少者也有可能出现漏检。本研究使用的尿液试剂C与对比试剂的符合率较高,进一步对尿液检测OD值分析发现,8例假阳性样本中中OD值为0.250~0.500 6例,提示OD值在0.50以下可能为尿液检测的灰区[13]。对处于灰区范围的样本重复采样检测或采集血液进行检测可大大提高检测准确性。
在HIV感染者的尿液检测结果中,219号样本的OD值为0.135,有可能该样本为非受检者本人的。因尿液标本的采集具有一定的隐私性,在样本采集过程中发现,个别受检者使用水代替尿液标本,所以,不排除个别受检者使用他人的样本代替本人样本。
尿液HIV抗体的检测受患者体内抗体和病毒载量水平高低的影响,当处于HIV感染的早期阶段或艾滋病终末期则抗体水平较低或经抗病毒治疗患者血中病毒载量水平较低,相应地尿中抗体含量较低,可能导致假阴性结果的出现。另外,尿液中成分复杂,细胞、蛋白质、盐类等,这些因素是否会导致检测结果出现假阳性或假阴性尚需进一步的研究。
4 结 论
传统的血液检测方法由于需有创采集样本,不但增加了医务人员职业暴露的风险,同时也降低了高危人群和害怕采血人群的检测意愿。本研究评价的3种HIV抗体无创检测试剂与有创试剂比较,具有较好的一致性,符合率较高。因此,无创检测试剂作为一种初筛检测试剂,对医疗条件有限、采血困难的儿童、肥胖者、静脉萎缩者等,以及具有特殊风俗习惯的少数民族地区将能极大地提高人群筛查率,为AIDS的预防和控制提供了新的检测途径。
