FBXO22对乳腺癌细胞侵袭迁移能力的影响
2019-06-04方虹舒
方虹舒,张 薇
(重庆市第四人民医院检验科,重庆 400014)
有研究表明,绝大多数的乳腺癌相关死亡是由于发生远端转移而不是原发肿瘤[1]。恶性乳腺癌的进展是一个高度复杂的过程,主要涉及肿瘤生长和侵袭后转移性传播到远端的器官[2]。为提高临床疗效,迫切需要确定控制乳腺癌转移进展的决定性分子因素和抗转移治疗的新靶点。泛素-蛋白酶体系统通过三步级联酶调控泛素依赖性蛋白水解,涉及泛素激活酶(E1)、泛素偶联酶(E2)和泛素连接酶(E3)[3]。真核生物E3中最大的家族是SKP1-Cullin-F-box蛋白(SCF)E3连接酶复合体[4]。其中F-box蛋白家族是其主要部分,通过蛋白-蛋白互作基序与底物结合,确定底物特异性[5-6]。迄今为止,绝大多数F-box蛋白的生物学功能和生理底物仍未明确。现有研究表明,FBXO22通过介导泛素依赖性降解肿瘤抑制因子——KLF4,从而促进肝细胞癌的进展[7]。最新研究表明,FBXO22基因沉默后能降低结肠癌细胞的侵袭迁移能力。然而,FBXO22对乳腺癌细胞的侵袭迁移能力及其相关分子机制尚不清楚。本研究探究了FBXO22基因沉默后对乳腺癌细胞侵袭迁移能力的影响,并初步探究了其相关分子机制。
1 材料与方法
1.1材料 乳腺癌MDA-MB-231细胞株由重庆医科大学基础医学院提供,杜氏改良Eagle培养基(DMEM)及胎牛血清购自Hylcone公司(美国),胰酶及Transwell小室购自Millipore公司(美国),磷酸盐缓冲液(PBS)购自武汉博士德公司,小干扰RNA(siRNA)-FBXO22(FBXO22-siRNA组)及对照siRNA(Control-siRNA组)购自上海吉玛公司,Lipofectamine 2000转染试剂购自Thermo Fisher公司(美国),FBXO22、E-cadherin、波形蛋白(Vimentin)、基质金属蛋白酶(MMP)-2和MMP-9购自CST公司(美国)。
1.2方法
1.2.1细胞培养 乳腺癌MDA-MB-231细胞培养于含10%胎牛血清的DMEM中,置于5%二氧化碳(CO2)、37 ℃恒温培养箱中培养。
1.2.2细胞转染 转染前取对数生长期的MDA-MB-231细胞接种于6孔板中,并于5% CO2、37 ℃恒温培养箱中培养至细胞密度为60%~70%。按Lipofectamine 2000转染试剂说明书进行转染,参照说明书分别用培养基将siRNA(FBXO22-siRNA组)和Lipofectamine 2000试剂(Control-siRNA组)稀释后在室温下孵育5 min,然后将二者轻轻混合,在室温下孵育20 min。将复合物加入到每个包含细胞和培养基的孔中。37℃、CO2培养箱孵育24~96 h。采用蛋白质印迹(Western blot)法检测转染效率。并在后续实验中将细胞分为只有试剂对照的对照组(Control),转染对照,siRNA的Control-siRNA组以及转染FBXO22的FBXO22-siRNA组。
1.2.3细胞划痕实验 将转染后的MDA-MB-231细胞用胰酶消化,以5×105个/孔接种到6孔板中。24 h后用枪头进行划线,用PBS清洗3次,去除划下的细胞后加入无血清培养基。放入37 ℃、CO2培养箱中共培养48 h后取出拍照。
1.2.4Transwell迁移实验 将转染后的MDA-MB-231细胞用胰酶消化,用DMEM制成单细胞悬液,以5×104个/孔接种于Transwell上室内。Transwell下室内加入含10%胎牛血清的DMEM。37℃、CO2培养箱中共培养20 h后取出Transwell小室,弃上室培养液,用棉签擦去上室内未迁移的细胞。然后用95%乙醇固定膜下表面细胞,取下Transwell小室膜,经结晶紫染色后置于载玻片上封片。在光镜(100×)下观察迁移细胞数,随机选取5个视野计数,计算平均迁移细胞数。
1.2.5Western blot 收集转染48 h后的MDA-MB-231细胞,提取总蛋白并采用BCA法测定蛋白浓度。在恒压条件下采用十二烷基硫酸钠-聚丙稀酰胺凝胶电泳法电泳分离蛋白,然后在恒流条件下将蛋白转印到PVDF 膜上,用10%脱脂奶粉封闭4 h后加入一抗4 ℃孵育过夜,用TBST洗涤3次后加入二抗37 ℃孵育2 h,用TBST洗涤3次后采用ECL 化学发光法显影,采集图像。
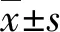
2 结 果
2.1细胞转染效率检测 FBXO22-siRNA组MDA-MB-231细胞中FBXO22蛋白表达水平明显低于Control-siRNA组,差异有统计学意义(P<0.05)。见图1。表明FBXO22-siRNA下调了乳腺癌MDA-MB-231细胞中FBXO22的蛋白表达水平。
注:与Control-siRNA组比较,*P<0.05
图1转染后乳腺癌细胞中FBXO22表达水平
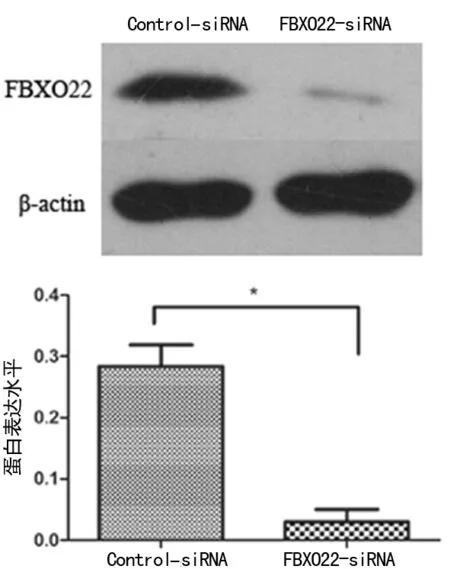
2.2下调FBXO22蛋白表达水平对乳腺癌细胞侵袭能力的影响 FBXO22-siRNA组MDA-MB-231细胞中发生侵袭转移者明显低于Control-siRNA组及对照组(Control)。见图2。表明FBXO22蛋白表达下调后乳腺癌细胞MDA-MB-231侵袭能力明显减弱。

图2 下调FBXO22对乳腺癌细胞侵袭能力的影响
2.3下调FBXO22蛋白表达水平对乳腺癌细胞迁移能力的影响 与Control-siRNA组及对照组比较,FBXO22-siRNA组MDA-MB-231细胞中穿过transwell小室膜的数目明显减少,差异均有统计学意义(P<0.05)。见图3。表明FBXO22蛋白表达下调后乳腺癌细胞MDA-MB-231的迁移能力明显降低。
注:A表示对照组(Control);B表示Control-siRNA组;C表示FBXO22-siRNA组;与Control-siRNA组及对照组比较,*P<0.05
图3下调FBXO22对乳腺癌细胞迁移能力的影响
2.4下调FBXO22蛋白表达水平对乳腺癌细胞侵袭迁移相关蛋白水平的影响 FBXO22蛋白表达水平下调后MDA-MB-231细胞中E-cadherin表达水平升高, Vimentin表达水平降低,与细胞侵袭迁移能力相关的MMP-2、MMP-9蛋白水平下降,差异均有统计学意义(P<0.05)。见图4。表明下调FBXO22基因能引起上皮细胞-间充质转化(EMT)进程相关蛋白——E-cadherin和Vimentin表达发生改变,以及侵袭迁移相关蛋白——MMP-2和MMP-9水平下降。
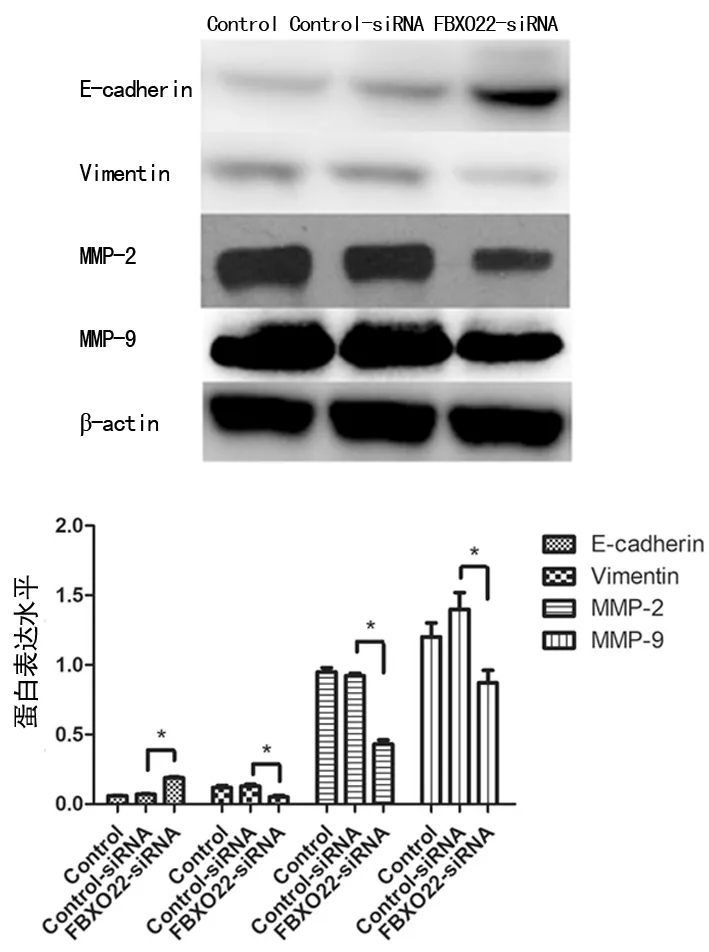
注:*P<0.05
图4下调FBXO22对乳腺癌细胞侵袭迁移相关蛋白的影响
3 讨 论
F-box蛋白是介导磷酸化依赖性泛素的SCF泛素蛋白连接酶复合物的4个亚基之一[8]。F-box蛋白分为3类:含有WD-40结构域的Fbws,含有富含亮氨酸重复序列的Fbls,以及含有不同蛋白-蛋白相互作用模块或无识别基序的Fbxs[9]。FBXO22蛋白属Fbxs类,作为肿瘤蛋白p53的转录靶点,被认为参与了p53诱导后特异性蛋白的降解[10]。FBXO22能通过调控p21 的泛素化水平而影响其降解进而促进肝癌的进展[11]。此外,在肾细胞癌中FBXO22能通过抑制MMP-9介导的迁移侵袭及血管内皮生长因子(VEGF)介导的血管生成从而阻止其远端转移的发生[12]。
FBXO22第一次被认识是作为一种针对甲基化p53进行降解的衰老相关E3连接酶,而后有研究表明,FBXO22通过针对赖氨酸特异性去甲基化酶4A和p53的蛋白酶体降解分别调节组蛋白甲基化标记和衰老[13-14]。此外,FBXO22能通过介导泛素依赖性降解肿瘤抑制因子——KLF4促进肝细胞癌进展。有研究表明,FBXO22基因沉默后能降低结肠癌细胞的侵袭迁移能力。在黑色素瘤细胞中下调FBXO22能引起HIF-1α/VEGF通路下调从而抑制其迁移侵袭及血管生成能力[15]。本研究通过Transwell小室细胞迁移实验证明了FBXO22基因的表达下调后乳腺癌MDA-MB-231细胞的迁移能力明显下降。此外,细胞划痕实验结果表明,FBXO22蛋白表达下调后乳腺癌MDA-MB-231细胞的侵袭能力明显减弱。表明下调FBXO22能使乳腺癌MDA-MB-231细胞迁移侵袭能力减弱。
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。在慢性炎症、胚胎发育、癌症转移、组织重建及多种纤维化疾病中均具有重要作用[16]。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移侵袭、抗凋亡和降解细胞外基质(ECM)的能力等间质表型[17]。EMT是上皮细胞来源的恶性肿瘤细胞获得迁移侵袭能力的重要生物学过程[18]。有研究表明,间充质干细胞与乳腺癌细胞之间的相互作用可能影响肿瘤的发生、生长和转移[19-20]。在体外脂肪源性间充质干细胞与乳腺癌细胞MCF-7共培养能引起共培养的MCF-7细胞迁移侵袭能力增强,且EMT呈时间依赖性变化[21]。还有研究表明,敲除乳腺癌MDA-MB-231细胞中长链非编码RNA LincK能通过抑制EMT从而使其在裸鼠中肺转移水平明显下降[22]。本研究结果显示,下调FBXO22基因的表达水平能引起MDA-MB-231细胞中E-cadherin表达水平上升,Vimentin表达水平下降。而EMT的主要特征是上皮标记物(如E-cadherin)的丢失,同时,间充质标记物如Vimentin表达增加[23]。下调FBXO22基因表达使乳腺癌MDA-MB-231细胞的上皮标记物水平增高,同时,降低了间充质标记物水平。表明FBXO22基因表达下调能抑制乳腺癌MDA-MB-231细胞的EMT进程。
MMP是一种钙依赖性含锌内源性肽酶,可降解各种ECM蛋白[24-25]。MMP在癌症进展中的主要意义之一是其在ECM降解中的作用,MMP-2与MMP-9一起能降解基底膜中最丰富的成分即Ⅳ型胶原,ECM降解可使癌细胞从原发肿瘤中转移出来形成转移灶[26-28]。有研究表明,乳腺癌MDA-MB-231细胞中MMP-2、MMP-9高表达,且在其侵袭及远端转移过程中具有关键作用[29]。此外,MMP-2与其他MMP已被证明可酶解激活转化生长因子β(TGF-β)从而促进EMT进程,进而引发癌症转移[30]。本研究结果显示,下调FBXO22基因后乳腺癌MDA-MB-231细胞中MMP-2、MMP-9表达下降,表明FBXO22基因的表达下调引起乳腺癌MDA-MB-231细胞迁移侵袭能力下降的可能机制为MMP-2、MMP-9水平下降。
4 结 论
下调FBXO22基因水平能抑制乳腺癌MDA-MB-231细胞的迁移侵袭能力,其可能的机制为FBXO22基因表达下调抑制了MDA-MB-231细胞EMT进程,并使细胞转移相关重要蛋白--MMP-2、MMP-9表达减少。
