抗酸染色室间质量评价质控片的标准化制备及评价
2019-06-04王淑玲徐兰兰
张 震,郭 攀,王淑玲,颜 令,徐兰兰,廖 璞△
(1.重庆市人民医院检验科,重庆 400014;2.内江市第二人民医院检验科,四川内江 641000)
WHO宣布控制结核病最佳策略中重要的一步就是通过痰涂片显微镜检查发现可疑患者[1]。抗酸染色因其经济、方便且能快速筛查可疑结核病患者,一直以来均被发展中国家临床医生和实验室人员所青睐[2]。我国绝大多数实验室,包括基层医疗机构实验室均开展了抗酸染色项目,但对该项目的准确度评价仍面临巨大的挑战[3],虽然各级临床检验中心组织有抗酸染色项目室间质量评价,但目前仍缺乏标准化制备抗酸染色项目室间质量评价质控片的相关研究。本研究基于重庆市临床检验中心的平台,探讨了标准化制备稳定、均一抗酸染色室间质量评价质控片的方法,现报道如下。
1 材料与方法
1.1菌株来源 脓肿分枝杆菌标准菌株ATCC 19977(CICC10381)购自中国工业微生物菌种保藏中心。
1.2仪器与试剂 血培板、改良罗氏培养基购自重庆旁通生物科技有限公司,革兰染色、抗酸染色试剂购自珠海贝索生物技术有限公司,比浊仪购自法国梅里埃,普通光学显微镜购自奥林巴斯(中国)有限公司。
1.3方法
1.3.1染色方法 革兰染色、萋-尼氏抗酸染色按商品化染色液说明书操作。
1.3.2确定最适培养基 从-80 ℃冰箱中取出脓肿分枝杆菌标准菌株干粉,在做好个人防护的前提下于生物安全柜中用无菌肉汤1 mL溶解,溶解后用接种环挑取一环,接种于血平板上,分三区划线,放于35 ℃、5%二氧化碳培养箱中孵育3 d[4]。另外取50 μL接种于改良罗氏培养基,培养5 d。将培养有ATCC 19977的血平板和改良罗氏培养基取出,取3 mL生理盐水,制备成3.00麦氏浓度菌悬液。调整好后分别用空针抽取1 mL菌悬液注入阴性血培养中,摇匀,分别取10 μL在玻片上涂2 cm2大小的菌膜,玻片自然风干,固定,进行抗酸染色。
1.3.3确定最佳消化液、消化时间和消化温度 (1)胰蛋白酶和N-乙酰-L-半胱氨酸(NALC)是消化痰液的2种良好消化剂[5]。有研究表明,使用1%胰蛋白酶消化30 min能得到理想的消化效果[6];而NALC使用最多的浓度是2%、消化15 min[7]。因此,本研究按文献报道的消化浓度和消化时间分别对胰蛋白酶和NALC的消化效果进行了评价。在生物安全柜中分别用无菌一次性塑料吸管吸取2 mL浓痰于痰杯中,分别加1%胰蛋白酶2 mL常温消化30 min、2% NALC 2 mL常温消化15 min,消化完后取10 μL于玻片上涂2 cm2菌膜,分别涂4张,2张进行革兰染色,2张进行抗酸染色。(2)在生物安全柜中分别用无菌一次性塑料吸管吸取1 mL浓痰于痰杯中,加入1%胰蛋白酶1 mL分别在室温和37 ℃消化30 min,消化结束后取10 μL于玻片上涂2 cm2,分别涂4张,2张进行革兰染色,2张进行抗酸染色。(3)在生物安全柜中分别用无菌一次性塑料吸管吸取1 mL浓痰于痰杯中,分别加入1%、2%、5%、10%胰蛋白酶1 mL于37 ℃消化30 min,消化完后取10 μL涂于玻片上涂2 cm2,分别涂4张,2张进行革兰染色,2张进行抗酸染色。(4)根据酶动力学相关知识,当酶浓度、底物浓度、反应温度、pH确定的时候,反应速率随即确定[8],达到理想的消化效果,即有一个最佳的消化时间。为此,本研究设计了4种不同的消化时间。在生物安全柜中分别用无菌一次性塑料吸管吸取1 mL浓痰于痰杯中,加入2%胰蛋白酶1 mL于37 ℃分别消化10、20、30、60 min,消化完后取10 μL在干净玻片上制成2 cm2椭圆形痰膜,分别涂4张,2张进行革兰染色,2张进行抗酸染色。
1.3.4制备不同等级抗酸染色室间质量评价质控片 在生物安全柜中用无菌一次性塑料吸管吸取5 mL浓痰于痰杯中,加入2%胰蛋白酶5 mL,在37 ℃孵箱中消化20 min。将培养有脓肿分枝杆菌ATCC 19977的血平板取出,在生物安全柜中调菌悬液到0.50麦氏浓度,取100 μL菌悬液于900 μL生理盐水稀释10倍,再取稀释后的菌悬液500 μL于500 μL生理盐水中,稀释2倍,之后再取100 μL稀释的菌悬液加入900 μL消化的痰液,于生物安全柜中涡旋震荡,混匀;取0.50麦氏浓度菌悬液100 μL于900 μL生理盐水中稀释10倍,再取100 μL稀释的菌悬液加入900 μL消化的痰液,于安全柜涡旋震荡,混匀;取0.50麦氏浓度菌悬液100 μL于900 μL生理盐水中稀释10倍,再取200 μL稀释的菌悬液加入800 μL消化的痰液,于安全柜涡旋震荡,混匀;取0.50麦氏浓度稀释的菌悬液100μL加入900 μL消化的痰液,于生物安全柜中涡旋震荡混匀。各取10 μL涂于玻片上,制成2 cm2椭圆形痰膜,各浓度分别制备4张。
1.3.5稳定性、均一性评价 (1)基于能力验证质控片在发放过程中生物安全的考虑,本研究对抗酸染色质控片进行了灭菌处理,处理方式包括紫外线灭菌处理24 h、高压蒸汽灭菌(121 ℃、20 min)、80 ℃高温烘烤3 h;通过比较3种灭菌方式后脓肿分枝杆菌菌体染色形态,背景细胞形态,评价其稳定性。对紫外线灭菌24 h的室间质量评价质控片在室温放置1、2周,1、3、6个月,每个时间点取出室间质量评价质控片进行抗酸染色,评价脓肿分枝杆菌ATCC 19977菌体形态及背景细胞形态。以镜检脓肿分枝杆菌菌体抗酸染色成典型的红色杆菌、且染色结果稳定、显微镜下形态完好、背景中性粒细胞胞体完整、背景清晰、呈蓝色作为稳定性评价标准。(2)在生物安全柜中随机抽取制备好的、等级为+++室间质量评价质控片10张,每张进行抗酸染色镜检,读取30个油镜视野。计数每个油镜视野的抗酸杆菌细菌数,计算平均值,根据中华人民共和国卫生行业标准WS 288-2017《肺结核诊断》判断结果。
2 结 果
2.1血平板是最佳的培养基 血平板培养的脓肿分枝杆菌通过抗酸染色后形态呈典型的红色长杆菌,直径3.0~5.0 μm,镜下容易识别(图1)。改良罗氏培养基培养的ATCC 19977菌体细小,直径0.5~1.0 μm,形态呈细小杆菌,不易识别(图2)。不适于抗酸染色室间质量评价质控片的制备。
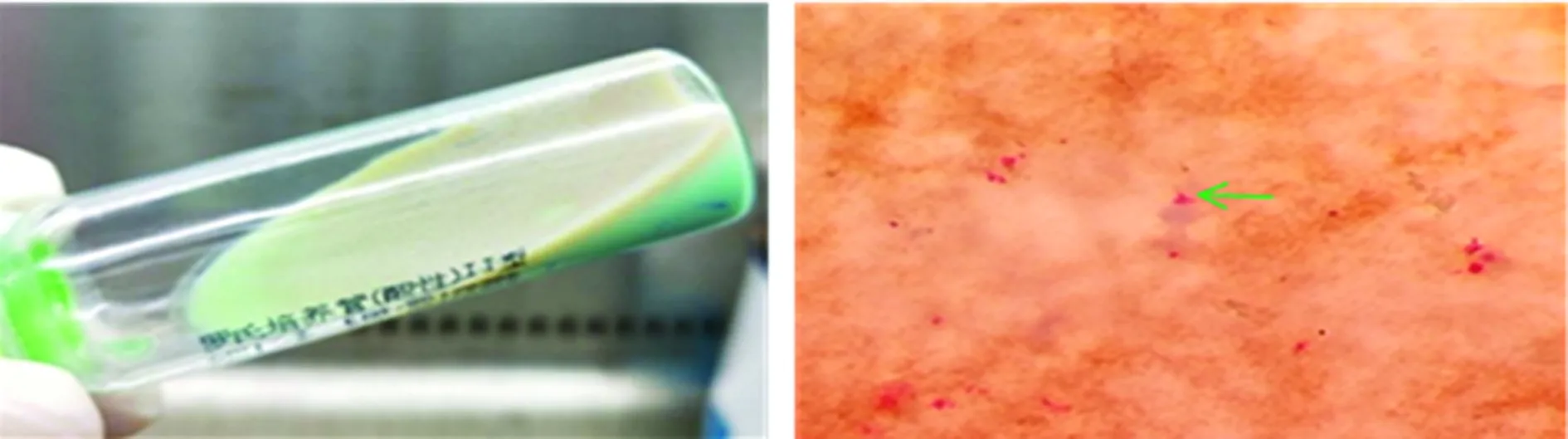
图2 脓肿分枝杆菌ATCC 19977在改良罗氏 培养基上的菌落形态和抗酸染色镜下形态
2.2胰蛋白酶是处理痰液最优的消化液 使用胰蛋白酶消化后的痰液均匀,流动性强,抗酸染色、革兰染色低倍镜下均能看见脓细胞相对均匀分布,而通过NALC消化后的痰液出现小的絮状痰块,且流动性欠佳,通过革兰染色和抗酸燃染色后在低倍镜下观察,NALC消化的痰液细胞呈块状聚集,非均匀地分散,表明消化效果不理想(图3、4)。
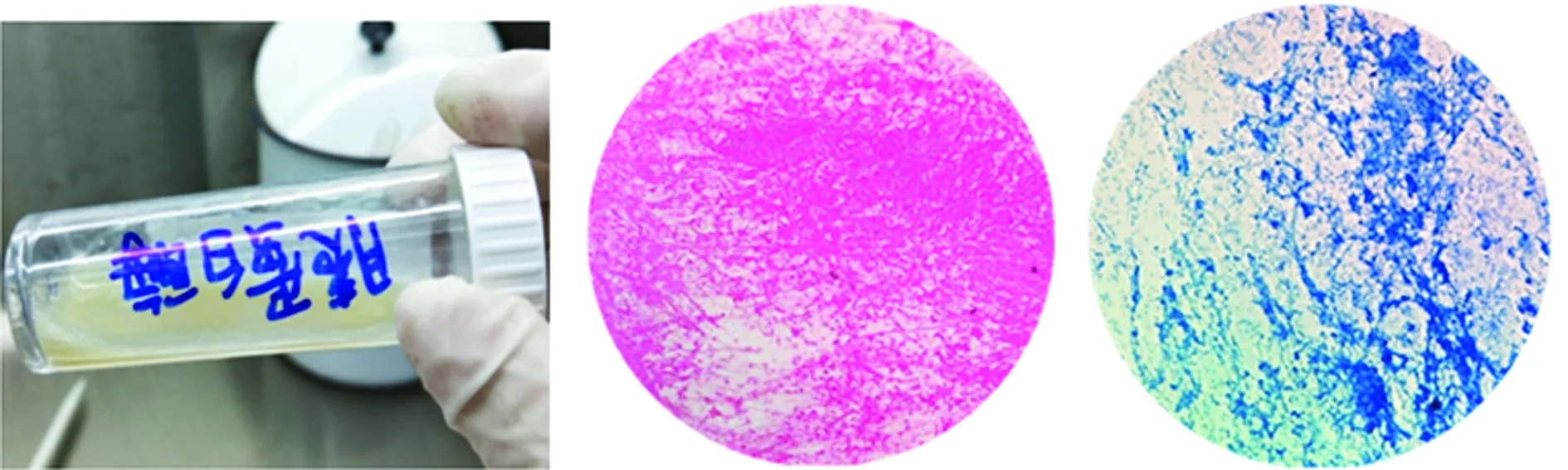
图3 浓痰在1%胰蛋白酶消化30 min后的 外观和显微镜下形态
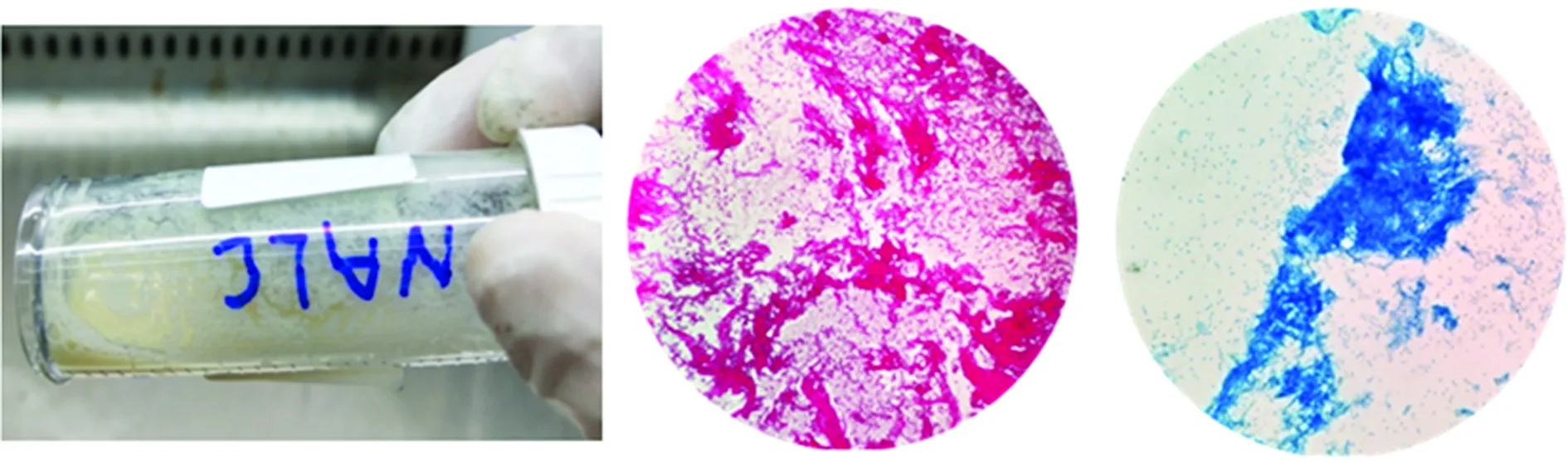
图4 浓痰在2% NALC消化15min后的 外观和显微镜下形态
2.3胰蛋白酶在37 ℃条件下消化效果优于常温下的消化效果 37 ℃下1%胰蛋白酶消化后痰液中的中性粒细胞呈均匀分布,而在室温下消化后低倍镜和高倍镜下仍可见典型的黏液丝(图5、6)。表明在37 ℃条件下胰蛋白酶消化效果明显优于室温下消化效果。
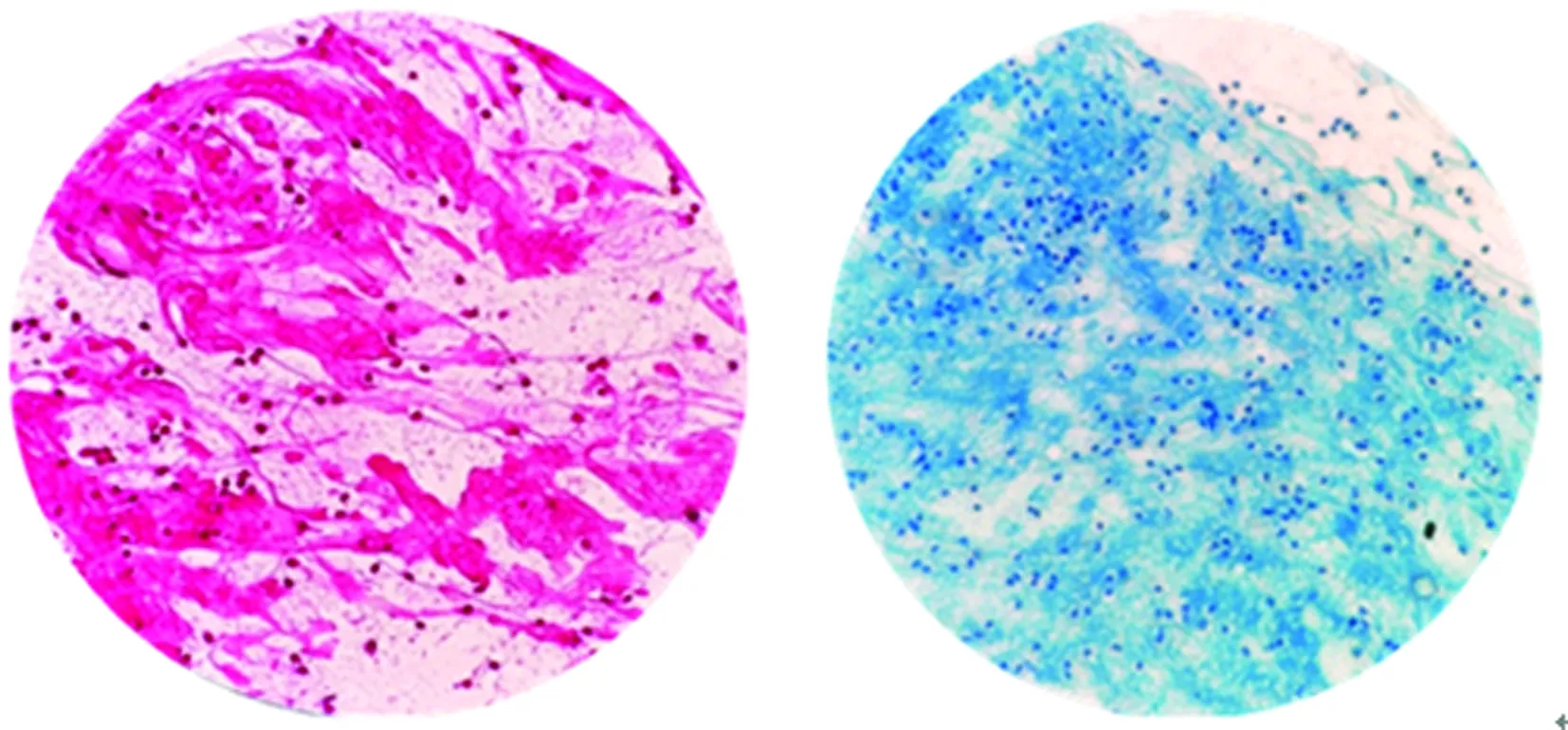
图5 1%胰蛋白酶常温消化浓痰1 h,革兰 染色、抗酸染色高倍镜下形态
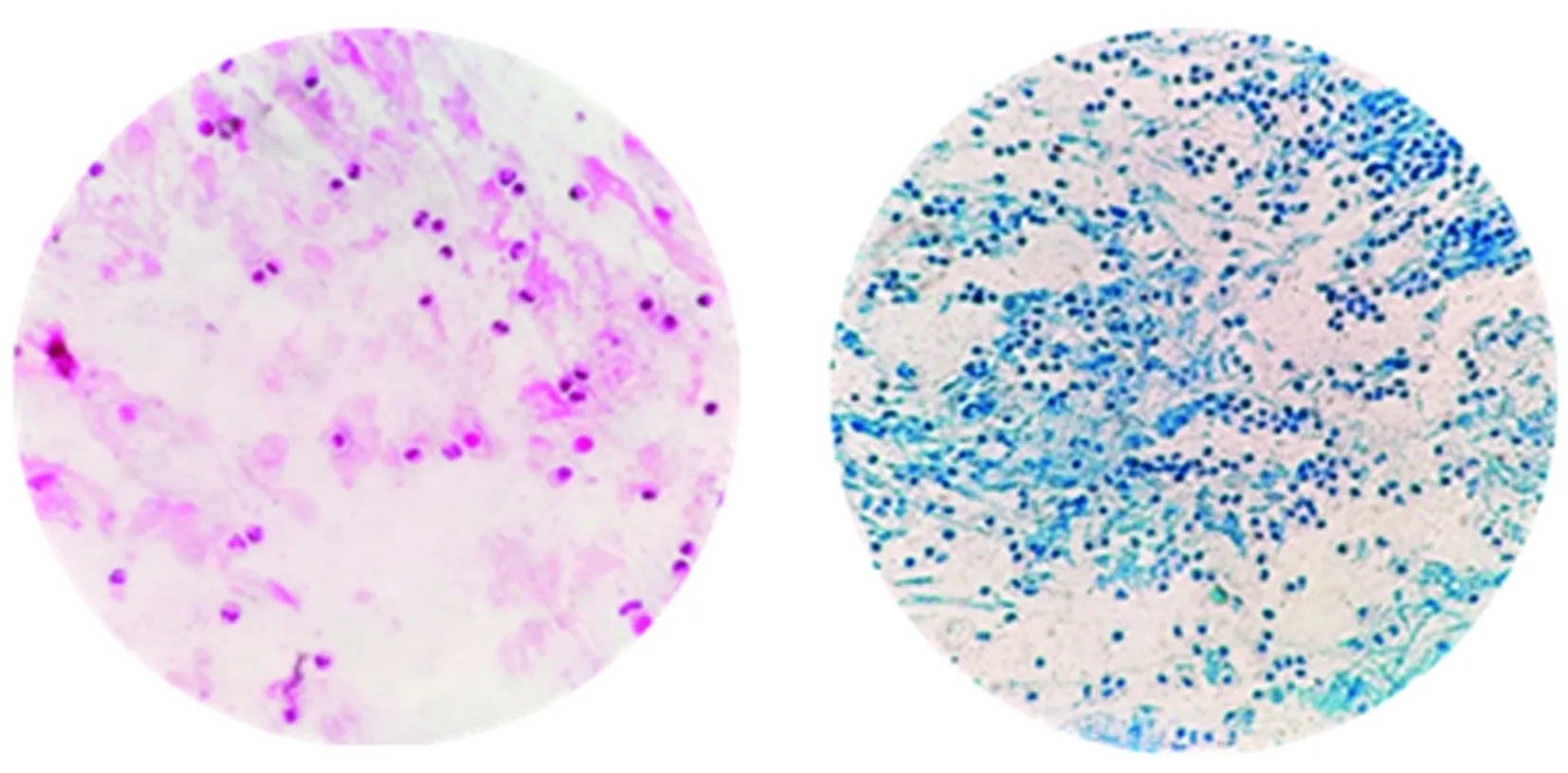
图6 1%胰蛋白酶37 ℃消化1 h,革兰 染色、抗酸染色高倍镜下形态
2.42%胰蛋白酶是制备抗酸染色质控片最佳的消化浓度 1%胰蛋白酶作为消化浓度,37 ℃消化1 h后显微镜下仍可见少量黏液丝,提示或许以1%胰蛋白酶作为消化浓度并非是最佳的。1%、2%、5%、10%胰蛋白酶作为消化液,在37 ℃孵箱中孵育30 min,通过外观、抗酸和革兰染色显微镜下观察,2%胰蛋白酶消化30 min是最好的消化浓度。
2.52%胰蛋白酶消化20 min能达到最佳的消化效果 10 min时肉眼见痰液黏稠,流动性不佳;20 min可达到理想的消化效果,而消化40 min时痰液呈稀薄呈水状,提示细胞被消化,显微镜下结果证实2%胰蛋白酶消化20 min能达到最佳的消化效果(图7)。
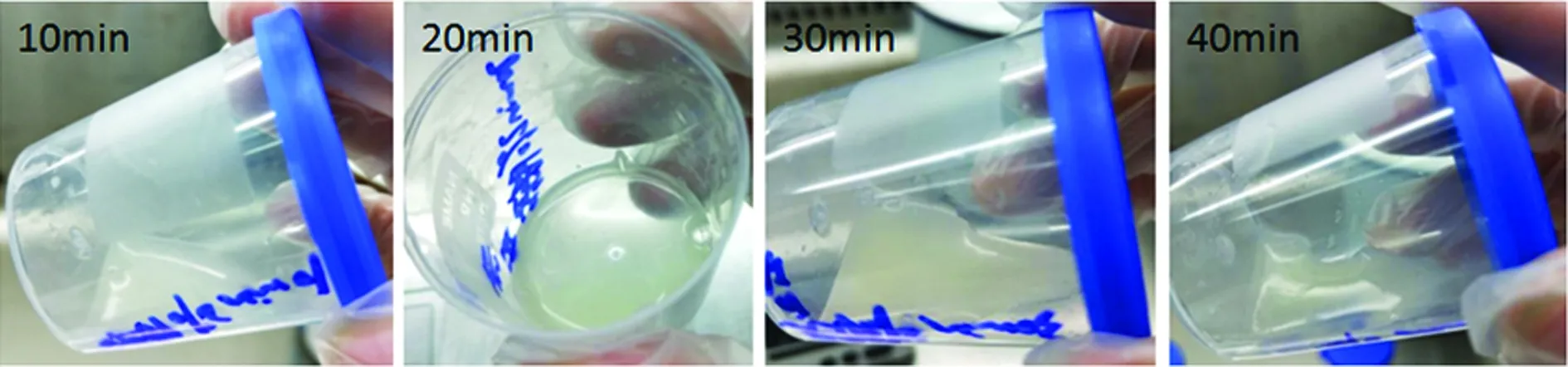
图7 不同时间点2%胰蛋白酶37 ℃消化 浓痰后的外观比较
2.6制备不同级别抗酸染色项目室间质量评价质控片 利用充分消化的痰液稀释200倍取10 μL制备2 cm2菌膜(+),稀释100倍取10 μL制备2 cm2菌膜(++),稀释50倍取10 μL制备2 cm2菌膜(+++),稀释10倍取10 μL制备2 cm2菌膜(++++)。
2.7稳定性评价结果 高压灭菌121 ℃、20 min对脓肿分枝杆菌ATCC 19977菌体形态无影响,但会对背景细胞造成破坏,进而影响染色背景,不宜作为室间质量评价质控片的灭菌方式。紫外线灭菌24 h和80 ℃高温烘烤对脓肿分枝杆菌ATCC 19977菌体形态及背景细胞染色均无影响,可作为灭菌的方法,且对质控片稳定性无影响。对紫外线灭菌24 h的室间质量评价质控片在室温放置6个月对脓肿分枝杆菌ATCC 19977菌体形态和背景细胞的染色稳定性无影响。
2.8均一性评价结果 随机抽取的10张抗酸质控片的结果都是(+++)。见表1。表明根据上述步骤做出的质控片均一性良好。
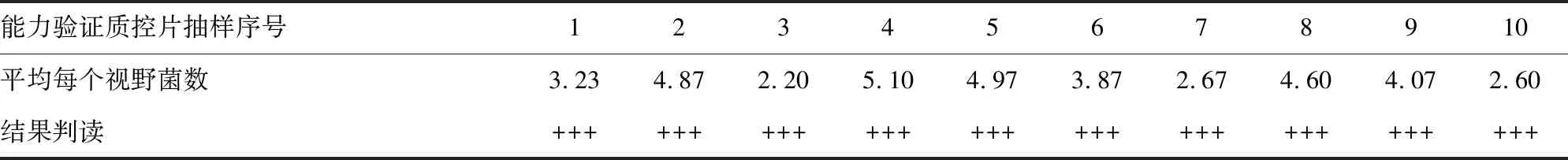
表1 抗酸染色质控片(+++)均一性评价
3 讨 论
本研究利用脓肿分枝杆菌标准菌株ATCC 19977作为实验菌株,结果显示,在血平板上培养后的菌体较改良罗氏培养基培养后的菌体细长,染色后效果更为典型和便于观察。分析可能的原因,改良罗氏培养基中加有孔雀绿,孔雀绿为抑菌剂,抑制其他杂菌生长的同时,对脓肿分枝杆菌生长有部分抑制作用,使改良罗氏培养基上的脓肿分枝杆菌菌体形态短小,制备成室间质量评价质控片后普通光学显微镜不利于观察,即不能用于抗酸染色室间质量评价质控片的制备。另一方面,在最佳的消化液选择过程中,通过查阅相关文献发现,对浓痰消化使用最多的消化液为胰蛋白酶和NALC,本研究进一步比较了2种常用消化剂对浓痰的消化作用,结果显示,胰蛋白酶消化效果明显优于NALC。分析其原因,浓痰成分主要是黏多糖、黏蛋白[9],而胰蛋白酶为蛋白水解酶,对精氨酸和赖氨酸肽链具有水解作用,可使痰液中的酸性糖蛋白和黏蛋白等水解为多肽或氨基酸[10],所以,胰蛋白酶能有效对痰液进行消化,使各类细菌与细胞呈游离暴露状态;而NALC为半胱氨酸的N-乙酰化衍生物,分子中含有巯基,能使黏蛋白肽键的二硫键(-S-S-)断裂,只能使黏蛋白变成相对小的肽链,其消化效果明显弱于胰蛋白酶。
相较于改良罗氏培养基,血平板上的脓肿分枝杆菌在显微镜下的形态更加细长,而改良罗氏培养基上的脓肿分枝杆菌短小,不易观察。因此,对抗酸染色项目室间质量评价质控片的制备,血平板是培养脓肿分枝杆菌的良好培养基;通过革兰染色和抗酸染色后利用显微镜镜检观察质控片的背景,确定胰蛋白酶为最佳的消化液,最佳消化浓度为2%,最佳消化条件是37 ℃下消化20 min。另外,制备成0.50麦氏浓度的脓肿分枝杆菌通过使用胰蛋白酶消化后的痰液进行不同倍数的稀释,可得到不同等级的抗酸染色室间质量评价质控片,且能保证其均匀和稳定。
抗酸染色项目因其操作简便、经济、快速等优点,受到我国各级临床实验室的青睐,其准确度对临床的诊断至关重要。目前尚未见关于如何标准化制备抗酸染色室间质量评价质控片的相关文献报道,本研究基于重庆市临床检验中心的平台,首次探讨了标准化制备稳定、均一抗酸染色室间质量评价指控片的方法,并成功用于重庆市各临床实验室抗酸染色项目的能力验证,保证了全市开展该项目临床实验室结果的准确性。
