慢性心力衰竭兔心室结构重构导致心功能和电生理异常及其意义探讨
2019-06-04赵瑶玉赵元刚杨清喜陈玉婷郭瑞强孙有刚
赵瑶玉 盛 波 赵元刚 杨清喜 陈玉婷 郭瑞强 孙有刚
慢性心力衰竭(心衰)是众多心血管疾病发生发展的终末阶段[1],常出现交感神经调节失常,心室壁承受机械牵张负荷加重,刺激交感神经系统无序释放出逃逸和/或超出患者自身调节的肾素、血管紧张素和醛固酮体液因子于心脏和血液循环系统,长期作用导致心肌组织纤维化和弥漫性坏死,心室兴奋-收缩偶联丧失,心腔扩大,产生心室结构重构[2]。其结果是心功能下降,心脏不能正常将血液从主动脉泵出供全身需要;心室肌细胞动作电位在传递中受阻、出现心室电不均一性,跨室壁离散度增加而诱发折返性室性心律失常(Ventricular Arrhythmias, VA)和/或异位触发性VA[3]。所以,心衰引起心室结构重构造成心室收缩舒张功能下降为VA发生提供了易损性[4]。只是相关结构重构特征及其引起心功能下降和电生理异常还不完全清楚。本文通过异丙肾上腺素(Isoproterenol, ISO)诱导家兔心衰模型,采用组织病理学及超微切片技术以及超声心动图等手段进行检测分析,旨在为临床认识和了解心衰发生结构重构及其引起的VA电生理异常提供实验依据,为有效防治心衰进一步恶化提供理论指导。
1 材料与方法
1.1 材料
1.1.1动物与分组:本研究遵从武汉大学医学院实验动物管理与使用指南的相关规定。健康雄性新西兰大耳白兔购于武汉生物制品研究所,起始体重1.5—2.0kg,共25只。动物购回后饲养于本院实验动物中心(SPF级动物室),1—2周后分成对照组(11只)和慢性心力衰竭组(心衰组,14只)。
1.1.2主要仪器和试剂:病理图像数字分析系统(NIH Image 1.6, 美国);超薄切片机(LKB-V,Bromma, 瑞士);透射电子扫描显微镜(H-600,日本);超声检测仪(iE33,Philips,美国);16导电生理记录系统(PowerLab 16/30,澳大利亚);电生理记录和分析模块(LabChart Pro V7, 澳大利亚);刺激器(Grass S88,美国)。ISO、戊巴比妥钠、肝素钠、甲醛、戊二醛、锇酸、醋酸双氧铀和枸橼酸铅等分别购于Sigma公司或国内相关试剂公司,均为分析纯。
1.2 方法
1.2.1心衰模型制备:制模方法参考文献[5]。经兔耳缘静脉在同一时间段注射ISO(0.3mg/kg/天),每天1次,连续不间断注射3周,注射前后注意剃毛、消毒和止血;对照组注射相同体积0.9%生理盐水。造模后继续喂养6个月,整个饲养过程充分提供动物生活所需要的湿度、温度和光线,自由进食和饮水。6个月后比较两组存活兔的临床表现、M型超声心动图和心电图相关指标,与对照组比较,制模组兔出现消瘦、脱毛、食欲减退、气促等临床症状;超声检测室间隔和心室侧壁出现不同程度运动减弱、心腔扩大、射血分数明显下降;心电图提示心率减慢, PR和QT间期均延长,ST段下移等改变,提示本实验兔心衰模型成功[6]。制模组兔有2只在喂养后期出现腹泻死亡,2只兔在记录在体电生理指标过程中意外死亡,余10只全部造模成功;对照组兔有1只在开胸时出现气胸死亡,余10进入后续实验。
1.2.2超声心动图检查兔心功能改变:将两组兔(各10只)背卧捆绑于实验动物台上,台面用温控电热毯将兔体温维持在37°C,备皮、剃除胸部长毛并消毒,待兔安静后行常规二维超声及M型超声检查。每次检查均由同一位熟练的超声专科医师将超声探头(Philips iE33超声诊断仪,美国Philips公司)贴服于兔胸壁,图像深度3.0-5.0cm,探头频率6MHz。观察心功能主要指标:左心室射血分数(LVEF)、主动脉最大流速(Avmax)、左心室舒张末期内径(LVEDd)和室间隔厚度(IVST)。
1.2.3心电图监测兔电生理变化:各组兔在完成1.2.2后,将兔四肢剃毛,待安静后用电生理仪记录清醒状态下模拟标准肢体II导联心电图(Electrocardiogram,ECG ECG-II),数据采集系统在信号采样率为1KHz下连续记录2h,信号经数模转换成ECG并存储计算机,通过电生理仪自带应用于兔的标准化记录和分析模块,测量和分析ECG-II连续10个P-QRS波群,取各主要参数平均值比较。观察主要参数:心率、PR间期、QT间期和ST段。
1.2.4ERP和Burst-pacing记录兔心室电活动离散度和VA诱发:各组兔耳缘静脉推注戊巴比妥钠(300mg/kg)麻醉后开胸,用开睑器撑开胸廓充分暴露心脏,剪开心包膜,用接触式双极铂金微电极贴于左心室前壁靠近心尖部,记录心室单相动作电位。利用程控电刺激检测不同基础刺激周长(Basic Cycle Lengths, BCL)的心室有效不应期(Effective Refractory Period, ERP),用铂金制成刺激双电极置于右室心外膜,由刺激器发放刺激对心脏进行起搏,刺激方波均为2ms,刺激强度为2倍舒张阈值,按8∶1的S1S2程控刺激法,即每8个基础起搏S1后发出一个期前刺激S2,BCL时的S1S1分别为150ms和200ms, S1S2偶联间期分别从各自的BCL开始,以5ms步长反扫递减,直到S2不能诱发心室激动,此时S1S2偶联间期定义为心室ERP,即:ERP150和ERP200。记录心电信号经放大器放大并经滤波器过滤(10Hz-1KHz)后存在计算机中,用自带的分析软件进行测量和分析。观察指标包括BCL为150ms和200ms的ERP150和ERP200及其ERP离散度(dispersion of ERP, dERP),即dERP150和dERP200。ERP测定完成后采用短阵快速刺激(Burst-pacing),刺激波宽2ms,BCL从150ms开始,观察各组兔被诱发VA,包括室性早搏、室性心动过速或心动颤动,图形存于计算机,用自带分析软件测量和分析诱发VA的BCL及其诱发率。
1.2.5组织病理方法检查兔心室肌组织重构和超微结构变化:将各组完成1.2.4且仍然存活兔手术摘取心脏,置入冰冻生理盐水中洗净残血,立即剪取1cm3左心室组织置于10%中性福尔马林液中固定,用于免疫组织化学染色;再剪取1mm3左心室组织置于预先冷冻0.1mol磷酸缓冲液+戊二醛中固定,用于超微结构检查。首先将用于免疫组织化学染色的左心室组织经梯度乙醇系列脱水,常规石蜡包埋切片(留取第30—32张切片为实验用切片,厚4μm),行心脏胶原Masson染色。40×40倍光学显微镜下选取切片中血管以外的区域观察胶原分布和着色情况,切片中间质胶原纤维被染成蓝绿色,利用图像采集分析系统拍片保存并测定心肌间质胶原面积。心室肌间质胶原纤维定量采用间质胶原容积分数(CVF)表示,即为单位测量面积中胶原所占百分比。将用于超微结果观察的组织标本在0.1M磷酸缓冲液中漂洗三次,经1%锇酸固定,梯度酒精脱水,环氧树脂包埋,超薄切片机切片后醋酸双氧铀+枸橼酸铅染色,最后用透射电镜观察心室肌细胞超微结构。
1.3 统计学处理

2 结 果
2.1 两组兔心室肌组织病理学特征比较
与对照组比较,心衰组兔心室肌组织中被染成蓝色似条纹状的胶原纤维明显增多,胶原纤维之间的心肌细胞排列不规则,可见心肌纤维断裂和/或肿胀,并被条状的结缔组织分开。与对照组比较,心衰组兔心室肌组织胶原纤维的CVF显著增加[(10.03±1.35)% vs (19.82±3.71)%,t=9.74,P<0.01,n=5]。另外,对照组兔心室肌细胞肌丝清晰、宽大厚实、明暗带清晰,糖原结构清楚、密度高,线粒体带厚实、紧密嵴,肌小节排列有序、稠密;心衰组兔心室肌细胞肌丝疏松、明显延长,充斥着少量排列杂乱线粒体,线粒体肿胀并带有蓬松嵴、有些出现空泡,肌小节稀疏增宽、少许断裂。见图1。

图1 对照组与心衰组兔心室肌免疫组织化学(分别为A和C)以及细胞超微结构形态学(分别为B和D)特征比较
2.2 两组兔心功能和心电图检测主要参数比较
与对照组比较,心衰组兔LVEF和Avmax显著下降(P<0.05),LVEDd明显延长,且IVST明显变薄(P<0.01),心率明显减慢,PR间期和QT间期均显著延长(P<0.01),ST段明显下移(P<0.05)。见表1。
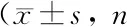
表1 两组兔心功能和心电图检测主要参数比较结果均=10)
注: 与对照组比较,1)P<0.05,2)P<0.01
2.3 两组兔心室肌组织ERP和VA诱发主要参数比较
与对照组比较,心衰组兔ERP150和ERP200均显著延长,且dERP150和dERP200均明显增大(P<0.01),诱发VA的BCL显著延长(P<0.01),VA诱发率明显加大(P<0.01)。见表2。
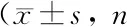
表2 两组兔心室肌组织ERP和VA诱发主要参数比较均=10)
注:与对照组比较,1)P<0.01
3 讨 论
临床上慢性心衰大部分源自扩张型心肌病的终末阶段,多因体内儿茶酚胺分泌增高日积月累所致,引起心脏结构重构和心功能降低[7]。本实验结果提示,心衰兔心室肌组织中胶原纤维明显增多,CVF显著增加,胶原纤维之间的心肌组织排列不规则,被条状的结缔组织分开,心肌纤维断裂,细胞肿胀。显示心室肌组织及细胞变性,发生明显纤维化倾向,出现结构重构,引起心室肌细胞之间相互偶联程度减少,动作电位依次下传的阻抗增加,下传过程受阻,传导减慢、减弱和/或间断,跨室壁离散度及电不均一性增加,从而为折返性VA的启动和维持提供了条件。所以慢性心衰引起的结构重构为折返性VA的诱发提供了易损性[8]。而从本实验结果进一步说明慢性心衰的结构重构可能来自心衰兔心室肌细胞肌丝疏松、明显延长,充斥着少量排列杂乱、肿胀并带有蓬松嵴和出现空泡的线粒体,肌小节稀疏增宽、少许断裂。说明心衰兔心室肌细胞发生明显 “去心室肌化”,心室肌细胞失去心肌应有的结构特征异化为胶原纤维。提示慢性心衰发生结构重构的基础可能是心室肌细胞超微结构出现退行性改变[9]。
正因慢性心衰发生了心室结构重构,其引起后果可能是心功能下降与电生理活动异常[10]。本实验结果提示,慢性心衰兔LVEDd明显延长,LVEF显著降低,IVST变薄,Avmax显著下降。超声心动图检测实验动物的心脏功能是心血管疾病基础研究的重要组成部分,本超声心动图检查结果说明心衰兔心脏做功能力明显不足,心输出量降低,不能充分泵出心脏血液供应全身。而经心电图监测提示心衰兔心率减慢,PR和QT间期延长,ST段下移均较正常兔明显。提示心衰兔心电冲动传导时间延长,心脏为了排出血液供应全身发生代偿性缺血状态,这些电活动异常特征为异位起搏点发放预留了时间和空间,从而使心室电活动的扩布出现异质性,易于诱发折返性VA[11]。所以,本实验结果表明,心衰兔心脏经过程控刺激后,有效不应期明显延长,离散度显著加大,显示出心衰时心室电活动的不稳定性和离散性,而正是有了这种异常心室电活动,使得心衰兔心室耐受不了快速电刺激,稍微给予一点长周期插入性电刺激就可诱发VA,甚至危及生命。本实验结果提示心衰兔心室被诱发VA的刺激周长明显延长,VA诱发率显著加大。提示慢性心衰的心室在经历电生理改变,电不均一性增大后对于VA的诱发具有明显倾向,诱发率大大增加[12]。总之,慢性心衰兔心室发生明显结构重构,使得心功能下降,心室电生理异常改变,二者相互作用,从而易于折返性VA诱发。通过本实验探讨有利于临床正常认识和了解慢性心衰病理生理变化及其带给临床的严重并发症,为防治心衰进一步病理性改变,逆转重构和幸存心室肌细胞回归提供帮助[13]。
