细胞因子诱导的杀伤细胞治疗晚期肺癌的临床观察
2019-06-03黄建敏杨双宁段晓冉
李 红,张 震,黄建敏,赵 璇,杨双宁,段晓冉,张 毅
1) 郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2) 郑州大学第一附属医院肿瘤中心 郑州 450052 3) 郑州大学生命科学学院 郑州 450001 4) 河南省肿瘤免疫与生物治疗重点实验室 郑州 450052
随着生活方式以及环境的改变,癌症的死亡人数逐年攀升[1]。据国家癌症中心发布的2017年中国肿瘤现状和趋势报告:中国癌症发病人数约占全球的22%,癌症死亡约占全球的27%,成为导致中国居民的主要死亡原因, 其中肺癌的发病率和死亡率均位居首位[2-3]。目前恶性肿瘤的主要治疗手段包括传统的手术、放疗和化疗等在内的综合治疗措施。随着肿瘤学、免疫学和分子生物学等相关学科的迅速发展,肿瘤免疫治疗作为一种新的抗肿瘤治疗手段,临床效果已经得到了验证,并成为肿瘤综合治疗的重要组成部分[4]。大量研究[5-8]显示,细胞因子诱导的杀伤细胞(cytokine-induced killer cell, CIK)、肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte cell, TIL)、树突状细胞(dendritic cell, DC)、自然杀伤性细胞(natural killer cell, NK)、嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)等免疫细胞治疗转移性黑色素瘤、肾癌、肺癌和淋巴瘤等均取得了较好的临床疗效。本课题组采用CIK细胞治疗联合常规疗法治疗了30例晚期肺癌患者,现将结果报道如下。
1 对象与方法
1.1研究对象收集2014年1月至2015年1月郑州大学第一附属医院生物细胞治疗中心收治的59例晚期肺癌患者。入组患者均经过手术和(或)多疗程放化疗等既往治疗,KPS≥75分,无明显免疫抑制,无活动性感染,无重大器官功能障碍。30例接受生物治疗并符合生物治疗适应证,余29例(对照组)接受以铂类为基础的双药联合等化疗方案。该研究通过医院伦理委员会审批,患者签署知情同意书。两组基本情况见表1。
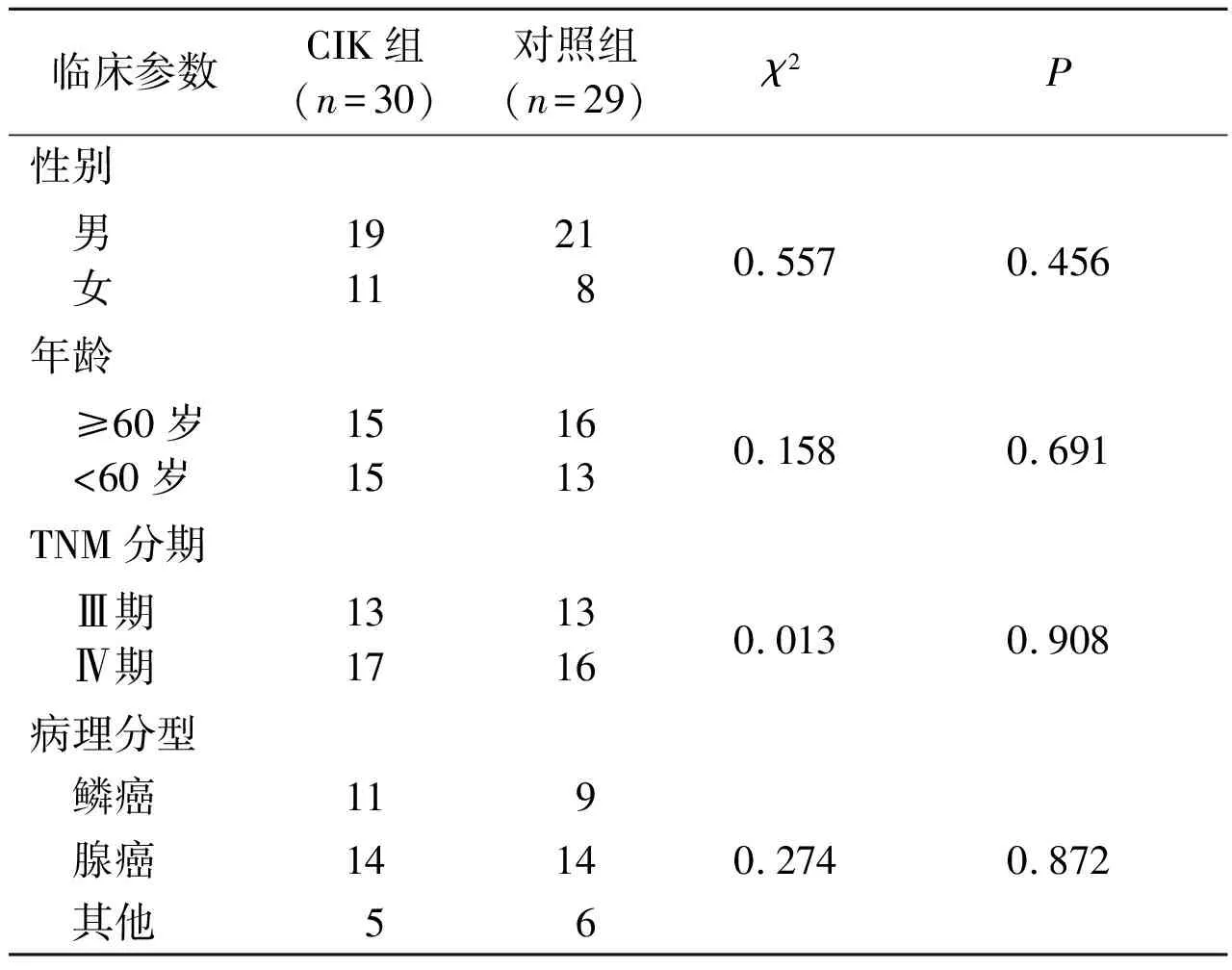
表1 两组患者的临床指标的比较
1.2CIK组治疗方案CIK组的治疗方案见图1。
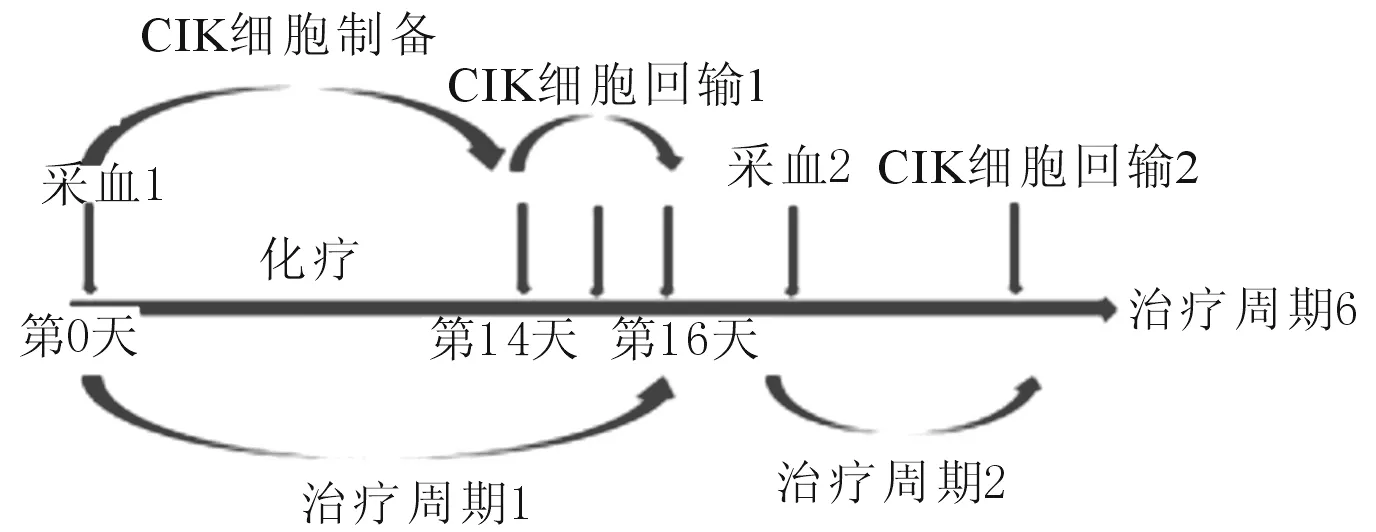
图1 CIK细胞治疗组的临床流程
1.2.1 CIK细胞的制备 采血前评估患者的血常规符合以下标准:白细胞计数>3×109个/L、淋巴细胞计数>0.6×109个/L、凝血酶原活动度(PTA)>50%,血小板计数(PLT)>80×109个/L、血红蛋白>100~150 g/L。抽取患者外周血50~100 mL,利用梯度离心法获得单个核细胞,计数后以2×106个/mL悬浮于50 mL GT-T551培养基(TaKaRa公司)中,置于含青、链霉素双抗、重组人IFN-γ(1 000 U/mL,PeproTech公司)的培养箱(37 ℃、体积分数5%CO2)中培养。24 h后加入CD3单抗(25 μg/L,eBioscience公司)、重组人IL-2(1 000 U/mL,北京双鹭药业股份有限公司),隔天观察细胞生长情况并更换培养液,直至完成14 d的细胞培养周期。诱导前后检测细胞表型(CD3、CD4、CD8、CD56)。
1.2.2 CIK细胞的回输 采用台盼蓝染色法检测CIK细胞终制剂的活细胞数量,活细胞数量应在90%以上。每批次细胞制剂在细胞回输前3 d取样质检(包括无菌检测和真菌)。质检合格后方可进行细胞回输。采用静脉滴注回输。每次回输前须评估患者的生命体征及心肺功能状态。如果患者体温高于38 ℃、血常规结果或主要脏器功能异常则不建议细胞回输。每个疗程包含6个周期,每次回输在传统治疗结束后3 d内开始,并以剂量爬坡的方式连续回输3 d(第1天10%,第2天30%,第3天60%)。每次回输的细胞数量不低于5×109个,每个疗程回输的细胞数应不低于1010个。首次接收细胞回输的患者、老年人或儿童须密切观察生命体征等变化。如果在回输过程中出现体温升高、过敏反应等则暂停回输并给予对症处理。
1.3临床疗效及安全性评估根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评估临床疗效。CIK组在完成最后一次细胞回输后4周进行评估,并按照治疗方案在细胞回输后每3个月(第1年)和之后每6个月(2 a后)进行复查和随访,包括血常规检查和影像学检查等。对照组在每次放化疗结束后评估临床疗效。根据美国国立癌症研究院通用毒性标准4.0版进行不良事件和安全评价。对生存结果进行电话随访分析,记录死亡时间。以确诊时间为起始事件,随访终止、失访或死亡作为终点事件。
1.4统计学处理采用SPSS 21.0进行分析,应用χ2检验比较两组患者临床资料和生活质量的差异,应用配对t检验分析CIK组患者治疗前后免疫细胞表型的变化;K-M法绘制两组的生存曲线并行log-rank检验。检验水准α=0.05。
2 结果
2.1CIK组患者外周血免疫细胞表型变化CIK组患者外周血诱导前CD3+T细胞比例偏低,且以CD3+CD4+T细胞为主;部分患者存在CD4+CD8+T细胞比例倒置。诱导后,CD3+CD56+细胞比例提高(表2),CD3+T细胞比例达90%以上,并且以CD3+CD8+T细胞为主要效应性细胞。

表2 CIK组患者外周血中免疫细胞诱导前后表型的比较(n=30) %
2.2两组患者治疗相关的不良反应和生活质量比较在CIK细胞回输过程中,部分患者出现一过性体温升高(多为低、中度发热),不需特殊处理可自行缓解。有3例患者出现高热,2例患者出现寒战,对症处理后均能迅速缓解。1例患者回输细胞后出现恶心、呕吐等消化道症状;2例患者出现肌肉酸困、乏力,多可自行缓解。全部患者均能顺利完成CIK细胞治疗周期,在回输过程中未出现危及生命或导致治疗中断的严重不良反应。与对照组比较,CIK组在精神状态和体力方面改善更明显(P<0.05),而睡眠质量和饮食方面变化不明显(表3)。

表3 CIK组和对照组生活质量的变化例(%)
2.3两组临床疗效CIK组有2例治疗2个月后局部肿瘤病灶明显缩小(图2、3);其余28例及对照组患者均未见病灶明显缩小。
CIK组和对照组生存曲线差异有统计学意义(χ2=4.156,P=0.041),中位生存期[M(P75,P25)]分别为29(24,45)个月和12(9,18)个月,CIK组中位生存期明显长于对照组(图4)。

图2 一例肺癌患者CIK治疗前(A)后(B)左肺部病灶CT表现

图3 一例肺癌患者CIK治疗前(A)后(B)右肺部病灶CT表现
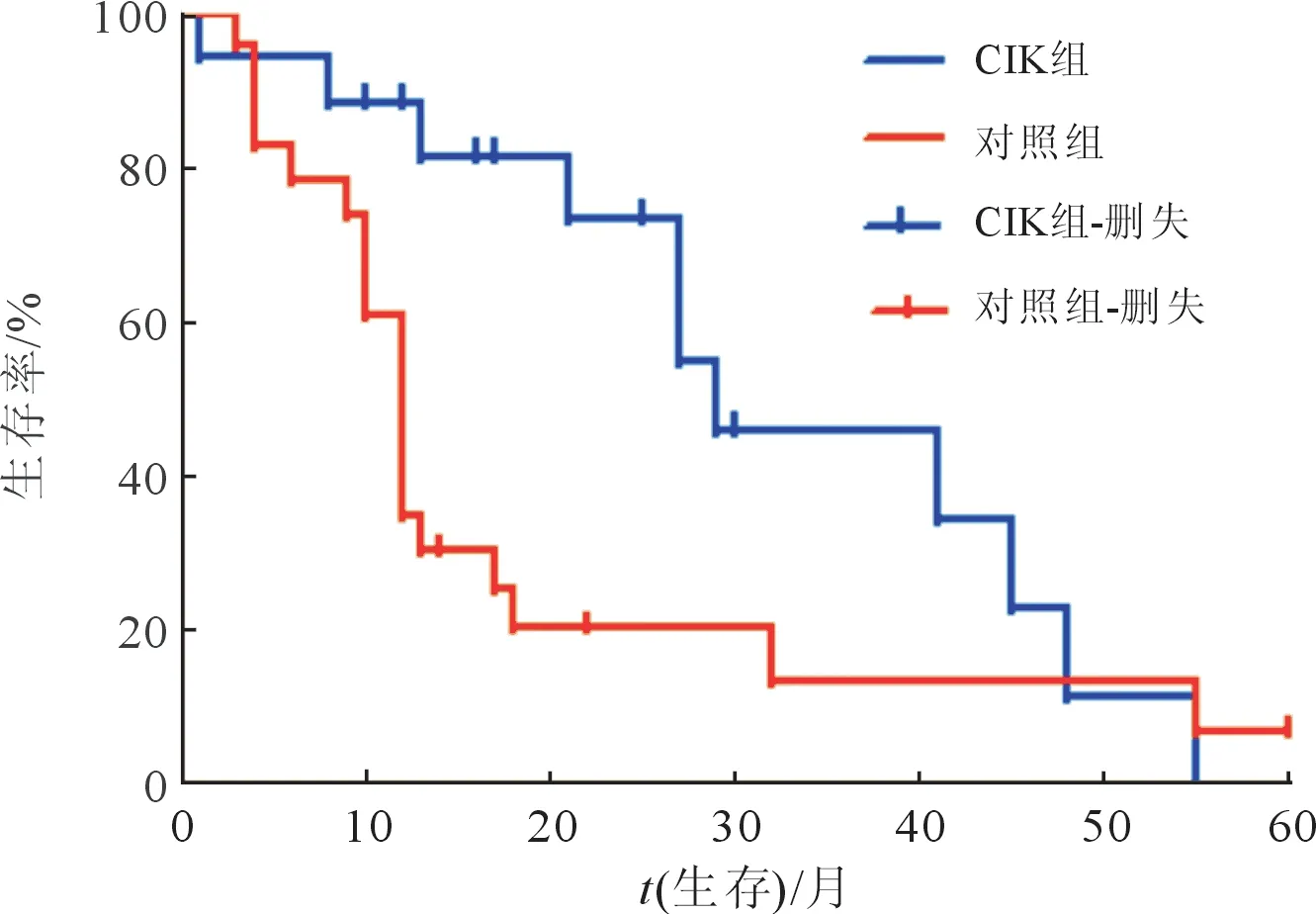
图4 CIK组和对照组患者的生存曲线
3 讨论
近年来,人们逐渐认识到机体的免疫调节对肿瘤的发生发展有着巨大影响,免疫治疗手段也被证实具有较好的临床疗效,因此肿瘤治疗理念在逐渐改变与更新。化疗药物虽然可以杀伤肿瘤细胞进而在一定程度上抑制肿瘤生长,然而不可避免地耐药、复发以及严重副作用等问题,无法给更多肺癌患者带来长期获益,特别是晚期肺癌患者的生活质量受到严重影响。肿瘤免疫治疗的理念是重建免疫系统,促进免疫系统清除肿瘤细胞,延缓病情进展,提高生活质量。CIK细胞表达CD3和CD56两种膜蛋白,兼具T淋巴细胞的抗瘤活性和非MHC限制性杀瘤特点。研究[9]表明,与LAK、TIL、NK和CAR-T细胞相比,CIK细胞具有增殖速度快、杀瘤谱广、抗肿瘤活性强、副作用轻微等特点。此外,CIK细胞可以通过多种机制杀伤肿瘤细胞,包括通过穿孔素及颗粒酶直接杀伤靶细胞,分泌IFN-γ、TNF-α、IL-2等多种细胞因子,增强细胞毒作用、高表达FasL,诱导肿瘤细胞的凋亡和坏死。
有文献[10-13]报道,免疫细胞如CIK、DC-CIK、TIL、CAR-T等细胞疗法对多种恶性肿瘤均有较明显疗效。早期的肿瘤患者更多地关注和受益于生存期的延长,而晚期肿瘤患者更多关注生活质量的提升与改善[5]。本组经CIK治疗的肺癌晚期患者中多数自觉饮食、睡眠和体力等方面有所改善。本组常见的不良反应为发热及体温升高,且均为一过性(发生率为10%),与文献[14]报道基本一致。体温升高常发生在细胞回输后1~6 h,可自行缓解。个别患者出现高热,对症处理后能够迅速缓解。在CIK治疗前后,患者的主要器官如肝、肾功能正常,无明显变化,提示CIK治疗不会造成肝、肾功能的损伤。
本研究中CIK组多数患者的瘤体没有出现明显改变,仅2例患者治疗后瘤体有较为明显缩小;对照组病灶均未缩小。文献[15]报道,接受PD-1/PD-L1治疗后有15%患者出现假性进展,影像学表现为瘤体增大25%甚至出现新的病灶,然而后期影像学的结果显示病情未被评估为肿瘤进展或者疾病进展。与传统的肿瘤治疗模式不同,接受CIK治疗的患者早期影像学结果较难鉴别为临床应答或非临床应答(基于这些影像技术的有限性),从而表现出特殊的临床应答模式(假性进展和延迟反应)或提示增大的瘤体,可能与肿瘤微环境中浸润的淋巴细胞归巢至肿瘤部位有关。因此,使用传统的RECIST疗效评价标准或许已不能准确评估免疫细胞治疗这一新兴技术的临床疗效,而需要更加完善与规范的评估标准[16-17]。此外,本研究中的病例数较少,其临床疗效需要在以后较大规模的临床研究中加以证实。
综上所述,此次临床观察初步证实了CIK治疗晚期肺癌的临床不良反应较为轻微,大多数患者可耐受;同时患者的生活质量得到提升,特别是在精神状态和体力恢复方面改善明显;此外,患者的中位生存期明显延长,说明CIK治疗晚期肺癌具有一定的临床受益;然而CIK治疗的具体作用机制和长期疗效仍需进一步的研究和验证。相信随着免疫细胞治疗的规范化,以及与传统肿瘤治疗手段的有效联合,免疫细胞治疗有望为肿瘤的临床治疗提供更好的选择。
