抑制Notch1信号通路对CD8+T细胞免疫检查点、功能及增殖的影响
2019-06-03程少燕赵启泰吴欣爱
程少燕,李 峰,平 玉,赵启泰,吴欣爱,张 毅
1)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2)郑州大学第一附属医院肿瘤中心 郑州 450052 3)河南省肿瘤免疫和生物治疗重点实验室 郑州 450052
CD8+T细胞是重要的抗肿瘤免疫细胞,通过T细胞受体(T cell receptor,TCR)的特异性识别后激活产生IFN-γ、颗粒酶B(granzyme B,GZMB)和穿孔素等因子,直接杀伤肿瘤细胞。研究[1-2]表明肿瘤微环境中CD8+T细胞的功能被明显抑制,呈现一种耗竭状态,包括免疫检查点(如PD-1、Tim-3)表达的上调,以及功能性细胞因子表达的下降等。既往研究[3]发现在CD8+T细胞TCR信号激活的过程中Notch1信号通路也被激活,Notch1信号通路异常与肿瘤的发生发展关系密切。Notch1作为一种高度保守的跨膜蛋白,主要影响CD8+T细胞的发育和分化[4-5],而对其功能、增殖及免疫检查点表达的影响尚不清楚[6-7]。本研究观察了抑制Notch1信号通路对活化的CD8+T细胞功能、增殖以及免疫检查点表达等的影响,探讨Notch1信号通路在CD8+T细胞中发挥作用的机制。
1 材料与方法
1.1主要材料及试剂淋巴细胞分离液购自天津灏洋生物制品有限公司,人CD8+T细胞分选磁珠、分选柱购自德国Mitenyi Biotec公司,CD8+T细胞活化磁珠购自美国Thermo Fisher Scientific公司,流式荧光抗体(CD8-APC-Cy7、PD-1-PE-Cy7、TIM-3-PE、GZMB-PE、IFN-γ-APC、IL-2-APC、Ki-67-PerCP)均购自美国Biolegend公司,Notch1抑制剂(LY3039478)购自美国Selleck生物科技有限公司,重组人白细胞介素-2(IL-2)购自北京双鹭药业股份有限公司,RPMI 1640培养基、佛波醇酯类多克隆刺激剂(PMA)、离子霉素、布雷杆菌A(BFA)等均购自美国Sigma公司,胎牛血清购自美国HyClone公司。
1.2CD8+T细胞分组及激活外周血单个核细胞(PBMC)的分离、CD8+T细胞的获取及培养见参考文献[8]。将获得的CD8+T细胞分为对照组和实验组,对照组加入CD3/CD28激活微珠,以淋巴细胞∶CD3/CD28激活微珠=2∶1的比例(数量比)激活CD8+T淋巴细胞[9-10]。实验组在加入同样活化微珠的同时加入50 μmol/L LY3039478。继续培养0~72 h后进行以下实验。
1.32组细胞表面免疫检查点的检测分别收集培养0、24、48、72 h后的2组细胞,PBS洗涤2次,1 500 r/min离心5 min,弃上清后避光加入CD8-APC-Cy7、PD-1-PE-Cy7、TIM-3-PE抗体,4 ℃孵育15 min,上流式细胞仪检测。实验重复3次。
1.42组细胞内功能性细胞因子和Ki-67的检测分别收集培养48和72 h后的2组细胞,调整细胞密度为1×106个/mL,分别加入50 μg/L的PMA和750 μg/L的离子霉素,置于培养箱中孵育3 h,加入BFA 1 mg/L[11],充分混合,继续培养4 h。收取细胞于1.5 mL离心管中,PBS洗涤2次,1 500 r/min离心5 min,弃上清后避光加入APC-CY7-CD8抗体,4 ℃孵育15 min,离心弃上清,每管加入400 μL固定剂重悬细胞,4 ℃避光孵育30 min,离心弃上清,加入400 μL破膜剂,4 ℃避光孵育30 min,离心弃上清,对应管加入IFN-γ、IL-2、GZMB和Ki-67抗体,4 ℃避光孵育15 min,上流式细胞仪检测。实验重复3次。
1.5统计学处理采用SPSS 17.0进行数据分析。应用析因设计的方差分析比较不同时间点2组细胞中PD-1、Tim-3表达的差异,应用;两独立样本t检验比较2组细胞中GZMB、IFN-γ、IL-2、Ki-67表达的差异,检验水准α=0.05。
2 结果
2.12组CD8+T细胞PD-1和Tim-3表达的比较见表1。由表1可知,随着活化时间的延长,2组细胞PD-1、TIM-3的表达均增加;与对照组相比,实验组CD8+T细胞PD-1和TIM-3的表达明显降低。
表1不同时间点2组CD8+T细胞PD-1和TIM-3的表达(n=3)
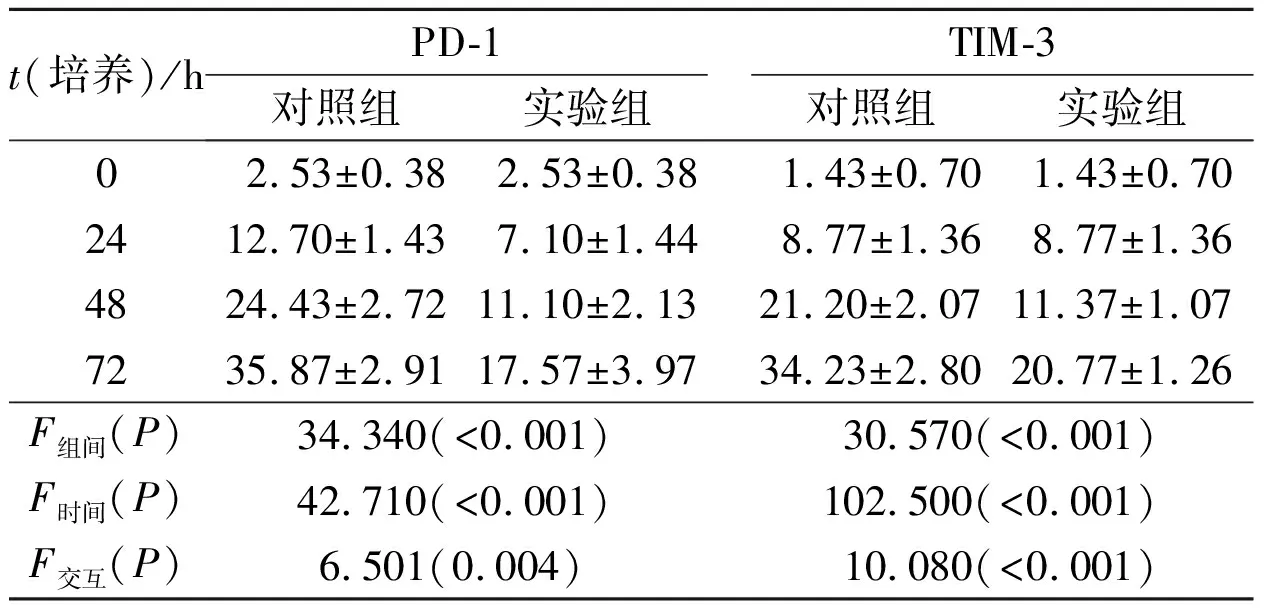
t(培养)/hPD-1对照组实验组TIM-3对照组实验组02.53±0.382.53±0.381.43±0.701.43±0.702412.70±1.437.10±1.448.77±1.368.77±1.364824.43±2.7211.10±2.1321.20±2.0711.37±1.077235.87±2.9117.57±3.9734.23±2.8020.77±1.26F组间(P)34.340(<0.001)30.570(<0.001)F时间(P)42.710(<0.001)102.500(<0.001)F交互(P)6.501(0.004)10.080(<0.001)
2.22组CD8+T细胞功能性细胞因子和Ki-67表达的比较见图1、表2。与对照组相比,实验组CD8+T细胞中GZMB、IFN-γ、 IL-2和Ki-67的表达均明显下降。

图1 2组CD8+T细胞功能性细胞因子和Ki-67的表达
表22组CD8+T细胞功能性细胞因子和Ki-67的表达(n=3)
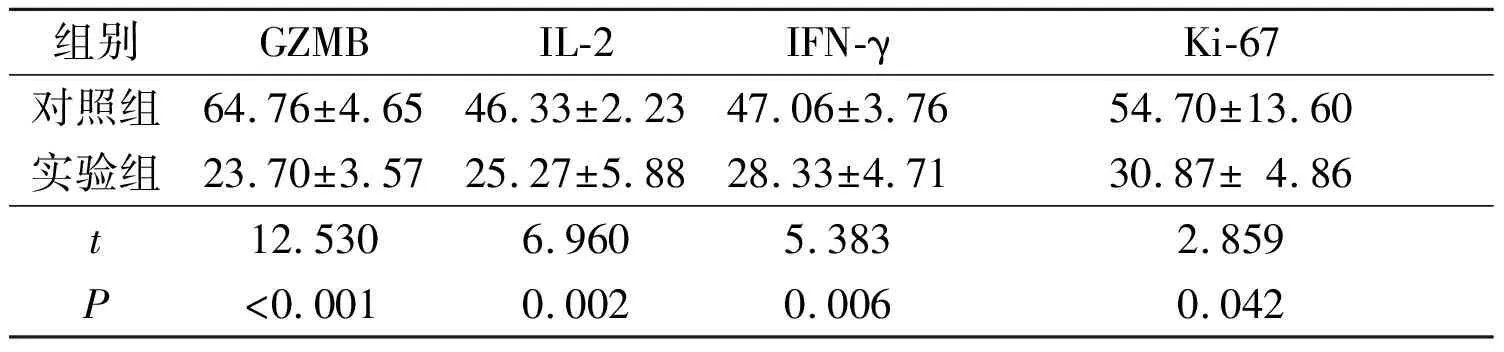
组别GZMBIL-2IFN-γKi-67对照组64.76±4.6546.33±2.2347.06±3.7654.70±13.60实验组23.70±3.5725.27±5.8828.33±4.7130.87±4.86t12.5306.9605.3832.859P<0.0010.0020.0060.042
3 讨论
Notch是广泛存在于多种细胞表面的跨膜受体蛋白,在哺乳动物中存在4种Notch受体(Notch1~4)和5种Notch配体(Delta-like1、3、4和Jagged1、2),其中Notch1的研究最为广泛[12]。邻近细胞的配体和受体相互作用后Notch1信号通路被激活,激活后的Notch1蛋白经过剪切形成胞内段,在哺乳动物中胞内段和RBP-JK结合形成复合体,后进入胞核作为转录因子促进下游基因的转录[13]。Notch1信号通路异常与肿瘤的发生、发展密切相关。如在急性淋巴细胞白血病(T-ALL)中普遍存在Notch1的突变,γ分泌酶抑制剂可以抑制Notch1胞内段的剪切释放,在不改变Notch1本身表达水平的情况下抑制其下游靶基因的表达,能有效地阻碍Notch1信号通路的活化,抑制其致癌作用[14]。此外在实体瘤如肺癌、宫颈癌、胶质瘤等中也常见Notch1的异常表达,其对肿瘤的代谢、生长、周期等过程都起到调控作用[15]。
Notch1信号通路在T细胞中的研究主要集中在CD4+T细胞,包括调控CD4+T细胞的分化、增殖以及影响多种细胞因子的产生,虽然结果不尽相同,但是大部分研究[16-17]表明Th2细胞的分化依赖于Notch1信号通路,敲除RBP-JK可促进CD4+T淋巴细胞向Th1亚型分化。CD8+T细胞作为最重要的抗肿瘤免疫细胞,可以通过直接接触杀伤肿瘤细胞,也可以通过间接分泌GZMB、IFN-γ、IL-2等细胞因子发挥生物学功能。Notch1信号通路对CD8+T细胞功能的影响也存在争议,有研究[5, 18]发现Notch1信号通路促进效应性CD8+T细胞的增殖和活化,但也有研究[7]表明在条件敲除Notch1的小鼠中CD8+T细胞的增殖和激活并未有明显改变。本研究发现抑制Notch1信号通路可以抑制CD8+T细胞的增殖,功能性细胞因子的产生也明显降低,提示Notch1信号通路的激活促进了CD8+T细胞的功能,利于其抗肿瘤作用的发挥。
免疫检查点是重要的免疫抑制分子,在初始T细胞表面基本不表达,但在T细胞活化后其表达明显上调;免疫检查点与其相应配体合后,产生抑制性信号,负向调节活化性T细胞的功能,从而抑制免疫应答[19]。在肿瘤及慢性病毒感染患者中,感染的基质细胞及肿瘤细胞表达PD-L1,与表达PD-1的CD8+T细胞相互作用后导致T细胞功能耗竭[20]。本研究结果显示在抑制Notch1信号通路后CD8+T免疫检查点的表达下降。
综上所述,Notch1信号通路在T细胞活化、功能和增殖方面有重要的调控作用。
