MIP-3α-SA双功能融合蛋白的制备及其生物学功能鉴定
2019-06-03宋志纯戴数王朋高基民
宋志纯,戴数,王朋,高基民
(1.丽水市人民医院 检验科,浙江 丽水 323000;2.温州医科大学 检验医学院 生命科学学院,浙江 温州 325035)
恶性肿瘤严重威胁人类健康,我国每年新发肿瘤病例达430余万例,死亡280多万例[1],肿瘤疫苗可诱发自身特异性免疫应答,抑制并清除肿瘤[2],因特异性高、针对性强、不良反应小、安全稳定,已经成为恶性肿瘤治疗的重要方法。通过基因修饰、细胞表面锚定修饰将细胞因子修饰到肿瘤细胞是肿瘤疫苗新的发展方向[3]。
巨噬细胞炎性蛋白3α(macrophage inflammatory protein-3α,MIP-3α)又称CCL20,可参与树突状细胞、T细胞的定向迁移,在肿瘤免疫方面发挥作用[4]。它的转基因细胞能诱导肿瘤特异性细胞免疫,抑制肿瘤生长、延长荷瘤小鼠的生存期[5]。另外,瘤内直接注射MIP-3α可使DC和CD8+T细胞浸润到肿瘤实质内,抑制肿瘤生长的作用显著[6]。链亲和素(streptavidin,SA)是由链霉菌分泌的四聚体蛋白,能与生物素快速紧密不可逆结合,其结合力比抗原抗体间的亲和力高1万倍,可应用于生物医学的诸多领域[7]。
利用肿瘤细胞表面极易生物素化及SA能与生物素高效而超强结合的特性[8],我们制备了SA标记的MIP-3α融合蛋白,使其锚定在已生物素化的肿瘤细胞表面,并产生有效的抗肿瘤免疫作用。基于人与鼠的氨基酸同源性为73%,而该肿瘤细胞疫苗的抗肿瘤效应需要在小鼠体内进行检测,为此我们构建了MIP-3α-SA-PET21重组表达载体,并在大肠杆菌内高效诱导表达获得融合蛋白,经纯化、复性后对其生物学活性进行了研究。该研究为MIP-3α表面锚定修饰的肿瘤细胞疫苗提供了实验基础,为后续的临床实验提供了依据。
1 材料和方法
1.1 材料
1.1.1 菌株和细胞:E.coliRosetta(DE3)、DH5α购自北京Novagen公司,MIP-3α-SA-PET21质粒及RM-1细胞由本实验室保存。
1.1.2 试剂:IPTG及氨苄霉素、青链霉素、氯霉素购自美国Sigma公司,Sulfo-NHS-L C-Biotn购自美国Pierce公司,Ni-NTA螯合层析填料购自德国Qiagen公司,Transwell趋化小室购自美国Corning公司,抗-HIS单克隆抗体、辣根过氧化物酶标记羊抗鼠IgG、FITC标记羊抗鼠IgG、DAB显色试剂盒、硝酸纤维素膜均购自上海碧云天公司,胎牛血清及RPMI1640培养基购自杭州四季青生物工程材料有限公司,MIP-3α购自德国Bender公司,BSA购自瑞典Maverick公司,蛋白质预染marker购自加拿大Fermentas公司。
1.2 方法
1.2.1 MIP-3α-SA融合蛋白的诱导表达:感受态细胞制备及质粒转化按常规CaC12法,将MIP-3α-SAPET21质粒转化Rosetta(DE3)感受态细胞,用氨苄青霉素(终浓度50 mg/L)的平皿筛选转化后的细菌。随机挑选单克隆菌落,37 ℃于含相应抗生素的LB培养基中培养,待OD600值=0.4~0.6时加入IPTG诱导,摸索最佳诱导浓度及时间,用12% SDS-PAGE筛选表达情况。
1.2.2 包涵体的提取:分别用以下2种方法破碎包涵体并比较其效果:①菌体按1:20(w/v)重悬于超声缓冲液(50 mmol/L Tris-HC1、1 mmol/L EDTA、10 mmol/L NaCl)中,冰浴并超声破菌,收集包涵体;②菌体按1:20(w/v)重悬于PBS缓冲液(200 mg/mL溶菌酶)中,冰浴并高压破菌,收集包涵体。用专用洗涤液(专利号CN1169998A)洗涤,离心弃去上清,收集包涵体。
1.2.3 MIP-3α-SA融合蛋白的纯化:镍柱亲和层析纯化:包涵体用溶解液(20 mmol/L Tris-HC1,8 mol/L尿素,5 mmol/L β-ME)溶解,离心弃去沉淀,过滤除菌后将上清液上样于Ni-NTA柱,镍柱用平衡液(20 mmol/L Tris-HC1,6 mol/L尿素,5 mmol/L β-ME,500 mmol/L NaC1)先平衡,上清用平衡液稀释2倍上柱,然后依次用含50、75及150 mmol/L咪唑的平衡液洗脱,收集不同咪唑浓度洗脱峰,用12% SDS-PAG分析蛋白纯化情况。
1.2.4 MIP-3α-SA融合蛋白的复性:将纯化后的蛋白调整浓度至0.1~0.2 g/L,在透析液(20 mmol/L Tris-HC1,4 mol/L尿素,50 mmol/L NaC1,1 mmol/L GSH,0.2 mmol/L GSSG,50 mL/L甘油,0.5 mmol/L EDTA)中4 ℃透析复性12 h,依次降低透析液浓度,最后在PBS中继续透析复性12 h。离心除去不溶物,上清经过滤除菌,分装于-70 ℃保存。10% SDSPAGE分析蛋白复性情况。
1.2.5 Western blot分析:用12% SDS-PAGE电泳分离复性后蛋白,半干电转仪将蛋白转移至硝酸纤维素膜上,用50 mL/L的脱脂奶粉于室温下封闭1.5 h,加入抗-HIS单克隆抗体(mAb 1:1 000稀释)4 ℃过夜,TBST洗涤,加入辣根过氧化物酶标记羊抗鼠IgG二抗(1:1 000稀释),37 ℃孵育1 h,DAB显色液观察结果。
1.2.6 银氨染色:用12% SDS-PAGE电泳分离复性后蛋白,将整块PAGE凝胶转移至50%甲醛及10%醋酸混合液中浸泡1 h,脱色漂洗,用银氨染色液(0.8 g 硝酸银溶于4 mL蒸馏水中逐滴加入0.36% NaOH 21 mL于14.8 mmol/L氨水中)染色并洗涤液(0.5 mL 1%柠檬酸和50 μL 38%甲醛混合,加水至100 mL)中洗涤,待显色后用1%醋酸终止反应并观察结果。
1.2.7 MIP-3α-SA融合蛋白的趋化活性测定:①人淋巴细胞的准备:淋巴细胞分离液分离人血淋巴细胞,细胞浓度调整为2×106/mL重悬于无血清的1640培养基中备用;②MIP-3α-SA的准备:将-70 ℃保存的MIP-3α-SA用PBS分别稀释为不同浓度(1 000 ng/mL、 100 ng/mL、10 ng/mL、1 ng/mL、0.1 ng/mL),PBS为空白对照;③加入MIP-3α-SA:将稀释好后37 ℃预温的MIP-3α-SA样品加入Costar 3422微孔趋化板的下槽中,每个浓度MIP-3α-SA加3个复孔,每孔 600 μL,装上上槽小室,MIP-3α做阳性对照;④加入人淋巴细胞:将稀释好的人淋巴细胞悬液加入上槽小孔中,每孔100 μL;⑤孵育:将趋化小室放入37 ℃,5% CO2培养箱中,孵育3~4 h;⑥计数:将趋化小室下层细胞充分混匀,计数各孔细胞数并计算趋化指数(chemo tactic index,CI:是指细胞迁移到待测样品液的数目和迁移到空白对照液的数目的比值)。CI=实验组趋化的细胞数/阴性对照组趋化的细胞数。
1.2.8 MIP-3α-SA融合蛋白对肿瘤细胞表面锚定修饰效率的检测:取生长状态良好的RM-1细胞,调整细胞浓度至5×109/L,加入Sulfo-NHS-LC-Biotin使终浓度为1 g/L,37 ℃,30 min;PBS洗涤,加入MIP- 3α-SA,37 ℃,60 min;PBS洗涤,加入抗MIP-3α抗体,37 ℃,30 min;PBS洗涤,加入FITC标记的二抗,37 ℃,避光30 min;500 μL PBS重悬,流式细胞仪分析MIP-3α-SA融合蛋白对肿瘤细胞的锚定修饰效率。
2 结果
2.1 MIP-3α-SA融合蛋白的诱导表达 将MIP-3α-SAPET21重组表达质粒转入大肠杆菌Rosetta(DE3)中,经IPTG筛选后获得工程菌,经12% SDS-PAGE电泳检测证实在相对分子质量31 kDa处有蛋白带,与预测的目的蛋白相对分子质量相符。而未经诱导的工程菌在同一位置未见蛋白带。BandScan软件分析得出目的蛋白约占总蛋白的30%。表达菌破碎后(见图1),分析上清或包涵体表达:证明目的蛋白主要以包涵体形式存在。分析不同浓度IPTG(见图2A)和相同浓度IPTG不同时间(见图2B)的诱导表达情况:证明IPTG终浓度0.3 mmol/L,诱导时间5 h为最佳。
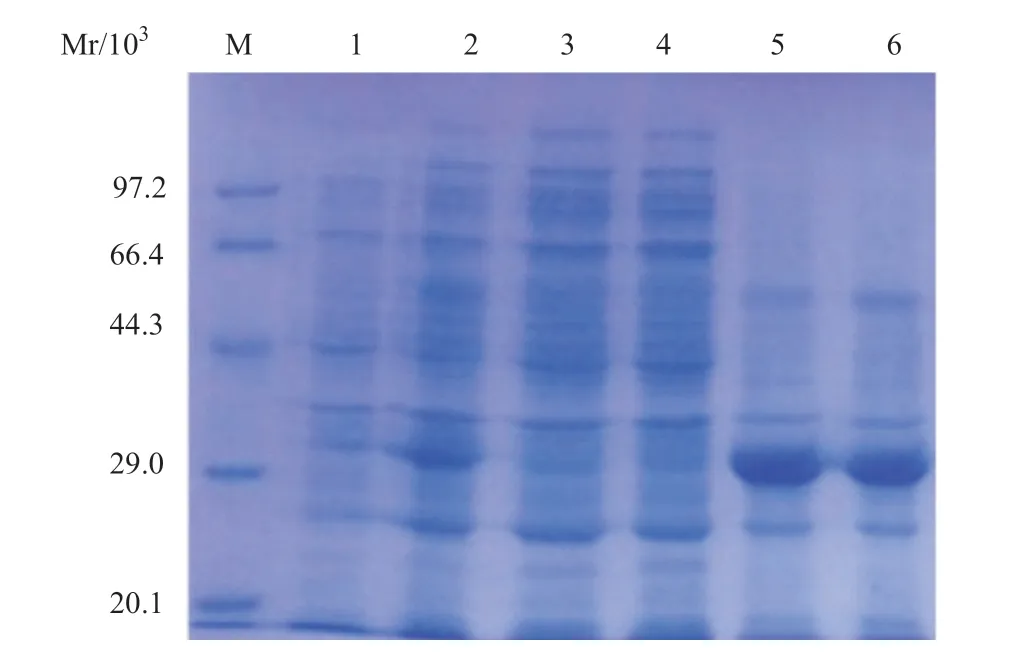
图1 12% SDS-PAGE鉴定MIP-3α-SA融合蛋白的诱导表达
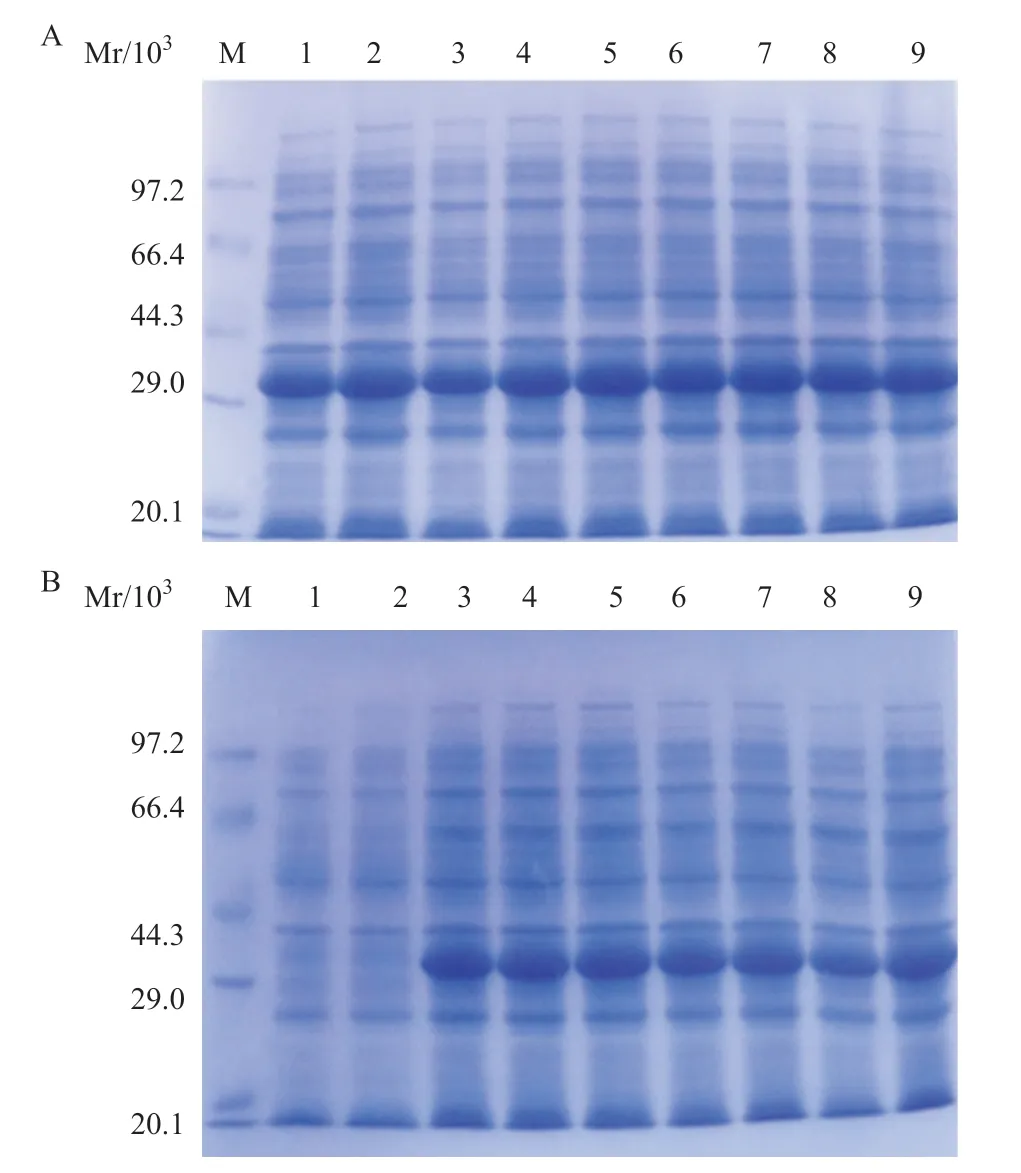
图2 12% SDS-PAGE鉴定MIP-3α-SA融合蛋白的表达情况
2.2 包涵体的提取及MIP-3α-SA融合蛋白的纯化 比较2种方法进行包涵体的提取,镍柱亲和层析,12% SDS-PAGE鉴定结果显示:加入溶菌酶后,挂柱效果佳(见图3A-B),包涵体洗涤后经过镍柱亲和层析,杂蛋白主要被穿透和50 mmol/L咪唑洗脱出,从峰值图(见图4)上可以看到目的蛋白在75 mmol/L咪唑浓度下被洗脱,且纯度和浓度最高,其中纯度达到95%以上(见图5A-B)。

图3 12% SDS-PAGE鉴定MIP-3α-SA融合蛋白纯化情况

图4 MIP-3α-SA融合蛋白镍柱亲和层析AKTA峰值图
2.3 MIP-3α-SA融合蛋白的复性 采用尿素梯度透析复性,复性后非还原状态的融合蛋白主要以多聚体的形式存在(见图6A-B)。
2.4 MIP-3α-SA融合蛋白的Western blot分析和银氨染色 Western blot结果证实,MIP-3α-SA融合蛋白纯化后,复性后蛋白质单体与多聚体均可与抗-HIS抗体结合,并显色(见图7A);银氨染色结果证实,第一泳道marker条带经银离子染色后显示出多条杂带,而目的蛋白复性后经染色显示为单一条带(见图7B)。
2.5 趋化活性测定 利用人淋巴细胞趋化实验,发现不同浓度的MIP-3α-SA有趋化人血淋巴细胞的活性且成剂量依赖效应,其中100 ng/mL趋化活性最高,之后提高MIP-3α-SA融合蛋白浓度趋化活性反而减低(见表1和图8)。

图5 12% SDS-PAGE电泳鉴定MIP-3α-SA融合蛋白镍柱亲和层析纯化图
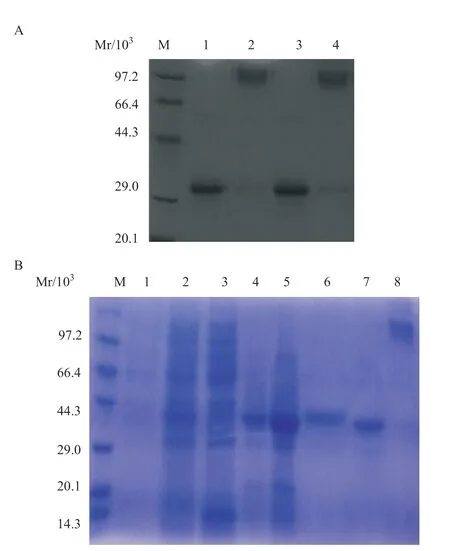
图6 SDS-PAGE电泳鉴定MIP-3α-SA融合蛋白复性图
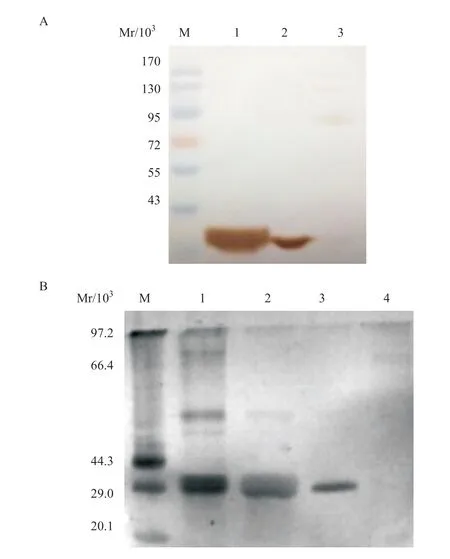
图7 MIP-3α-SA融合蛋白的Western blot分析(A)和银氨染色(B)
2.6 FCM分析 用MIP-3α的抗体及荧光标记的二抗,经FCM对锚定在已生物素化的RM-1肿瘤细胞表面的MIP-3α-SA融合蛋白进行检测,结果显示:MIP-3α-SA融合蛋白能高效锚定修饰表面已生物素化的RM-1肿瘤细胞,修饰效率为99.7%(见图9)。左图峰为未修饰的细胞(阴性对照),而右峰为MIP-3α-SA融合蛋白锚定修饰的细胞。
3 讨论
目前CCL20 应用于肿瘤治疗的常用研究方法有:①单一趋化因子的疗法:将趋化因子导入肿瘤环境中在体内可招募相关的白细胞亚群,减少恶性细胞的肿瘤形成,目前我们课题组正在致力于应用链亲和素标记的CCL20治疗前列腺癌及膀胱癌等的研究,CCL20可以较强地趋化未成熟的DC细胞,将CCL20腺病毒注射入不同的肿瘤模型(B16黑色毒瘤细胞,Lewis肺细胞癌等)较明显地抑制了肿瘤的生长并增加了肿瘤宿主特异性存活。CCL20腺病毒注射可刺激局部CD8+细胞明显聚集,激活细胞毒T细胞,进而抵抗肿瘤细胞[5],其具体的机制还有待进一步的研究。②共同应用2种趋化因子或细胞因子与趋化因子结合治疗的疗法:目前国外有文献报道,联合应用CCL3和CCL20对小鼠胃癌有积极的治疗作用[9];另外CXCL9与IL-12联合应用也取得明显的抑瘤效果,将趋化因子与活化的细胞因子联合用于肿瘤微环境中,可以诱导强烈的抗肿瘤反应并能明显地减少系统地使用细胞因子所致的剂量限制性毒性作用;而我们课题组已经研究出链亲和素标记的sCD40L[10]、TNFα[11]、白介素系列[12-14]蛋白对不同肿瘤的治疗作用,而CCL20与其中两两联合还有待进一步实验,且其相应的机制还有待研究。③趋化因子与肿瘤相关抗原(TSA)相融合:我们研究的CCL20是否也有与相应的白介素甚至GM-CSF结合发挥抗肿瘤作用,有待进一步的探讨。④肿瘤疫苗:将趋化因子导入肿瘤环境中在体内可招募相关的白细胞亚群,减少恶性细胞的肿瘤形成,将趋化因子与其他免疫刺激细胞因子结合可提供较强的长期抗肿瘤免疫。因此,趋化因子也许作为潜在的天然佐剂而应用于试验性抗肿瘤免疫治疗即肿瘤疫苗。然而,目前国内外尚无CCL20与细胞因子联合应用治疗肿瘤的相关报道,因而CCL20联合其他细胞因子治疗肿瘤的应用前景尚有待进一步研究。⑤CCL20联合放射治疗:应用于肿瘤治疗放射治疗一直是恶性肿瘤的主要治疗方法之一,但是无论治疗的条件如何优化,其疗效始终难有突破性的提高。目前将CCL20基因串联到早期生长反应启动子(Egr21)下游,构建Egr21启动的CCL20真核表达载体并转染Lewis肺癌细胞,通过放射诱导使肿瘤细胞中CCL20表达增强,有效趋化树突状细胞及淋巴细胞产生抗肿瘤治疗效应,是对放射-基因治疗新的尝试[15-16]。

表1 MIP-3α-SA双功能融合蛋白趋化实验结果
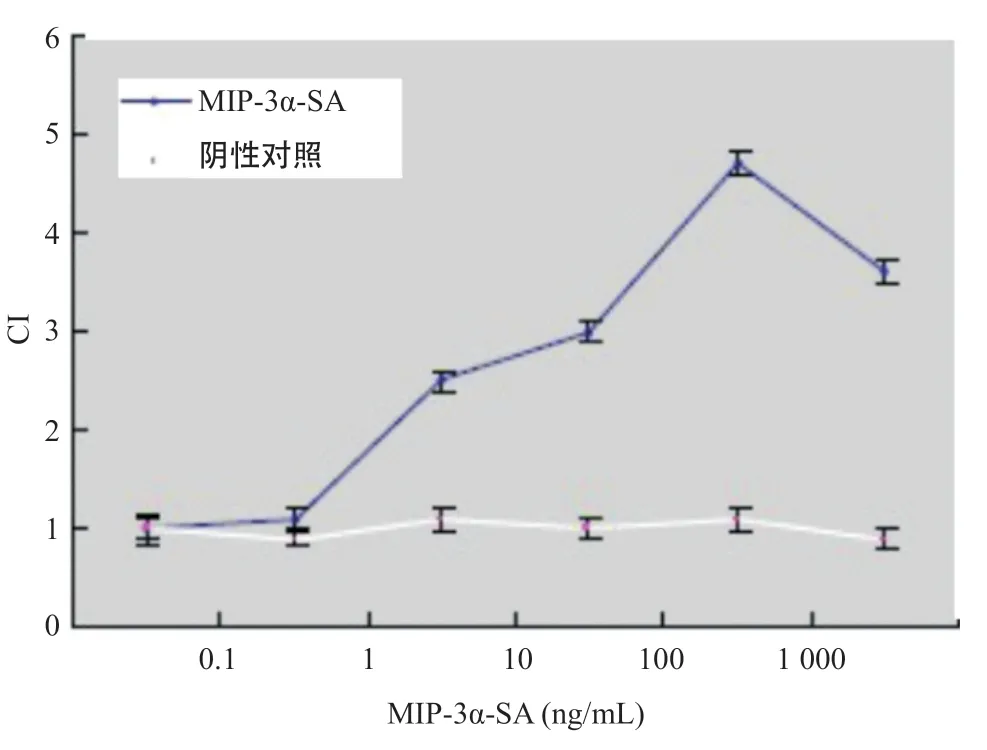
图8 MIP-3α-SA双功能融合蛋白淋巴细胞趋化效率

图9 FCM分析MIP-3α-SA融合蛋白对已生物素化的RM-1肿瘤细胞锚定图
本研究基于本实验室建立的细胞膜表面锚定修饰技术平台,利用该平台制备了一系列链亲和素连接的多种具有免疫佐剂作用的免疫刺激因子制备双功能融合蛋白[10-14],发挥其生物学活性,并诱发机体产生特异性主动免疫,已取得了良好成效。并且部分蛋白已建立了中试制备工艺,该平台具有简便快捷、高效,对细胞、组织,机体无明显的毒副作用等特点。本研究利用人淋巴细胞趋化实验,发现不同浓度的MIP-3α-SA有趋化人血淋巴细胞的活性且成剂量依赖效应,其中100 ng/mL趋化活性最高,之后提高MIP-3α-SA融合蛋白浓度趋化活性反而减低,猜测不同剂量的MIP-3α-SA对肿瘤的作用不同;有研究报道MIP-3α的表达可能参与了肺癌的侵袭及淋巴结转移,可能的机制为:MIP-3α与其受体CCR6结合后,引发细胞内骨架蛋白的重新分布,调节肿瘤细胞迁移,促进肿瘤细胞的侵袭与转移[17]。因而不同剂量的MIP-3α对肿瘤的促进还是抑制作用还有待进一步实验,而探索合适的药物剂量是今后研究的趋势。
目前,我们已研发出部分SA标记的可用于锚定修饰的膀胱癌及前列腺癌治疗性疫苗。研究证明:SA标记的细胞因子双功能融合蛋白锚定修饰的表浅膀胱癌瘤苗可诱导小鼠机体产生有效的抗肿瘤作用,并且能有效防治表浅膀胱癌的复发[18-21]。
利用基因重组技术,我们构建了MIP-3α-SAPET21重组表达质粒,在C端设计了6×His标签使后期更利于镍亲和层析制备高纯度的双功能融合蛋白;SA和MIP-3α之间靠甘氨酸和丝氨酸的15肽连接,使各单元蛋白质分子独立折叠,保留各自生物学活性。我们制备的融合蛋白能够在大肠杆菌中高效表达,纯化后通过尿素梯度透析复性,经人淋巴细胞趋化实验验证了MIP-3α-SA融合蛋白有MIP-3α介导的对人淋巴细胞的趋化作用且呈剂量依附性,以及SA介导的高效结合至表面已生物素化的小鼠前列腺癌RM-1细胞的功能(表面锚定修饰效率大于95%),以上研究为今后肿瘤防治以及新型肿瘤疫苗研制奠定了坚实的基础。
