黄铁矿强化零价铁去除Orange II研究
2019-05-23李益民
陈 昆 李益民
(绍兴文理学院 化学化工学院,浙江 绍兴 312000)
0 引言
染料广泛用于纺织、塑料、皮革、化妆品等行业,据估计目前全球染料产量已达160万吨左右[1-2],其中约2/3属于合成的偶氮染料.在生产和使用过程中约有10%~15%的染料会排放到水体中,偶氮染料废水因其组分复杂、色度大、毒性强,是一类较难降解的工业废水.常用的废水染料处理方法主要分为物理法[3-4]、化学法[5-7]和生物法[8-10].物理法不能彻底降解污染,化学法成本过高,而生物法降解缓慢.因此寻求一种成本低廉、高效的处理技术是节能减排急需解决的重要课题之一.
黄铁矿(FeS2,Pyrite)广泛存在于厌氧环境中,是地壳中分布最广的硫化物.黄铁矿具有一定的还原能力,可以还原Cr(VI)、Se(IV/VI)和TCE等污染物[26-30],但其电极电势(+0.35 V)高于ZVI,所以在一般情况下,其还原性能明显低于ZVI[31].但黄铁矿与Fe(III)、O2等氧化剂反应会产生具有高还原活性的Fe(II),并释放出能降低介质pH值的H+,从而可减少ZVI表面钝化产物的生成.反应方程式如下:
(1)
(2)
本文将价廉的黄铁矿(pyrite)与零价铁混合,用于处理合成废水中常用偶氮染料Orange II,研究了介质的pH值、pyrite/ZVI质量比对Orange II去除率的影响,并对协同反应机理进行了初步探讨.
1 实验
1.1 材料与试剂
零价铁购自Aladdin;黄铁矿来源于广东英德,X射线荧光光谱分析(X-ray fluorescence,XRF)表明,pyrite中Fe/S的比例接近1∶2,pyrite中FeS2的质量分数为97.14%.黄铁矿和零价铁粉经粉碎后过筛,取300~400目部分,用超纯水和无水乙醇洗去表面小颗粒,再经超纯水清洗,真空冷冻干燥后备用.实验所用其他试剂均为分析纯,实验用水为去离子水.
偶氮染料Orange II购自Acros Orangics USA,其结构式如图1所示:

图1 Orange II的化学结构式
1.2 实验方法
在一组250 mL的碘量瓶中盛入150 mL初始浓度为5×10-5mol/L的Orange II溶液(pH值实验除外,pH=7),通N230 min后,分别加入一定量的ZVI、pyrite、不同质量比的pyrite和ZVI,盖塞加铝箔圈密封后置于恒温气浴振荡器中,在25±0.2 ℃、250 r/min振荡,定时取样,经0.45 μm的滤膜过滤后,在486 nm处测量样品溶液的吸光度.溶液的pH值均用0.01 mol/L HCl或0.01 mol/L NaOH调节.所有实验重复两次.
1.3 分析方法
Orange II浓度与吸收光谱在紫外-可见分光光度计(尤尼克(上海)仪器有限公司,UV-2800)上测定.固体样品元素分布及含量通过JEM-1011扫描电镜(SEM)-能量色散X射线光谱(EDS)获得,加速电压为30 kV.
2 结果与讨论
2.1 黄铁矿对零价铁去除Orange II 的影响
图2为初始pH=7.0,0.5 g/L ZVI、1 g/L pyrite和不同pyrite/ZVI质量比体系去除5×10-5mol/L Orange II的反应动力学行为.由图2可见,反应180 min后,ZVI对Orange II的去除率仅为13%,pyrite对Orange II去除率接近0;而当ZVI体系中加入了pyrite后,其去除率明显提高,并且随着pyrite的加入量增加,对Orange II 的去除率增大.在60 min时,质量比分别为0.5、1、2、4的pyrite/ZVI体系对Orange II去除率分别达到了57.4%、79.4%、91.7%和95.1%. 120 min时,所有pyrite/ZVI混合体系中Orange II几乎被完全去除.可见,所有pyrite/ZVI复合体系对Orange II的去除率远高于相应pyrite和ZVI分别对Orange II去除率的加和,显示了明显的协同效应.

图2 ZVI、pyrite和pyrite/ZVI复合体系对Orange II的去除
图3是ZVI(0.5 g/L)/pyrite(2 g/L)与Orange II反应时间为0 min、20 min、60 min、120 min时的紫外-可见(UV-VIS)吸收光谱的变化.图中的231 nm、312 nm和486 nm是Orange II的三个特征吸收峰[32],其中231 nm和312 nm分别对应了苯环偶氮键、萘环偶氮键的吸收峰,而486 nm处的吸收峰是由苯环和萘环通过偶氮双键相连所构成的整个共轭体系所引起的.在Orange II与ZVI/pyrite反应120 min时,位于231 nm、312 nm和486 nm处的吸收峰均消失,而在251 nm处出现了新吸收峰,表明分子中的偶氮键被破坏.这些光谱的变化证明染料的脱色是通过N=N还原断键反应造成的.
2.2 初始pH值对Orange II去除的影响
为了探究初始pH值对ZVI、pyrite、ZVI/pyrite体系去除Orange II的影响,考察了在6个不同初始pH值(5.0、6.0、7.0、8.0、9.0、10.0)的介质中,体系对Orange II去除的影响,实验结果如图4所示.
由图4可知,随着初始pH值的增大,ZVI去除Orange II 的能力逐渐减小.在反应180 min后,在初始pH=5.0、6.0、7.0、8.0、9.0、10.0时,ZVI对Orange II的去除率分别为55.4%、15.8%、13.3%、11.7%、11.7%、3.4%.这是因为ZVI与Orange II 反应时H+作为反应物[1,32],随着反应的进行,H+不断消耗而导致介质pH值的升高,零价铁被氧化而生成的氧化物和氢氧化物逐渐增加,并附着在零价铁表面,进而抑制了内核ZVI与Orange II反应,降低了ZVI对Orange II的去除率.所以反应介质的pH值对Orange II的去除有着重要的影响,pH值越小越有利于去除Orange II.

图3 ZVI(0.5 g/L)/pyrite(2 g/L)与Orange II在不同反应时间的吸收光谱

图4 不同pH值下ZVI、pyrite、pyrite/ZVI体系对Orange II去除率的影响
Fe→Fe2++2e-,
(3)
R1N= NR2+4H++4e-→R1-NH2+R2-NH2.
(4)
对于ZVI/pyrite体系,介质初始pH值对去除Orange II的影响很小;在初始pH=10.0时,该体系对Orange II的去除率仍能达到99%.
2.3 零价铁/黄铁矿与Orange II反应动力学研究
与Orange II反应时间段内(0~60 min),在对ZVI体系、各种混合比的pyrite/ZVI体系以及在不同初始pH值下各体系染料浓度的变化进行拟合,表明各种体系与Orange II反应符合拟一级反应动力学方程,其表观反应速度常数(kobs)见图5.由图5a可知,在初始pH=7.0,pyrite/ZVI质量比为1~4时,与Orange II反应的表观速率常数是相应零价铁的9.36~28.0倍;表明铁量固定,黄铁矿量加入越多,对Orange II还原去除越快.图5b表明,随着初始pH值从6.0增加到10.0,kobs从40.910-3降至31.210-3min-1,说明介质初始pH值越低越有利于Orange II的去除;但在初始pH=10.0时,复合体系仍能维持较高的动力学常数,而零价铁与Orange II已几乎不能反应.由此可见,在零价铁中加入黄铁矿能在更宽的pH值范围内有效去除Orange II.
3 强化作用机理初探
3.1 黄铁矿能显著抑制反应过程中pH值的升高
式(4)表明,ZVI去除Orange II的过程是一个消耗H+的反应,反应介质pH值的升高导致了铁表面生成铁(氢)氧化物钝化产物,抑制了ZVI与Orange II继续反应,因此介质中的pH值是影响ZVI去除Orange II的重要因素.

图5 a.不同质量比pyrite/ZVI(pH0=7.0,0.5 g/LZVI),b.不同初始pH0下(0.5 g/L ZVI,2.0 g/Lpyrite)去除Orange II的拟一级动力学反应速率常数
图6是初始pH=5.0、6.0、7.0、8.0、9.0和10.0时,ZVI和ZVI/pyrite体系反应过程pH的变化.由图6可见,在实验条件下,ZVI/pyrite体系的pH都小于相应的ZVI体系,即pyrite的加入能有效抑制的pH值的升高.这是因为ZVI/pyrite体系中的pyrite能与反应过程中生成的Fe(III)反应,如反应方程(1)所示,产生的H+促进了ZVI与Orange II反应.在这个反应式中Fe(III)起到了氧化黄铁矿的作用,而单独pyrite很难还原Orange II.
3.2 黄铁矿能促进高还原活性Fe(II)的生成
众多研究表明,铁氧化物或铁硫化物上吸附态的Fe(II),其还原电位明显低于游离态的Fe(II)[33],因而具有更强的还原活性.有研究证明,ZVI/pyrite体系在与硝基苯、Cr(VI)的反应时,体系中产生的Fe(II)是去除污染物的重要还原剂[34-35].由于体系中吸附态的Fe(II)极易与氧化剂Orange II反应,所以不能直接测量ZVI、pyrite、ZVI/pyrite与Orange II反应体系中的Fe(II)量.为此,我们进行如下模拟实验:在厌氧条件下,往初始pH=6.0和7.0的缓冲溶液中分别加入ZVI(0.5 g/L)、pyrite(2 g/L)、ZVI(0.5 g/L)/pyrite(2.0 g/L),然后在三个体系中分别缓慢滴加等量的Fe(III)溶液,反应后Fe(II)的含量如图7所示.
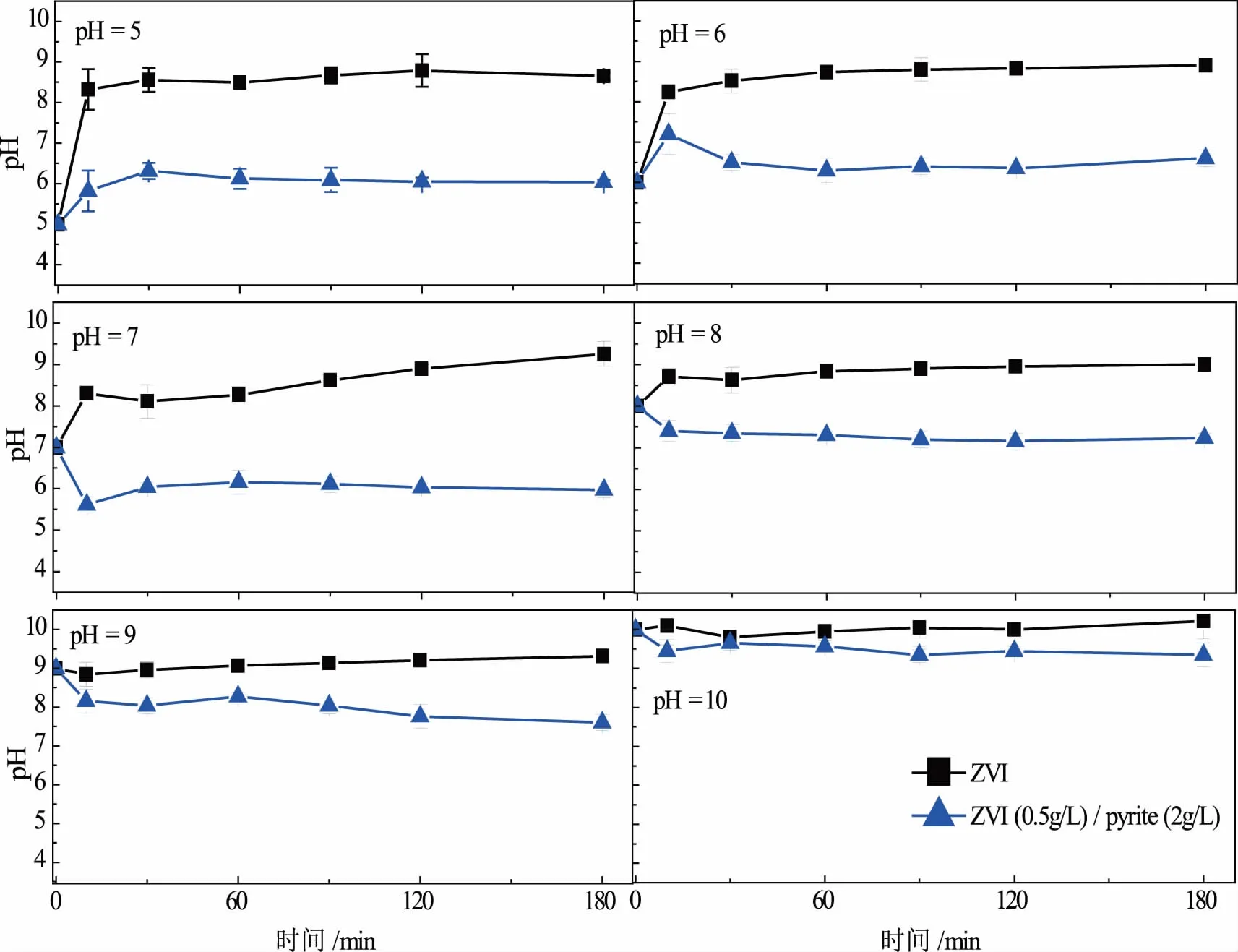
图6 不同初始pH值,ZVI和ZVI/pyrite体系反应过程中pH值的变化

图7 ZVI、pyrite、ZVI/pyrite体系与Fe(III)反应生成Fe(II)的含量
由图7可知,两种缓冲溶液(与混合反应体系的pH接近)与Fe(III)反应产生Fe(II)量的多少依次为:ZVI/pyrite>pyrite> ZVI,而且ZVI/pyrite体系产生的Fe(II)也大于后两者的加和,这表明ZVI/pyrite与Orange II反应过程中能够产
生更多的吸附在铁氧化物或黄铁矿上的Fe(II).
此外,图7还表明pyrite与Fe(III)反应产生Fe(II)的量明显大于ZVI体系,说明pyrite与Fe(III)反应生成Fe(II)的速率大于ZVI,这是因为在ZVI 表面生成的铁氧化物抑制了内核ZVI与Fe(III)反应.因此,ZVI/pyrite体系产生的更多Fe(II)主要来源于pyrite与Fe(III)的反应,即ZVI/pyrite体系中的Fe(II)与Fe(III)之间存在着如方程式(5)所示循环:

因为复合体系能够产生更多Fe(II),这解释了为什么在初始pH值为10.0时,在复合体系与零价铁体系反应过程中pH值相差不大的情况下,复合体系对Orange II有较好的去除率.
3.3反应前后ZVI和pyrite的SEM-EDS
图8和表1是通过SEM-EDS测得的ZVI、pyrite、ZVI/pyrite体系与Orange II反应前后相关样品的图谱及铁、氧、硫元素质量百分含量.

图8 反应前后不同样品的SEM-EDS图
表1 反应前后不同样品中各元素质量百分比 %

样品(编号)样品来源FeOSPyrite(a)反应前pyrite42.76.9250.4 Pyrite(b)2.0 g/L pyrite反应后40.57.3852.1 Pyrite(c)混合体系反应后pyrite36.325.338.4 ZVI(d)反应前ZVI97.03.030 ZVI(e)0.5 g/L ZVI反应后89.410.60 ZVI(f)混合体系反应后ZVI81.318.70
由图8和表1可见,反应前后的pyrite(图8(a),8(b))与反应后从ZVI(0.5 g/L)/pyrite(2 g/L)分离出的pyrite(图8(c)),其中硫含量分别为:50.4%、52.1%和38.4%,氧含量分别为:6.92%、7.38%和25.3%.由此可以发现,单独pyrite体系反应前后的硫和氧含量变化很小,这与图2 中pyrite几乎不能去除Orange II的实验结果相吻合;而ZVI/pyrite混合体系在反应后,pyrite中的硫含量明显减少,氧含量却显著增加.比较反应前后单一ZVI(图8(d),8(e))与ZVI/pyrite混合体系反应后分离出的ZVI中的氧含量和铁含量,ZVI/pyrite混合体系反应后氧含量明显增加,铁含量明显减少,这说明混合体系中有更多的ZVI与Orange II发生了反应.上述结果表明,混合体系中零价铁和pyrite在反应中单位质量的利用率得到显著提高.
4 结论
(1)相同实验条件下,ZVI/pyrite对Orange II去除率于远高于相同剂量pyrite和ZVI分别对Orange II去除率的加和.
(2)在零价铁中加入黄铁矿能在更宽的pH值范围内有效去除Orange II.
(3)ZVI/pyrite混合体系中零价铁和pyrite的单位质量的利用率显著提高.
(4)黄铁矿对零价铁去除Orange II中的强化作用主要是通过抑制介质中pH值的升高以及生成更多的还原活性Fe(II)完成.
