MicroRNA-433在非小细胞肺癌A549细胞增殖及迁移中的作用
2019-05-22郑庆凯张晓萍邵润霞
郑庆凯,张晓萍,邵润霞
(1.焦作市人民医院 呼吸内科,河南 焦作 454000;2.郑州大学第二附属医院呼吸内科, 河南 郑州 450014)
肺癌已成为人类癌症死亡的首要原因,其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%,由于临床缺乏早期有效诊断的生物学标志物,其5年生存率仍少于15%[1]。我国每年约有40 万人被确诊患有肺癌,且预计到2025年,人数将达到100 万人/年。因此,寻找能早期诊断的生物学标志物具有重要意义。
MicroRNA(miRNA)是一类长度约22 个核酸的非编码内源性小RNA,通过与目的基因的3'-非编码区(3'-UTR)相结合,调控靶基因的表达,从而参与调控个体发育、细胞凋亡、增殖及分化等生命活动[2]。研究表明,miRNAs 的异常表达与肺癌的发生、发展密切相 关,如miR-509-5p[3]、miR-512-5p[4]、miR-513[5]等。据报道,miR-433 在多种肿瘤中的表达下调,且发挥抑癌的作用,如口腔鳞状细胞癌[6]、结直肠癌[7]等,而其在肺癌中的表达及具体的作用机制尚未见报道,因此,本文旨在研究miR-433 对A549 细胞增殖及迁移的影响。
1 材料与方法
1.1 主要材料
NSCLC 细 胞 系A549、NCI-H1299、NCI-H358,人肺成纤维细胞系HFL1,HEK293 细胞等购自美国Abcam 公司;DMEM 培养基、10%胎牛血清、青霉素100 u/ml、链霉素100 mg/ml 购自美国Gibco 公司,miR-433 模拟物(miR-433 mimic)以及模拟物对照(mimic control)均由广州锐博生物科技有限公司合成,LipofectamineTM3000 购自Thermo Fisher Scientific,Trizol购自美国Invitorgen 公司,逆转录试剂盒、SYBR Premix Ex TaqTMⅡ试剂盒购自日本TaKaRa 公司,MTT、RIPA 裂解购自美国Sigma 公司,Transwell 小室购自美国BD Biosciences 公司,双荧光素酶报告基因检测试剂盒购自美国Promega 公司,兔抗人p21 活化激酶4 (p21-activated kinase 4,PAK4)、单丝氨酸蛋白激酶1(LIM domain kinase 1,LIMK1)、磷酸化单丝氨酸蛋白激酶1(phospho-LIM domain kinase 1,p-LIMK1)多克 隆抗体购自美国Abcam 公司,兔抗人丝切蛋白(Cofilin)和磷酸化丝切蛋白(p-cofilin)多克隆抗体购自美国CST 公司。
1.2 细胞培养
细胞均培养在含10%胎牛血清的DMEM 培养基中,于37℃、5%二氧化碳CO2培养箱中进行培养。根据生长情况,每2 ~4 天传代1 次,取对数期的细胞用于后续实验。
1.3 细胞转染
将A549细胞培养至80%融合时,按照LipofectamineTM3000 转染试剂说明书进行转染。分为空白对照组、miR-433 mimic(50、80 及100 nmol/L)组、mimic control 组。转染48 h 后,Real-time PCR 检测转染效率,选取最佳浓度进行后续实验。
1.4 real-time PCR 检测miR-433 水平
收集细胞,利用Trizol 法提取总RNA,然后按照逆转录试剂盒说明书合成cDNA,再按照SYBR Premix Ex TaqTMⅡ试剂盒说明书于ABI 7500 仪器(美国应用生物系统公司)进行real-time PCR,具体反应程序为:95℃ 预变性30 s;95℃变性5 s,60℃退火30 s,共40 个循环。目的基因表达量按照2-△△Ct法计算。
1.5 MTT 检测细胞活力
将处于对数生长期的A549 细胞以1×105个/ml 浓度接种于96 孔细胞培养板,于转染48 h 后加入5 μg/μl 的MTT 溶液20μl,孵育4 h 后每孔分别加入150 μl 的DMSO 溶液,最后于490 nm 波长处检测各组吸光度(Absorbance,A)值。
1.6 Transwell 检测细胞迁移能力
将A549 细胞调整为2×105个/ml,取200μl 加入到TranswellTM小室内,并进行转染。24 孔板中加入500 μl 含10%血清的DMEM 完全培养基,将TranswellTM小室放入24孔板中,继续培养48 h后取出。弃掉上室培养液,加入4%多聚甲醛固定10 min,经PBS 清洗后再用1%结晶紫染色3 min,PBS 清洗小室。最后于倒置显微镜下进行观察。随机选取5 个高倍镜视野,对穿过底膜的细胞进行计数。
1.7 荧光素酶活性实验检测miR-433 对PAK4 的靶向性
将包含PAK4 野生型(WT)的3'-UTR 的pmir GLO 质粒和PAK3 突变型(Mut)的3'-UTR 的pmir GLO 质粒分别与miR-433 mimic 和mimic control 转染至HEK293 细胞,每组各重复6 个孔,转染后48 h,利用双荧光素酶检测试剂盒检测萤火虫荧光素酶活性,同时检测海肾荧光素酶活性作为内参对照。
1.8 Western blotting 检测蛋白水平
将处于对数生长期的A549 细胞以1×105个/ml 浓度接种于24 孔细胞培养板,转染48 h 后收集各组细胞,加入RIPA 裂解细胞,提取细胞总蛋白。取30 μg 蛋白进行SDS-PAGE 电泳,然后转移至PVDF膜上,经5%脱脂牛奶封闭后,分别加入相应PAK4(1 ∶1 000 稀释)、LIMK1/p-LIMK1(1 ∶1 000 稀释)、cofilin/p-cofilin(1 ∶1 000 稀释)等一抗,4℃孵育过夜。然后加入辣根过氧化物酶偶联的抗兔(1 ∶2 000稀释)二抗,37℃孵育1 h。加入ECL 发光剂进行显色,曝光拍照。
1.9 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(x±s)表示,多组间比较采用重复测量设计的方差分析或单因素方差分析,其中两两比较采用LSD-t检验。两组间差异比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-433 在NSCLC 细胞中的表达情况
miR-433 在多组间的表达,经单因素方差分析比较,差异有统计学意义(F=20.364,P=0.003)。miR-433 在NSCLC 细 胞 系A549(0.420±0.047)、NCI-H1299(0.510±0.082)、NCI-H358(0.480±0.032)中的表达与人肺成纤维细胞系HFL1(1.00±0.12)比较下降,差异有统计学意义(P<0.05)。
2.2 过表达miR-433 对A549 细胞增殖的影响
过表达miR-433 后,不同浓度组间miR-433 表达,差异有统计学意义(F=26.321,P=0.004)。与空白对照组(1.00±0.12)比较,50、80 及100 nmol/L 的miR-433 mimic 表达量分别为(75.06±5.82)、(142.02± 10.25)、(106.89±8.57)可促进miR-433 的表达,其中,80 nmol/L 的miR-433 mimic 转染后,miR-433 表达量最高(P<0.05)(见表1)。80 nmol/L 的miR-433 mimic 转染对A549 细胞增殖的影响,采用重复测量设计的方差分析,结果显示:①不同时间点的A549 细胞增殖率有差异(F=11.539,P=0.001);②3 组间A549 细胞增殖率有差异(F=6.651,P=0.019),miR-433 mimic 组与mimic control 比较,细胞增殖能力较低,抑制细胞增殖效果较好;③miR-433 mimic 组与mimic control 组A549 细胞增殖率变化趋势有差异(F= 5.379,P=0.025)。见表1。
表1 80 nmol/L 的miR-433 mimic 转染对 A549 细胞增殖的影响 (±s)
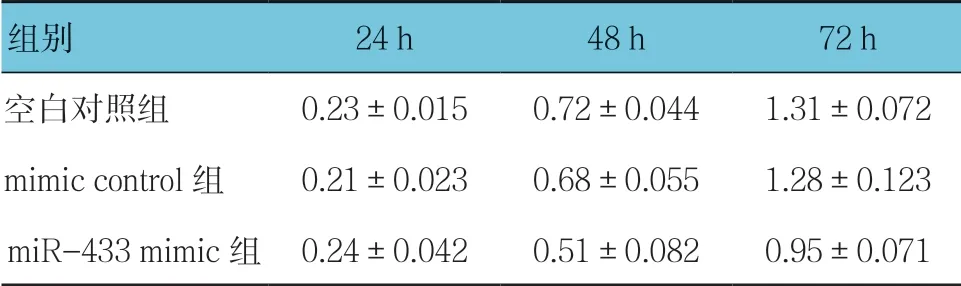
表1 80 nmol/L 的miR-433 mimic 转染对 A549 细胞增殖的影响 (±s)
组别 24 h 48 h 72 h空白对照组 0.23±0.015 0.72±0.044 1.31±0.072 mimic control 组 0.21±0.023 0.68±0.055 1.28±0.123 miR-433 mimic 组 0.24±0.042 0.51±0.082 0.95±0.071
2.3 过表达miR-433 对A549 细胞迁移的影响
Transwell 结果显示,过表达miR-433 后,空白对照组A549 细胞迁移数为(89.25±7.71)个/视野,mimic control 组为(84.33±8.32)个/视野,miR-433 mimic 组为(31.76±4.66)个/视野,3 组间比较,差异有统计学意义(F=3.991,P=0.020)。与mimic control 组比较,miR-433 mimic 组A549 细胞迁移能力降低,差异有统计学意义(P<0.05)。见图1。
2.4 miR-433 对PAK4 的靶向性

图1 miR-433 mimic 转染对A549 细胞迁移的影响
Target Scan Human 7.0 软件预测结果表明,PAK4为miR-433 的潜在靶基因。荧光素酶活性实验结果表明,在转染野生型PAK4 3'-UTR 的质粒时,与mimic control 组比较,miR-433 mimic 可抑制相对荧光素酶活性[(1.00±0.13)VS(0.42±0.09)(P=0.015)],而在转染突变型PAK4 3'-UTR 的质粒时,miR-433 mimic 对相对荧光素酶活性无影响[(0.95±0.09) VS(0.91±0.07)] (见图2A)。此外,real-time PCR 和Western blotting结果显示PAK4在3种人NSCLC细胞系中的表达上升,差异有统计学意义(P<0.05)(见图2B 和表2)。
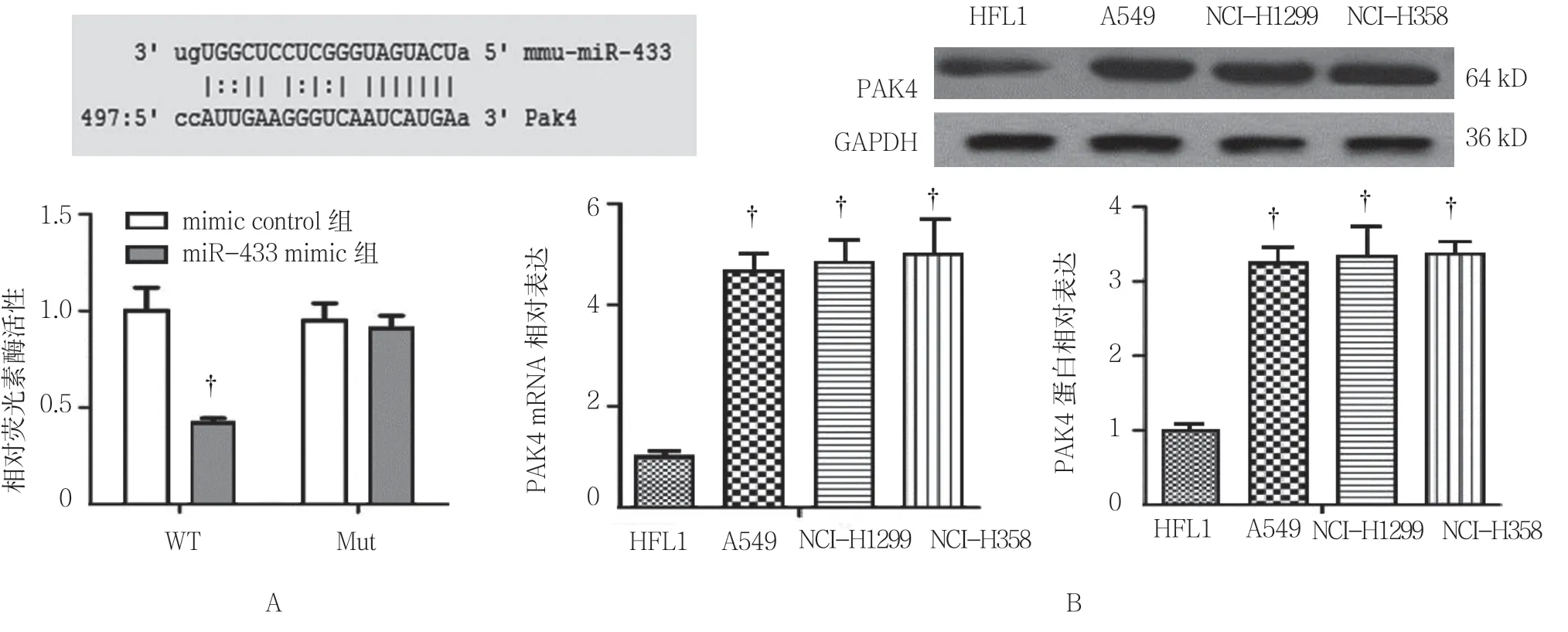
图2 miRNA-433 靶基因检测结果
表2 不同细胞中PAK4 mRNA 和蛋白的相对表达 (±s)

表2 不同细胞中PAK4 mRNA 和蛋白的相对表达 (±s)
注:†与HFL1 比较,P <0.05
组别 PAK4 mRNA PAK4 蛋白HFL1 1.00±0.12 1.00±0.08 A549 4.67±0.34† 3.25±0.21†NCI-H1299 4.86±0.42† 3.35±0.39†NCI-H358 5.01±0.68† 3.38±0.15†
2.5 过表达miR-433 对PAK4/LIMK1/Cofilin 信号通路的影响
由表3和图3可见,miR-433 mimic 转染后,3 组间PAK4、p-LIMK1 和p-Cofilin 的相对表达水平经单因素方差分析比较,差异均有统计学意义(P<0.05)。与mimic control 组比较,miR-433 mimic 转染后细胞中PAK4、p-LIMK1 以及p-Coflilin 的相对表达均降低,差异有统计学意义(P<0.05)。
表3 miR-433 mimic 转染对PAK4/LIMK1/Cofilin 表达的影响 (±s)

表3 miR-433 mimic 转染对PAK4/LIMK1/Cofilin 表达的影响 (±s)
组别 PAK4 p-LIMK1 p-Coflilin空白对照组 1.00±0.03 1.00±0.04 1.00±0.07 mimic control 组 1.13±0.08 1.12±0.06 1.08±0.12 miR-433 mimic 组 0.46±0.05 0.34±0.08 0.16±0.08 F 值 5.165 8.491 18.365 P 值 0.015 0.009 0.000
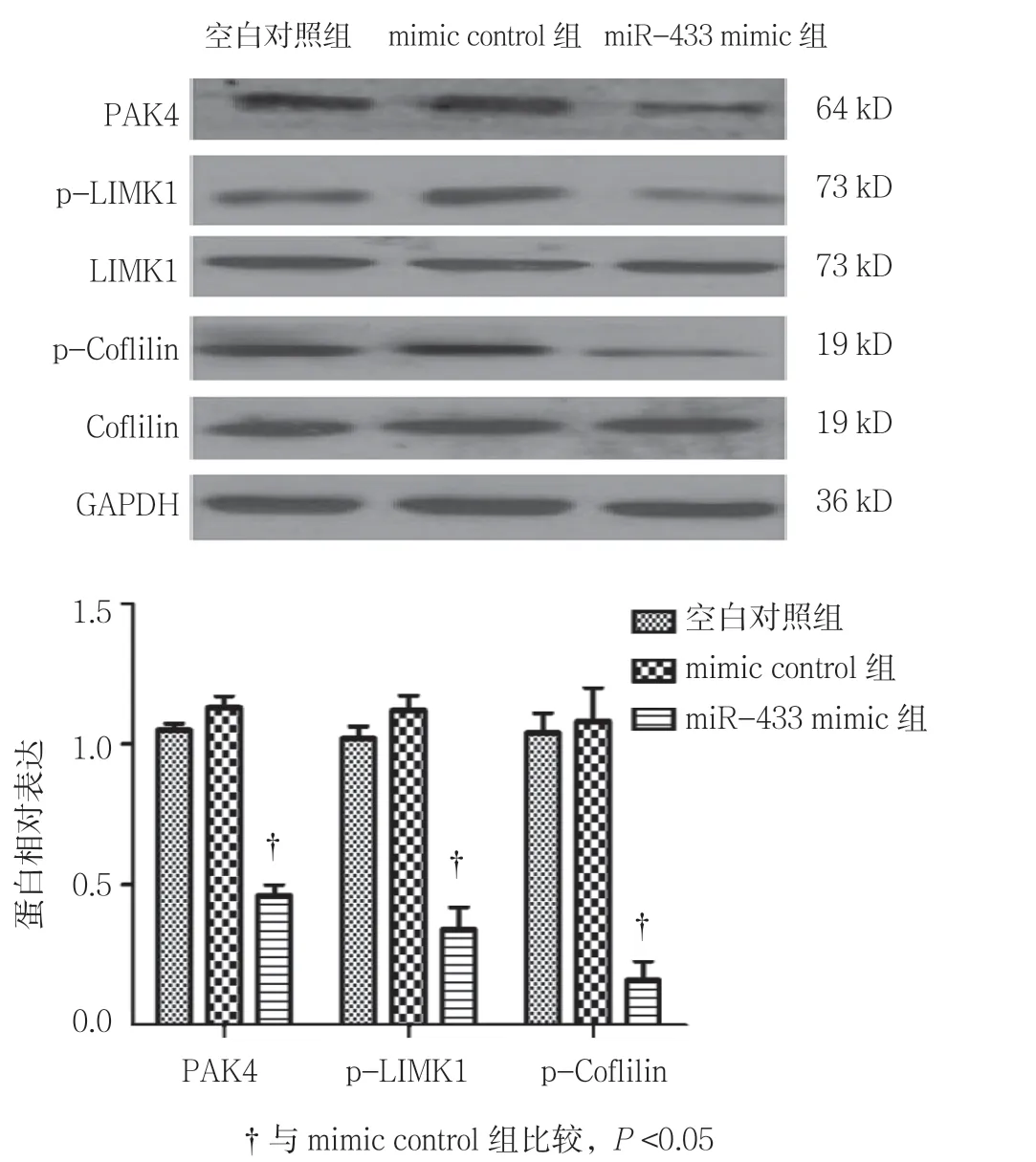
图3 miR-433 mimic 转染对PAK4/LIMK1/Cofilin 信号通路的影响
3 讨论
研究报道,miR-433 编码的基因位于第12 号染色体,与多种肿瘤的发生、发展密切相关[8]。如miR-433 通过靶向调节Notch1 的表达,抑制卵巢癌细胞的侵袭和迁移[9];miR-433 通过抑制环磷腺苷效应元件结合蛋白(CREB)的表达,抑制胶质瘤细胞的增殖、侵袭及迁移[10]。本研究结果表明,miR-433 在A549、NCI-H1299、NCI-H358 等NSCLC 细胞中的表达下降,且过表达miR-433 可抑制A549 细胞增殖及迁移。说明miR-433 可能在肺腺癌的发生、发展中发挥一定的抑癌作用。
PAK4 属于丝氨酸/苏氨酸蛋白激酶家族中的成员,是Rho-GTP 酶家族的下游效应器。PAK4 在各种细胞生命活动中具有重要的作用,其表达异常即可导致肿瘤的发生、发展、侵袭、转移等[11]。已有研究报道,PAK4 在多种肿瘤中异常表达,如胃癌中的p-PAK4呈高表达,与胃癌不良预后相关[12];高表达的PAK4 可通过激活PI3K/Akt 通路促进乳腺癌的发展[13]。此外,PAK4 在肺癌组织中呈异常高表达[14],本研究结果同样显示,PAK4 在3 种NSCLC 细胞中的表达上升,且发现PAK4 为miR-433 的靶向调节基因,过表达miR-433 后PAK4 的表达降低。
LIMK1 是PAK4 下游的靶蛋白,通过调节Cofilin的磷酸化水平调节激动蛋白细胞骨架的重组,参与肿瘤血管形成、细胞侵袭和迁移[15]。研究表明,LIMK1/Cofilin信号通路在多种肿瘤的发生、发展过程中被激活,如鼻咽癌[16]。本结果同样表明,PAK4/LIMK1/Cofilin 信号通路在A549 细胞中被激活,而过表达miR-433 可抑制PAK4/LIMK1/Cofilin 信号通路。表明miR-433 对肺腺癌的抑制作用可能是通过抑制PAK4/LIMK1/Cofilin 信号通路实现。
综上所述,miR-433 可通过抑制PAK4/LIMK1/Cofilin 信号通路,抑制A549 细胞的增殖及迁移,为NSCLC 的治疗提供新的靶点及理论基础。
