Urantide 对动脉粥样硬化大鼠心脏UⅡ和GPCR14基因与蛋白表达的影响*
2019-05-22孙晓旭王途周健刘凯崔海鹏谢云鹏赵娟
孙晓旭,王途,周健,刘凯,崔海鹏,谢云鹏,赵娟
(承德医学院,河北 承德 067000)
动脉粥样硬化(Atherosclerosis,AS)时,动脉内膜脂质沉积形成粥样斑块,从而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死,出现心脏的病理改变。国内外大量研究报道,多种心脏疾病与AS 的发生、发展密切相关,互为因果[1-2]。因此,研究心脏的病理改变及发病机制,对防治AS 具有重要的临床意义。Urantide 是在人尾加压素Ⅱ(human urotensin Ⅱ,hU Ⅱ)基础上衍生而来,目前被认为是最有效的肽类U Ⅱ的特异性受体G 蛋白偶联受体14(G-proteincoupled receptors 14,GPCR14)的拮抗剂,U Ⅱ与其受体GPCR14 结合从而发挥生物学效应[3]。本课题组前期研究发现,Urantide 可加速胸主动脉壁内的胶原蛋白降解,抑制U Ⅱ对动脉炎症损伤的促进作用,改善AS 病变程度[3-4]。而Urantide 对AS 大鼠心脏的具体作用及机制尚不清楚。本研究利用大鼠AS 模型,探讨Urantide 对AS 大鼠心脏U Ⅱ、GPCR14 基因和蛋白表达水平的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及试剂 无特定病原体(SPF)级健康雄性Wistar 大鼠180 只,3 周龄,体重180 ~200 g, 购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)-2016-0011,生产合格证:11400700 127208];Urantide 由苏州强耀生物公司提供,辛伐他汀(simvastatin)购自北京诺华制药有限公司,免疫组织化学(以下简称免疫组化)染色试剂盒(PV-6000)购自北京中杉金桥生物技术有限公司,放射免疫沉淀测定(RIPA)裂解液(P0013B)、Bradford 蛋白浓度测定试剂盒(P0006)和超敏电化学发光(ECL)试剂盒(Cat P0018)均购自上海碧云天生物技术有限公司,兔抗大鼠U II、GPCR14 均购自上海Santa 公司,兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体、辣根过氧化物酶(HRP)标记山羊抗兔二抗购自美国Bioworlde 公司,Trizol(DP405-02)、TIAN Script cDNA 第一链合成试剂盒(KR104)、Super Real Pre Mix SYBR Green(FP204)均购自北京天根生化科技有限公司。
1.1.2 大鼠AS 模型复制及实验分组 高脂饲料配制:基础饲料,胆固醇35%,猪油10%,丙硫氧嘧啶0.2%,胆酸钠0.5%,白糖5%。Wistar 大鼠180 只随机分为2 组。正常组30 只,饲以普通饲料;模型组150 只,在实验开始时饲以高脂饲料,并在此基础上每只大鼠连续3 d 给予腹腔注射维生素D3150 u/(kg·d),实验周期为4 周[3-6]。AS 模型复制成功后,将150 只模型组大鼠又随机分为3 组:AS 模型组(AS 组)30 只,阳性药辛伐他汀组(辛伐他汀组)30 只,Urantide 3、7 和14 d 组90 只(给药时间分别为3、7 和14 d,每组30 只)。正常组和AS 组每只大鼠每日尾静脉注射生理盐水30 μg/kg,连续14 d;辛伐他汀组每只大鼠每日灌胃辛伐他汀5 μg/kg,连续14 d;Urantide 组每只大鼠每日尾静脉注射Urantide 30 μg/kg,给药时间分别为3、7 和14 d。
1.1.3 样本采集 各组大鼠均采用小动物麻醉机吸入式麻醉安乐死方法处理。胸主动脉样本采集:麻醉取血后,立即摘取胸主动脉,生理盐水洗去血迹后,4%多聚甲醛固定,大鼠胸主动脉经脱水、透明、浸蜡、包埋后制备成石蜡切片,经二甲苯脱蜡、梯度乙醇水化、常规HE 染色后,光学显微镜下拍照观察病理学变化。心脏样本采集:摘取胸主动脉后,立即摘取心脏,生理盐水洗去血迹后,一部分标本用4%多聚甲醛固定,待形态学检测;另一部分冷冻于液氮进行分子生物学检测。
1.2 实验方法
1.2.1 免疫组化法检测大鼠心脏U Ⅱ和GPCR14 的表达 心脏经酒精脱水、二甲苯透明、浸蜡、包埋后,应用LEICA(上海徕卡显微系统有限公司,RM2255)切片机将组织切为3 ~4 μm 的蜡带,然后进行免疫组化染色。应用病理图形分析软件IP win32 对图像中阳性表达进行统计分析,计算各组大鼠心肌中U Ⅱ与GPCR14 阳性颗粒表达的光密度(OD)值。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠心脏U Ⅱ与GPCR14 mRNA 的表达 Trizol法提取心脏组织总RNA,紫外分光光度计进行定量检测,逆转录合成cDNA,qRT-PCR 检 测U Ⅱ、GPCR14、GAPDH mRNA 的Ct 值,引物序列见表1,扩增条件:94℃预变性5 min;94℃变性30 s,60℃退火34 s,40 个循环;做熔解曲线。以各基因Ct 值与GAPDH mRNA Ct 值的差值为△Ct,采用2-△△Ct法计算各基因mRNA 的相对表达水平,并以正常组为参照做归一处理,其他各组与其做比较。
1.2.3 Western blotting 检测大鼠心脏U Ⅱ与GPCR14蛋白的表达 RIPA 裂解液提取组织样本的总蛋白,Bradford 蛋白浓度测定试剂盒进行蛋白定量。45 μg蛋白于SDS 聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转膜,封闭,U Ⅱ(1 ∶200)、GPCR14(1 ∶100)、GAPDH(1 ∶10 000)兔抗大鼠一抗4℃孵育过夜。加入HRP 标记山羊抗兔二抗(1 ∶5 000),37℃孵育1 h,洗膜后用超敏ECL 试剂盒显影。利用Image J 光密度分析软件对各蛋白目的条带灰度值与GAPDH 条带灰度值的比值作为各蛋白质的相对表达水平。

表1 引物序列
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 AS 大鼠胸主动脉的形态学改变
HE 染色结果显示,正常组大鼠胸主动脉内膜、中膜、外膜结构完整清楚,内皮细胞完整,中膜平滑肌细胞排列整齐,且外弹力板结构清晰,呈环形排列,外膜由疏松结缔组织构成;AS 组大鼠胸主动脉内皮细胞破坏,出现钙化及炎症细胞浸润,平滑肌细胞增殖、萎缩,弹力纤维破坏、变薄,内膜下脂质沉积形成AS 斑块,呈典型的AS 病理改变。表明,腹腔注射维生素D3及高脂饲料喂养的方法4 周后成功复制大鼠AS 模型。见图1。
2.2 免疫组化染色结果
各组大鼠心脏U Ⅱ与GPCR14 阳性表达经单因素方差分析,差异有统计学意义(P<0.05)。AS 组大鼠心脏U Ⅱ及GPCR14 阳性表达较正常组增多(P< 0.05),且多表达于血管周围及病变部位。与AS 组比较,经Urantide 治疗后Urantide 组大鼠心脏U Ⅱ及GPCR14 阳性表达减少(P<0.05),其效果接近辛伐他汀组的表达水平(P<0.05)。见图2、3 和表2。
2.3 各组大鼠心脏U Ⅱ及GPCR14 mRNA 表达
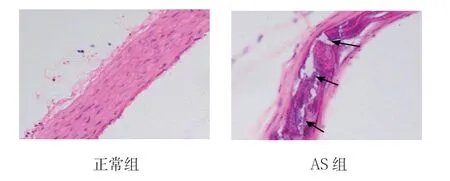
图1 AS 大鼠胸主动脉形态学改变 (HE×400)

图2 大鼠心脏U Ⅱ免疫组化染色结果 (×200)
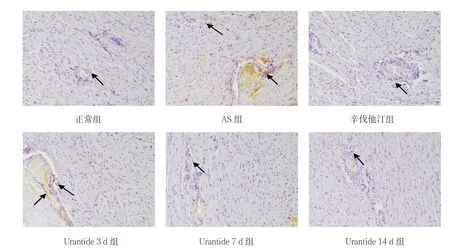
图3 大鼠心脏GPCR14 免疫组化染色结果 (×200)
表2 各组大鼠心脏U Ⅱ和GPCR14 OD 值的比较 (n =30,±s)

表2 各组大鼠心脏U Ⅱ和GPCR14 OD 值的比较 (n =30,±s)
注:1)与AS 组比较,P <0.05;2)与辛伐他汀组比较,P <0.05
组别 U Ⅱ GPCR14正常组 0.16±0.041) 0.08±0.031)AS 组 1.66±0.15 1.20±0.06辛伐他汀组 0.69±0.131) 0.27±0.041)Urantide 3 d 组 0.80±0.041)2) 0.83±0.061)2)Urantide 7 d 组 0.58±0.071)2) 0.50±0.081)2)Urantide 14 d 组 0.61±0.071)2) 0.31±0.071)2)F 值 85.254 122.241 P 值 0.000 0.000
各组大鼠心脏U Ⅱ与GPCR14 mRNA 表达经单因素方差分析,差异有统计学意义(P<0.05)。AS组大鼠心脏U Ⅱ及GPCR14 mRNA 表达较正常组升高(P<0.05)。与AS 组比较,经Urantide 治疗后各Urantide 组大鼠心脏U Ⅱ及GPCR14 mRNA 表达降低(P<0.05),其效果接近辛伐他汀组的表达水平(P< 0.05)。见表3。
2.4 各组大鼠心脏U Ⅱ及GPCR14 蛋白表达
各组大鼠心脏Ⅱ与GPCR14 蛋白表达经单因素方差分析,差异有统计学意义(P<0.05)。AS 组大鼠心脏U Ⅱ及GPCR14 蛋白表达较正常组升高(P< 0.05)。经Urantide 治 疗 后 各Urantide 组 大 鼠 心 脏U Ⅱ及GPCR14 蛋白表达降低(P<0.05),其效果接近辛伐他汀组的表达水平(P<0.05)。见表4和图4。
表3 各组大鼠心脏U Ⅱ和GPCR14 的mRNA 表达 (n =30,±s)

表3 各组大鼠心脏U Ⅱ和GPCR14 的mRNA 表达 (n =30,±s)
注:1)与AS 组比较,P <0.05;2)与辛伐他汀组比较,P <0.05
组别 U Ⅱ mRNA GPCR14 mR NA正常组 1.00±0.011) 1.00±0.081)AS 组 2.30±0.05 2.30±0.05辛伐他汀组 1.10±0.021) 1.20±0.041)Urantide 3 d 组 1.40±0.031)2) 1.32±0.061)2)Urantide 7 d 组 1.25±0.041)2) 1.48±0.071)2)Urantide 14 d 组 1.20±0.081)2) 1.10±0.091)2)F 值 67.125 64.100 P 值 0.000 0.000
表4 各组大鼠心脏U Ⅱ和GPCR14 的蛋白表达 (n =30,±s)

表4 各组大鼠心脏U Ⅱ和GPCR14 的蛋白表达 (n =30,±s)
注:1)与AS 组比较,P <0.05;2)与辛伐他汀组比较,P <0.05
组别 U Ⅱ蛋白 GPCR14 蛋白正常组 0.34±0.021) 0.50±0.011)AS 组 0.96±0.01 0.99±0.01辛伐他汀组 0.80±0.031) 0.05±0.001)Urantide 3 d 组 0.70±0.031)2) 0.19±0.001)2)Urantide 7 d 组 0.70±0.031)2) 1.45±0.001)2)Urantide 14 d 组 0.56±0.031)2) 0.13±0.001)2)F 值 89.031 93.428 P 值 0.000 0.000

图4 大鼠心脏U Ⅱ与GPCR14 的蛋白表达
3 讨论
U Ⅱ是一种生长抑素样环肽,最早从鱼的脊髓尾部下垂体中分离出来,是目前已知的最强的缩血管活性肽,U Ⅱ与其受体GPCR14 相结合构成U Ⅱ/UT 系统在生理和病理条件下发挥多种生物学功能[3]。国内外大量研究报道,U Ⅱ不但促进AS 的进展,而且参与了心肌纤维化、心脏重塑、冠状动脉粥样硬化性心脏病、心力衰竭、心肌肥厚等多种心脏疾病的发生与发展,其有可能成为一个影响因素[7-8]。因此,以U Ⅱ为靶点,保护心脏、治疗AS 成为人们关注的热点。
Urantide 由hU Ⅱ衍生而来,目前被认为是最有效的U Ⅱ受体GPCR14 拮抗剂[3]。CERNARO 等[9]研究报道,Urantide 可以降低由U Ⅱ和转化生长因子β诱导的纤维连接蛋白的表达,在心肌纤维化中具有抗纤维化的作用。国内外有关Urantide 与动脉粥样硬化心脏的报道极少,迄今可查到的信息,基本上都来自本课题组所做的工作。本研究室前期研究证明,在体内实验中,U Ⅱ及其受体GPCR14 基因与蛋白在AS大鼠胸主动脉中大量表达,且U Ⅱ可促进炎症因子的释放,而Urantide 可以下调其表达量,减轻胸主动脉的炎症损伤,起到保护胸主动脉的作用;在体外实验中,U Ⅱ可以促进血管平滑肌细胞的增殖,上调血管平滑肌细胞中U Ⅱ与其受体GPCR14 基因与蛋白的表达水平,促进炎症因子的释放,Urantide 则可以下调其表达量,对血管平滑肌细胞中的炎症因子具有抑制调作用,从而改善AS 病理改变[10]。
本结果显示,Urantide 作为U Ⅱ受体GPCR14 的拮抗剂,可减少大鼠心脏U Ⅱ、GPCR14 的阳性颗粒表达;qRT-PCR 及Western blotting 结果进一步证实Urantide 对AS 大 鼠 心 脏U Ⅱ、GPCR14 mRNA 及 蛋白质表达水平均具有下调作用。笔者推测,U Ⅱ与其受体GPCR14 结合后可加重AS 大鼠的心脏损伤,而Urantide 则可阻断U Ⅱ这种促进作用,减轻大鼠AS病理改变。
综上所述,Urantide 可以通过降低AS 大鼠心脏U Ⅱ及其受体GPCR14 的基因及蛋白质的表达水平,而起到对抗损伤、保护心脏,治疗AS 的作用。但有关于Urantide 对AS 大鼠心脏的具体作用机制,还需进一步研究,以期为临床应用Urantide 治疗AS 提供更多的实验依据。
