丙泊酚联合卡铂对乳腺癌细胞凋亡及JAK/STAT通路的影响
2019-05-22张新科司小萌张朔
张新科,司小萌,张朔
(南阳市中心医院 麻醉科,河南 南阳 473000)
乳腺癌严重威胁妇女身体健康,为临床常见妇科肿瘤。调查显示近年来其发病率逐年升高,在所有妇科恶性肿瘤中占据首位,因此,探究乳腺癌发生、发展的确切机制对疾病的靶向治疗至关重要[1]。临床治疗乳腺癌主要以手术结合铂类化疗为主,卡铂为二代铂类药物,在乳腺癌治疗中应用较广,但容易产生耐药性,患者生存率并未得到明显改善,因此,如何降低药物的耐药性是目前治疗乳腺癌的重要途径[2]。丙泊酚为临床常用静脉麻醉药物,在乳腺癌等多种肿瘤切除手术中应用广泛,近期研究显示其能够抑制卵巢癌、肝癌、前列腺癌等癌细胞的侵袭、迁移进而抑制肿瘤的增殖[3]。王萍等[4]研究显示,丙泊酚对耐药性癌细胞具有抑制作用,同时不作用于敏感肿瘤细胞,与化疗药物结合后能够抑制肿瘤细胞产生耐药性,然而在乳腺癌中是否也有相同作用,目前尚未见报道。本研究通过体外培养乳腺癌细胞并给予丙泊酚联合卡铂处理,以探究其对乳腺癌细胞增殖、凋亡的影响,以及其可能的作用机制。
1 材料与方法
1.1 实验细胞
人正常乳腺上皮细胞MCF-10A、乳腺癌细胞MCF-7 购自中国科学院上海细胞研究所,置入-80℃冰箱冷冻保存,使用时取出,放置37℃解冻,置于RPMI 1640 培养液,置于37℃、5%二氧化碳CO2培养箱内培养,当细胞生长至80%时,加入0.25%胰酶溶液进行消化,进行传代培养,当细胞培养至第3 代时,可用于后续研究。
1.2 仪器与试剂
丙泊酚购自美国Sigma 公司,卡铂购自上海赛默飞公司,胎牛血清以及含青霉素、链霉素RPMI 1640培养基购自美国Gibco 公司,胰酶溶液购自上海碧云天生物研究所,鼠抗人p-JAK2、p-STAT3、β-actin抗体购自美国Santa Cruz 公司,Bcl-2、Bax、Cleaved Caspase-3、辣根过氧化物酶标记的羊抗鼠IgG 二抗购自美国R&D 公司,PDVF 膜购自生工生物工程(上海)有限公司,二联喹啉酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自美国Thermo 公司,电子荧光显微镜购自日本Olympus 公司,蛋白凝胶成像仪购自Bio-Red 公司。
1.3 细胞分组
取对数期MCF-7 细胞接种于96 孔板中,细胞密度调整为1×104个/ml,培养24 h 将细胞分为4 组:对照组、丙泊酚组(100 μmol 丙泊酚组)[5]、卡铂组(20 μmol/L 卡铂组)[6]、联合组(100 μmol 丙泊酚+ 20 μmol/L 卡铂组)。
1.4 观察指标与检测方法
1.4.1 CCK-8 法检测细胞增殖 各组细胞处理后置于37℃、5% CO2潮湿培养箱内,每组设置6 个重复,以不接种细胞的培养液作为空白孔,分别培养24、48、72 和96 h,结束后添加CCK-8 试剂孵育4 h,离心后保留下层细胞添加DMSO 避光孵育15 min,置于酶标仪570 nm 处检测光密度(OD)值,细胞增殖抑制率(%)=(1-实验组OD 值/对照组OD 值)× 100%。
1.4.2 细胞形态学观察 细胞分组后继续培养12 h,接种在含盖玻片6 孔板内,过夜孵育更换新鲜培养液继续培养24 h,弃去上层培养液,PBS 漂洗后添加10%甲醛固定1 h,PBS 清洗后,添加Hoechst33342 染液染色20 min,冲洗后置于荧光显微镜下观察细胞形态 变化。
1.4.3 细胞菌落形成检测 取对数期细胞,密度调整为300 个/ml,于培养皿(直径60 mm)孵育24 h 后,进行上述不同处理后,于37℃下培养2 周,将菌落用固定剂(甲硫醇∶冰醋酸=7 ∶1)固定15 min 后,用含结晶紫20%甲醇染液对菌落染色30 min,清洗晾干后拍照计数菌落形成个数。
1.4.4 PI/Annexin V-FITC 双染法检测细胞凋亡 收集各组细胞添加0.2%胰酶溶液消化,细胞密度调整为1×106个/ml,采用预冷PBS 清洗后,加入150 μl结合缓冲液重悬,随后添加5 μl PI、10 μl Annexin V-FITC,置于4℃冰箱中避光条件下孵育30 min,置于流式细胞仪中检测对细胞凋亡情况。
1.4.5 Western blotting 检测蛋白表达 采用裂解缓冲液裂解细胞,冰上孵育30 min 后,离心取上清液,使用蛋白提取试剂盒提取细胞中总蛋白。采用10% SDS-PAGE 凝胶上分离,并转移至PDVF 膜上,加入BSA 室温下封闭后,添加一抗稀释液(1 ∶500)在室温下孵育1 h。PBS 清洗后,加入辣根过氧化物酶标记的抗兔IgG 二抗稀释液(1 ∶5 000)室温下与膜孵育1 h,通过ECL 化学发光液进行发光显影,采用Image J 软件分析蛋白相对表达。
1.5 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞增殖情况
随着培养时间的增加,各组细胞的抑制率逐渐升高。同一时间点,丙泊酚组、卡铂组细胞抑制率与对照组比较,差异有统计学意义(P<0.05),丙泊酚组、卡铂组均升高;联合组细胞抑制率与丙泊酚组、卡铂组比较,差异有统计学意义(P<0.05),联合组均升高。见表1。
表1 各组MCF-7 细胞抑制率比较 (%,±s)

表1 各组MCF-7 细胞抑制率比较 (%,±s)
注:1)与对照组比较,P <0.05;2)与丙泊酚组、卡铂组比较,P <0.05
组别 24 h 48 h 72 h 96 h对照组 4.09±0.32 6.13±0.25 9.19±0.34 13.21±0.68丙泊酚组 10.18±1.531) 12.22±2.091) 14.29±2.191) 18.32±2.161)卡铂组 11.19±1.761) 13.24±3.141) 15.13±3.241) 19.16±2.851)联合组 21.45±2.752) 26.53±3.372) 30.72±2.682) 34.71±3.482)F 值 94.963 69.110 91.939 81.614 P 值 0.000 0.000 0.000 0.000
2.2 细胞形态学变化
Hoechst 染色显示,对照组细胞形态、大小均正常,丙泊酚组、卡铂组细胞体积明显变小,细胞核荧光强度增大,部分出现碎片化,联合组细胞核固缩现象更加明显。见图1。
2.3 细胞克隆形成情况
丙泊酚组、卡铂组细胞菌落数量与对照组比较,差异有统计学意义(P<0.05),丙泊酚组、卡铂组均降低;联合组细胞菌落数量与丙泊酚组、卡铂组比较,差异有统计学意义(P<0.05),联合组降低。见表2和图2。
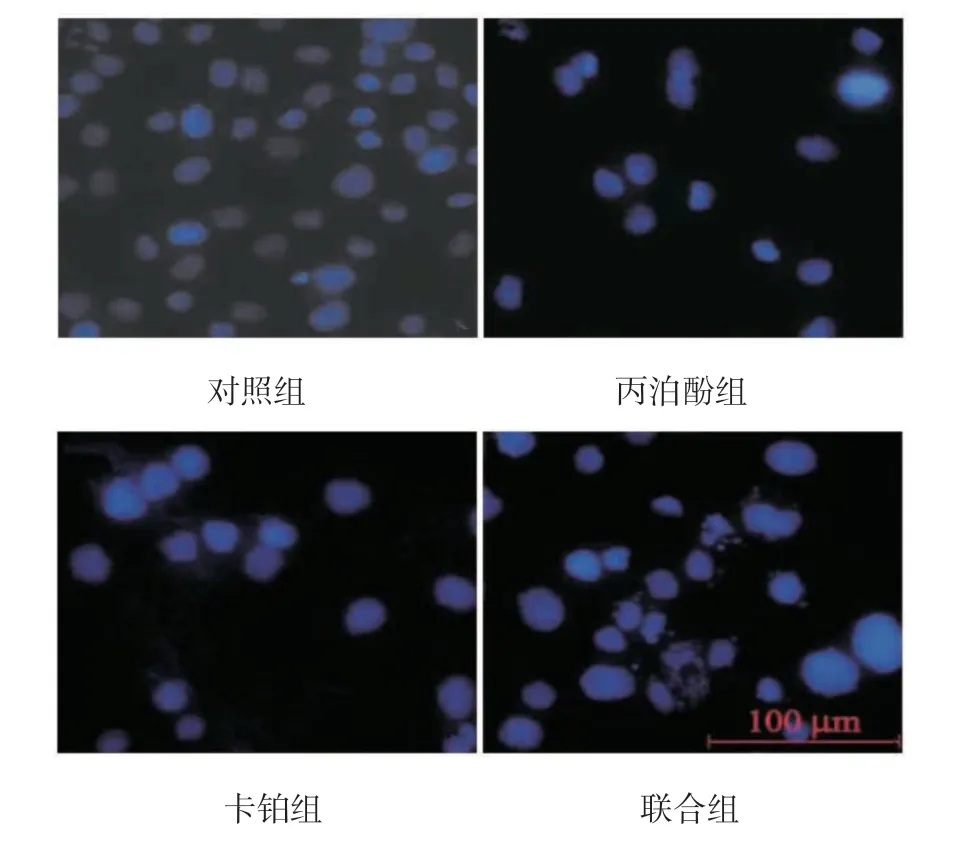
图1 细胞染色结果 (Hoechst 染色 ×100)
2.4 细胞凋亡情况
丙泊酚组、卡铂组细胞凋亡率与对照组比较,差异有统计学意义(P<0.05),丙泊酚组、卡铂组均升高;联合组细胞凋亡率与丙泊酚组、卡铂组比较,差异有统计学意义(P<0.05),联合组升高。见表3和图3。
表2 细胞菌落数量比较 (个,±s)

表2 细胞菌落数量比较 (个,±s)
注:1)与对照组比较,P <0.05;2)与丙泊酚组、卡铂组比较,P <0.05
组别 菌落数量对照组 74.37±11.69丙泊酚组 59.86±12.561)卡铂组 60.36±9.271)联合组 23.49±4.682)F 值 82.963 P 值 0.000

图2 细胞菌落形成情况
表3 各组细胞凋亡率比较 (%,±s)

表3 各组细胞凋亡率比较 (%,±s)
注:1)与对照组比较,P <0.05;2)与丙泊酚组、卡铂组比较,P <0.05
组别 凋亡率对照组 0.28±0.03丙泊酚组 4.75±0.561)卡铂组 4.83±0.781)联合组 16.27±4.222)F 值 61.852 P 值 0.000
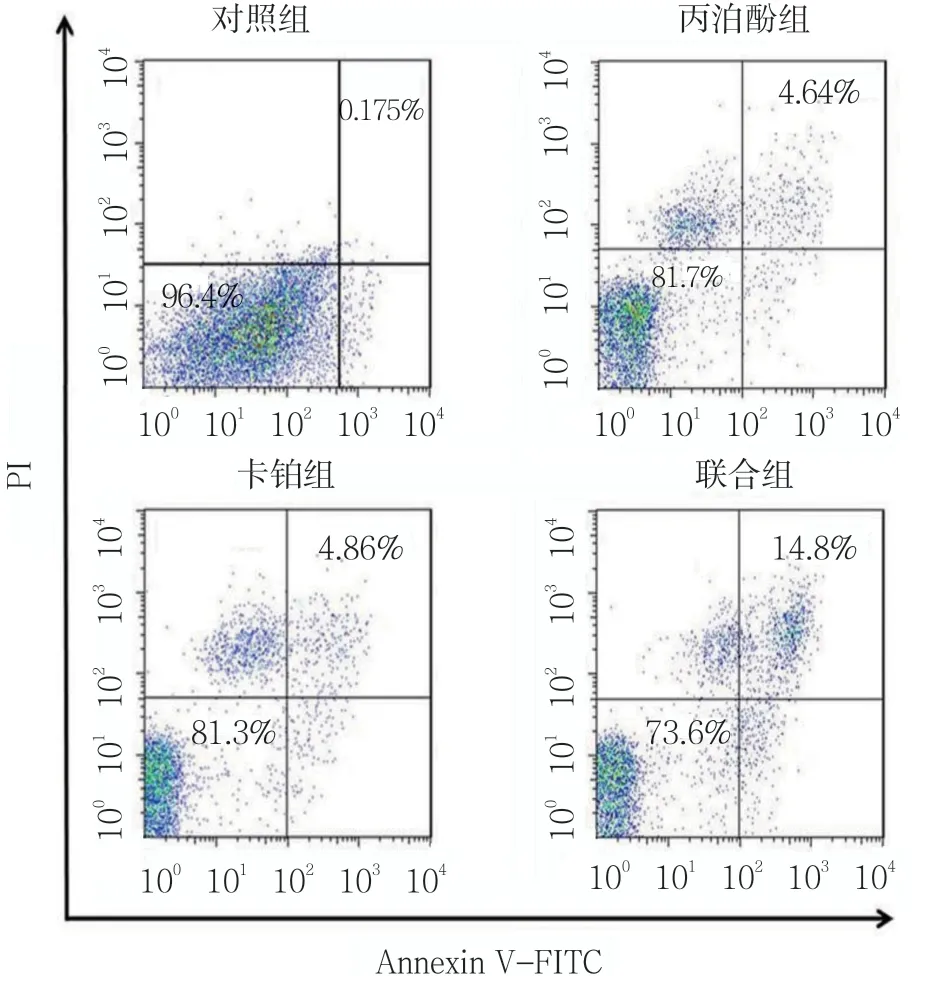
图3 细胞凋亡情况
2.5 不同细胞系中p-JAK2、p-STAT3 蛋白表达
MCF-7 细胞p-JAK2、p-STAT3 蛋白表达与正常乳腺上皮细胞MCF-10A 比较,差异有统计学意义(P< 0.05),MCF-7 细胞p-JAK2、p-STAT3 蛋白表达均升高。见表4和图4。
2.6 各 组p-JAK2、p-STAT3、Bcl-2、Cleaved Caspase-3、Bax 蛋白表达
丙泊酚组、卡铂组Cleaved Caspase-3、Bax 蛋白表达与对照组比较,差异有统计学意义(P<0.05),丙泊酚组、卡铂组Cleaved Caspase-3、Bax 蛋白表达与均升高,丙泊酚组、卡铂组p-JAK2、p-STAT3、Bcl-2蛋白表达对照组比较,差异有统计学意义(P<0.05),丙泊酚组和卡铂组均降低。见表5和图5。
表4 各细胞系p-JAK2、p-STAT3蛋白表达比较 (±s)

表4 各细胞系p-JAK2、p-STAT3蛋白表达比较 (±s)
注:†与MCF-10A 细胞系比较,P <0.05
细胞系 p-JAK2 p-STAT3 MCF-10A 0.14±0.03 0.21±0.04 MCF-7 0.87±0.11† 0.83±0.13†t 值 15.158 13.371 P 值 0.000 0.000

图4 MCF-10A、MCF-7 细胞中p-JAK2、 p-STAT3 蛋白表达
表5 各组p-JAK2、p-STAT3、Bcl-2、Cleaved Caspase-3、Bax 蛋白表达比较 (±s)
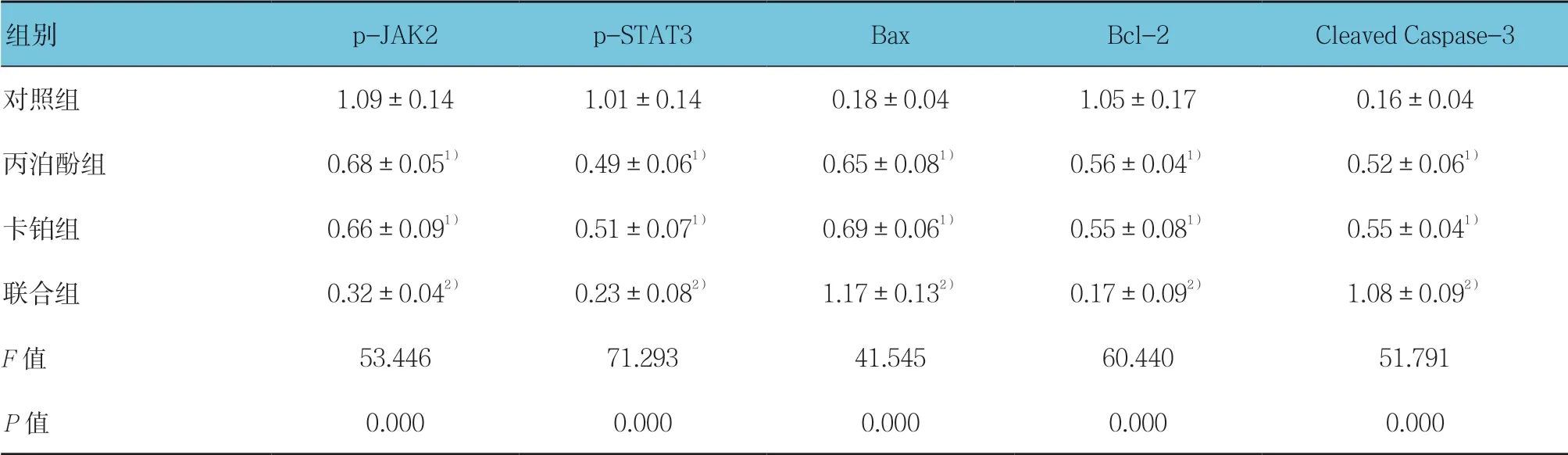
表5 各组p-JAK2、p-STAT3、Bcl-2、Cleaved Caspase-3、Bax 蛋白表达比较 (±s)
注:1)与对照组比较,P <0.05;2)与丙泊酚组、卡铂组比较,P <0.05
组别 p-JAK2 p-STAT3 Bax Bcl-2 Cleaved Caspase-3对照组 1.09±0.14 1.01±0.14 0.18±0.04 1.05±0.17 0.16±0.04丙泊酚组 0.68±0.051) 0.49±0.061) 0.65±0.081) 0.56±0.041) 0.52±0.061)卡铂组 0.66±0.091) 0.51±0.071) 0.69±0.061) 0.55±0.081) 0.55±0.041)联合组 0.32±0.042) 0.23±0.082) 1.17±0.132) 0.17±0.092) 1.08±0.092)F 值 53.446 71.293 41.545 60.440 51.791 P 值 0.000 0.000 0.000 0.000 0.000

图5 各组p-JAK2、p-STAT3、Bcl-2、Cleaved Caspase-3、Bax 蛋白表达情况
3 讨论
铂类药物在临床肿瘤治疗中应用较广泛,其能够通过与肿瘤细胞DNA 发生交联,进而影响细胞的复制、转录,抑制细胞的增殖,引发细胞死亡。研究显示卡铂单药对乳腺癌的总缓解率可达50%,体外研究显示,采用不同浓度卡铂处理乳腺癌细胞,细胞的抑制率升高,且细胞凋亡率也随之升高,提示卡铂能够阻碍乳腺癌细胞体外增殖,并且可以诱导其凋亡[7]。丙泊酚为临床常用静脉麻醉药物,具有起效快、苏醒快、安全性高等优点。近期研究显示丙泊酚能具有抗肿瘤的作用,在肺癌中研究显示,丙泊酚通过阻断金属基质蛋白酶表达进而抑制肿瘤细胞的侵袭、转移,抑制肺癌细胞的增殖[8]。有结肠癌研究[9]显示,丙泊酚能够通过抑制ERK 信号通路活性,进而抑制肿瘤细胞的侵袭、转移。以上结果均显示丙泊酚具有抑制肿瘤增殖的作用。卡铂在治疗肿瘤时,近期疗效较好,但易产生耐药性,据报道,丙泊酚能够抑制耐药性肿瘤细胞,同时对敏感性细胞无影响[4]。基于以往研究推测,丙泊酚联合卡铂可能会增强卡铂抗肿瘤效果,本研究结果显示,丙泊酚与卡铂两者联合后细胞抑制率升高,提示两者结合后,共同抑制乳腺癌细胞的增殖。但具体作用机制尚不明确。
一般情况下,细胞凋亡多出现于衰老、病变细胞,因此清除衰老、病变细胞,对维持机体健康状态十分重要;当受到外界刺激或内部刺激时,细胞其生长和凋亡相关的基因发生失调,导致凋亡程序紊乱,引起细胞异常凋亡,进而引发病理性损伤[10]。研究显示丙泊酚能够通过影响上调miR-let7i 进而诱导上皮性卵巢癌细胞的凋亡[11]。体外研究显示卡铂处理后能够明显抑制人肺腺癌、宫颈癌细胞的增殖,且诱导其凋亡[12]。以上研究均提示丙泊酚、卡铂均能诱导肿瘤细胞凋亡发挥抗肿瘤作用。本研究结果显示丙泊酚组、卡铂组细胞体积明显变小,细胞核荧光强度增大,部分出现碎片化,且流式细胞仪检测显示联合组细胞凋亡率较单独用药组升高,提示经联合处理后肿瘤细胞凋亡更为明显。
细胞凋亡是机体内调节细胞自主死亡的生物过程,其发生的涉及凋亡诱导因子和凋亡抑制因子等调节因子[13]。Bcl-2 家族包括多种与细胞凋亡密切相关的蛋白成员,包括抑凋亡蛋白Bcl-2、促凋亡蛋白Bcl-2 相关X 蛋白Bax 等成员[14]。一般情况下,细胞线粒体中Bcl-XL、Bcl-2 通过结合Bax 形成二聚体抑制细胞调亡;受到外界损伤后,Bax 蛋白表达升高,导致二聚体增多并聚集在线粒体膜,使线粒体膜通透性升高,促使AIF 等凋亡因子进入细胞质,激活Caspase级联反应进而诱导细胞凋亡[15-16]。本研究结果显示,联合组,Cleaved Caspase-3、Bax 蛋白表达均升高,Bcl-2 蛋白表达均降低,与丙泊酚组、卡铂组有差异,提示经丙泊酚、卡铂处理后肿瘤细胞出现一定凋亡,联合处理后细胞凋亡更为明显,进一步说明两者联合使用可进一步抑制肿瘤增殖。
酸激酶JAK/转录因子STAT 信号(JAK/STAT)信号通路在多类细胞生长、分化、凋亡以及炎症反应发生中发挥重要作用。细胞因子与受体结合后形成二聚体且与JAK 靠近,进而被酪氨酸残基磷酸化,吸引转录因子STAT 与受体结合,使STAT 磷酸化进而与受体解离形成二聚体,逐渐转移至细胞核内参与下游靶基因的调控,因而JAK 的磷酸化后能够激活STAT磷酸化,进而引发下游抗肿瘤凋亡因子表达失调,引发肿瘤,因此JAK/STAT 信号通路可能为治疗癌症的靶点[17]。滕文静等[18]研究显示,重楼皂苷抑制JAK/STAT3 信号通路活化进而诱导结直肠癌细胞凋亡。杨慧梅等[19]研究显示,在添加JAK/STAT 信号通路抑制剂后能够促进脑胶质瘤细胞凋亡。以上研究均提示抑制JAK/STAT 信号通路能够促进癌细胞凋亡。本研究显示,与对照组比较,丙泊酚组、卡铂组p-JAK2、p-STAT3、Bcl-2 蛋白表达均降低,联合组p-JAK2、p-STAT3、Bcl-2 蛋白表达进一步降低,提示丙泊酚联合卡铂可能通过抑制JAK/STAT 信号通路活化,进而诱导乳腺癌细胞凋亡,发挥抗肿瘤作用。
综上所述,丙泊酚联合卡铂可能通过抑制JAK/STAT 信号通路活化,上调凋亡蛋白的表达,诱导其凋亡,从而抑制乳腺癌生长,发挥抗肿瘤作用,这可能为乳腺癌细胞治疗的靶点,然而本研究仅以乳腺癌细胞系MCF-7 作为研究对象,所涉及相关信号通路还有待深入探究。
