羊膜凝胶对大鼠干眼的治疗作用及其作用机制
2019-05-16沈满意马晓萍
沈满意 马晓萍
(复旦大学附属中山医院眼科 上海 200032)
干眼是最常见的眼表疾病,随着电子设备的广泛应用、现代人生活方式的改变及环境因素的恶化,干眼的发病率逐年增高,并呈年轻化趋势。干眼患者常出现眼部干涩感、异物感、畏光、视物模糊等症状,轻者影响工作和生活质量,重者可导致角膜上皮细胞的鳞状化生,甚至引起角膜感染、角膜溃疡及瘢痕形成等,使视功能严重受损[1]。目前干眼的治疗以人工泪液滴眼为主,可在一定程度上缓解患者眼部不适症状,但对中、重度干眼的治疗效果不佳。
羊膜从细胞滋养层衍化而来,位于胎膜的最内层,由母体外绒毛膜和胎儿内羊膜组成。Gregory[2]将羊膜移植应用到重度干眼患者(Stevens-Johnson综合征)的眼表,取得了良好的疗效。近年来,大量研究发现由羊膜中的可溶性成分制成羊膜提取液,同样能保留羊膜的生物学活性[3-4]。羊膜提取液可诱导上皮细胞增殖,IL-1b表达下调,并抑制炎症细胞浸润,在促进上皮细胞形成、抗炎和抑制角膜新生血管形成方面具有与羊膜移植相当的效果。羊膜提取液的滴眼给药常常会通过泪液冲洗或鼻泪管排出,眼部生物利用度差,且由于夜间给药不便,药理学峰谷现象突出,极大地影响了治疗效果[5]。通过延长药物在眼内的停留时间或改善药物向角膜和结膜的渗透,可提高其眼部的生物利用率[6-7]。凝胶呈透明黏稠状,点眼后一般不引起视物模糊,与滴眼液相比,眼用凝胶具有延长角膜接触时间、减少给药频率、提高患者依从性等优点[8]。
本研究在制作羊膜匀浆提取液的基础上制成羊膜凝胶。通过0.2%苯扎氯铵(benzalkonum chloride,BAC)点眼制作大鼠干眼模型,检测各时间点干眼临床指标,初步探讨局部应用羊膜凝胶对减缓大鼠干眼模型眼表损害的作用,并通过组织病理学检查探讨其作用机制,以期为干眼的治疗提供实验依据。
资料和方法
羊膜凝胶的制备选取自剖宫产或顺产无菌接生的新鲜胎盘,产前血清学检查排除乙肝、丙肝、梅毒及风疹病毒、获得性免疫缺陷综合征等疾病,取材均在无菌操作下完成。将胎盘羊膜面用无菌生理盐水先冲去血块,并于抗生素生理盐水(2.5 μg/mL两性霉素B和1∶1 000妥布霉素)中漂洗40 min;随后将胎盘自羊膜与绒毛膜间的潜在空隙行钝性剥离,羊膜上皮面朝上置于无菌方盘中,并在无菌方盘中刮除羊膜的海绵层,用无菌生理盐水清洗。研磨羊膜,按1∶5(W/V)加入PBS,匀浆,将匀浆液置于4 ℃放置5天。5 000 r/min(r=10 cm)离心30 min,取上清液,调节pH至7.2,用0.22 μm滤膜过滤,取滤液为羊膜匀浆提取液,置于4 ℃冰箱保存备用。随后在制备羊膜匀浆提取液的基础上进行羊膜凝胶的制备。称取1 g卡波姆干粉,置于刻度50 mL的干烧杯内,加入25 mL羊膜匀浆液,边加边搅拌,使卡波姆充分吸水溶胀,水浴加热40 min;滴加碱液(NaOH溶液)调节pH至7.2,制备凝胶成功,补充羊膜匀浆液至总体积为50 mL,充分搅拌后得到羊膜凝胶。
建立干眼动物模型选取30只健康的7周龄Wistar 雌性大鼠(上海斯莱克实验动物有限责任公司),置于标准无菌环境,食物及水供给充足,饲养环境符合医学实验动物环境的要求。试验前对所有大鼠进行裂隙灯下双眼眼表及眼前节检查,结果均正常。随机选取25只大鼠制作干眼动物模型,用0.2%BAC溶液滴双眼,3次/日,持续10天。干眼动物模型制作完成后,将小鼠随机分为干眼对照组(A组)、溶剂治疗组(B组,PBS溶液)、羊膜提取液组(C组)、羊膜凝胶组(D组)和人工泪液治疗组(E组,羧甲基纤维素钠滴眼液),每组5只,其余5只大鼠作为正常对照组(F组)。
实验步骤B、C、D、E组大鼠分别使用PBS溶液、羊膜匀浆提取液、羊膜凝胶和人工泪液连续滴眼治疗1个月,3次/日,而A、F大鼠不进行治疗。于治疗前及治疗后1、2、3、4周分别对各组大鼠进行泪液分泌试验(schimers I test,SIT)、泪膜破裂时间(tear break-up time,BUT)试验和角膜荧光染色评分。治疗4周后对各组大鼠行过量麻醉处死,并进行角膜HE染色、结膜PAS染色、免疫组化实验及TUNEL试验。
泪液分泌试验按0.3 mL/100 g于腹腔内注射10%水合氯醛溶液进行全身麻醉。轻拉大鼠下睑,将棉线一端置于下睑结膜中外1/3处,放置20 s后取出。用毫米刻度尺测量酚红棉线湿润变红部分的长度,每眼测量2次(间隔10 min),取平均值记录为SIT。
泪膜破裂时间将2%荧光素钠溶液滴于大鼠结膜囊内,待荧光素钠溶液充分扩散后,于钴蓝光下观察大鼠从睑裂打开至泪膜第1个破裂点出现的时长为泪膜裂时间结果。每眼观察3次,取平均值记录为BUT。
角膜荧光染色将2%荧光素钠溶液滴于大鼠结膜囊内,待荧光素钠溶液充分扩散后,将裂隙灯调至钴蓝光模式,观察角膜荧光素着染情况,判断角膜上皮缺损程度。将角膜平均分为鼻上、鼻下、颞上、颞下4个象限分别进行评分,各象限分值相加即为角膜的荧光素染色评分。评分标准:0分,无着色;1分,点状着色≤30个;2分,点状着色>30个,但不弥散;3分,严重的弥散性着色,但尚未形成斑块状;4分,有斑块状着色。
病理检测滴眼治疗4周后,各组动物以过量麻醉法(10%水合氯醛)安乐处死,迅速取出包括上下睑在内的完整眼部组织。4%多聚甲醛固定,制作石蜡切片进行HE染色,观察角膜上皮缺损程度;PAS染色对结膜组织中富含黏蛋白的杯状细胞进行染色分析,间接反映MUC5AC含量;取角结膜组织切片行MUC1及K10组化分析;TUNEL试验观察角膜上皮细胞凋亡状况。
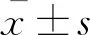
结 果
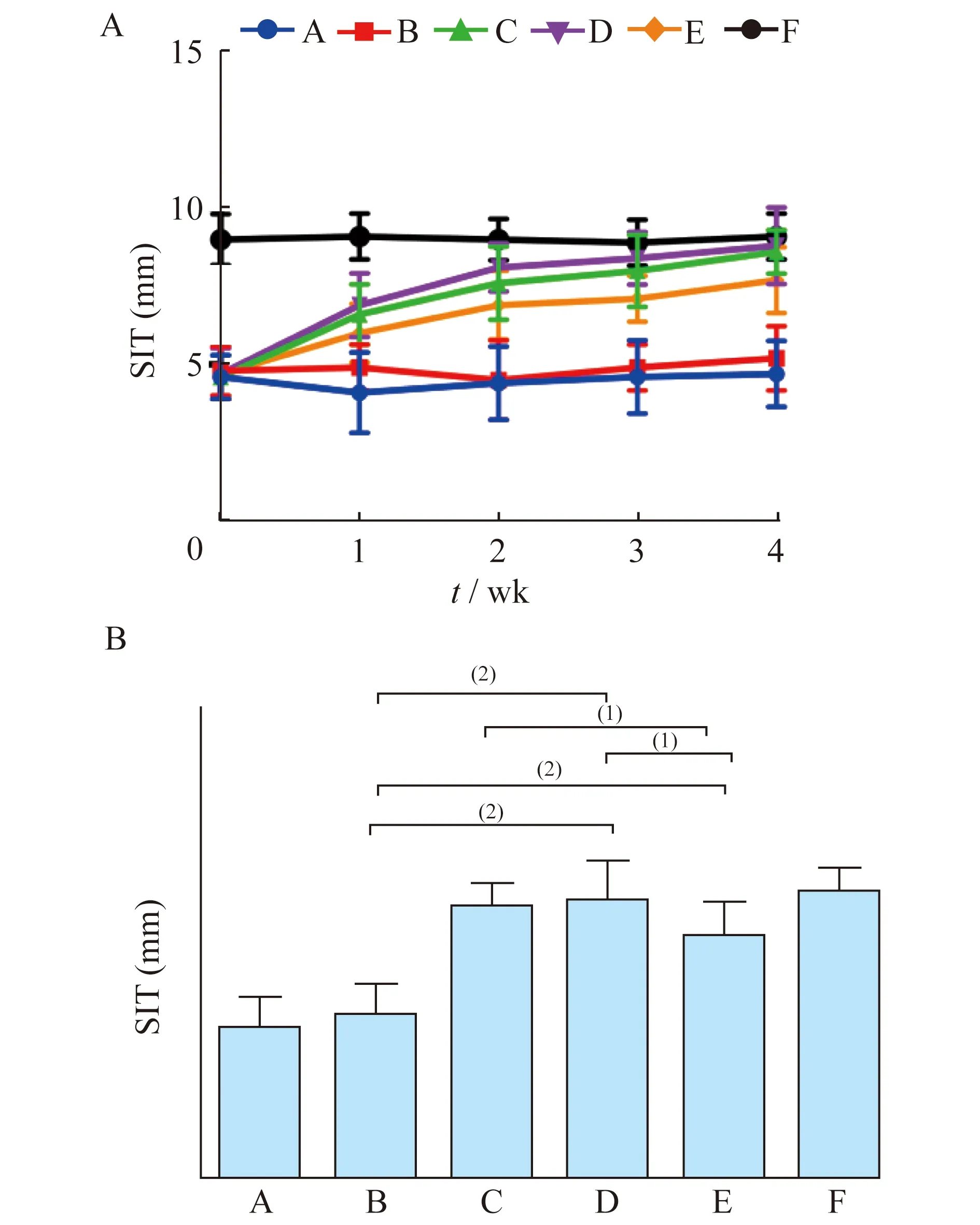
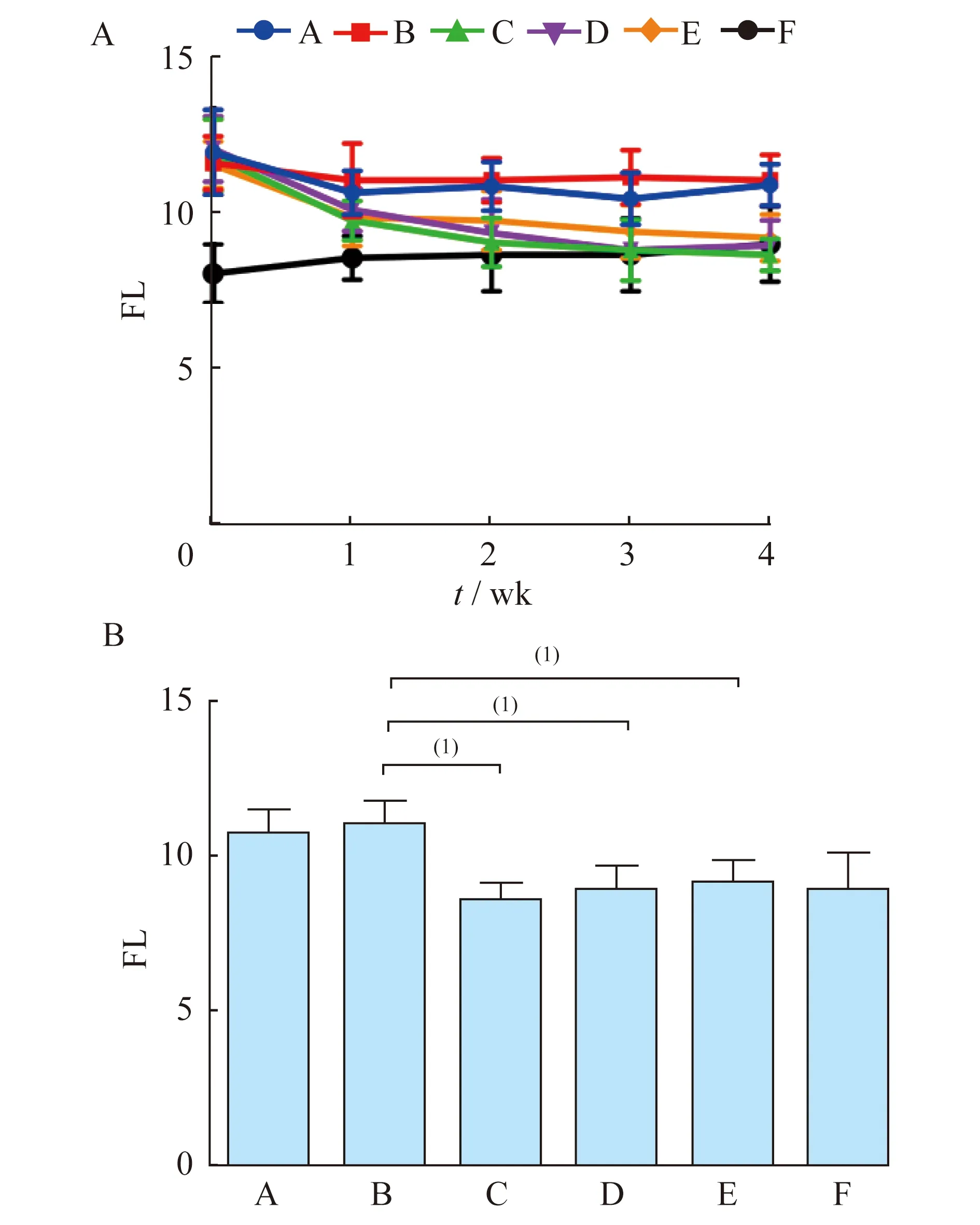
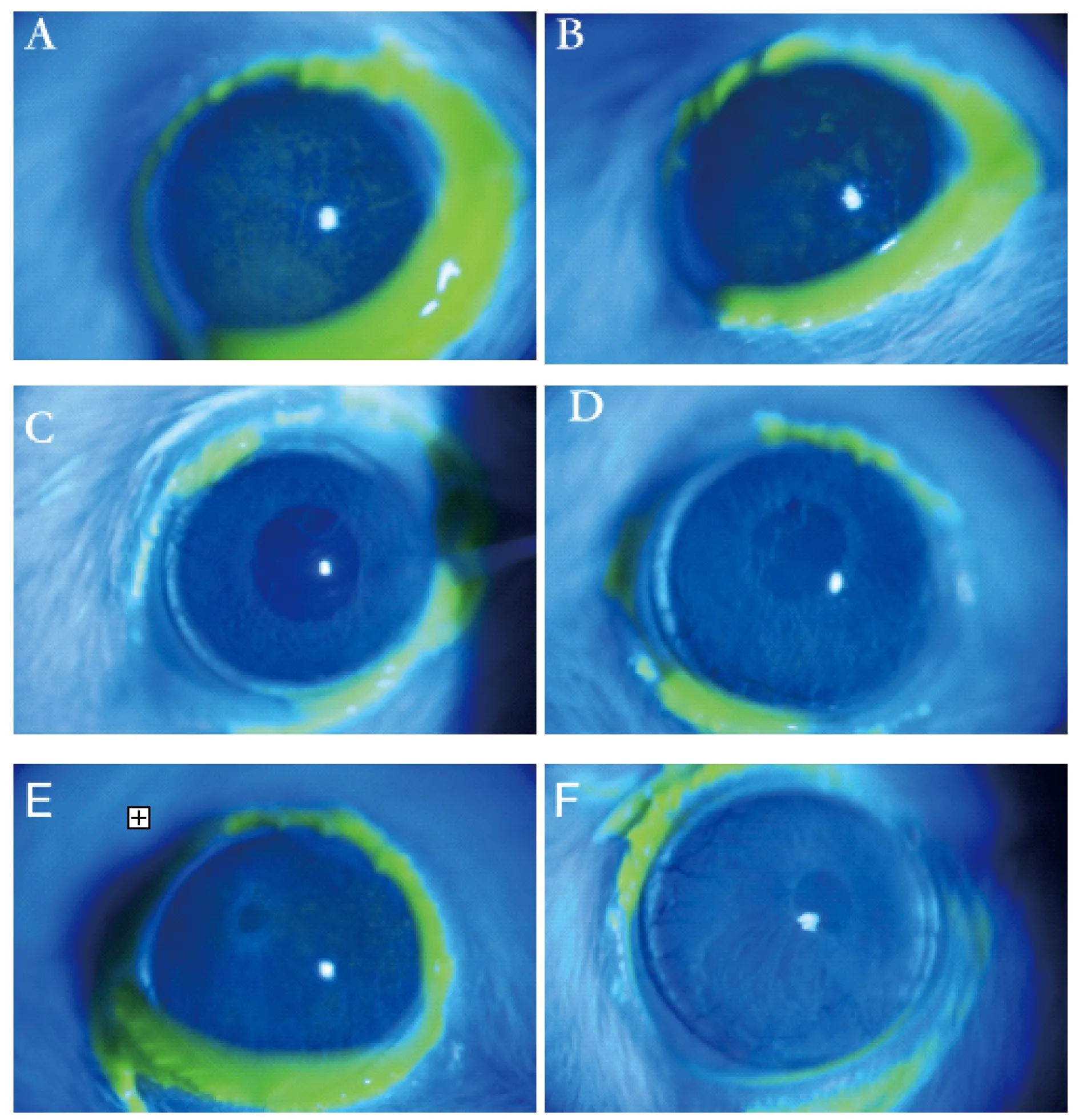
干眼指标变化治疗前,A、B、C、D、E组即经BAC诱导的干眼模型组间的大鼠泪液分泌量及BUT未见明显差异,各组泪液分泌量及泪膜稳定性均明显低于正常对照组(P均<0.05);经过4周治疗,羊膜凝胶可明显促进泪液分泌,延长BUT,提示羊膜凝胶可有效改善造模后大鼠泪液分泌量减少的情况,有效促进泪膜的稳定性(表1,图1、2)。通过角膜荧光染色评分来评价大鼠角膜上皮的完整性:A、B组大鼠的角膜荧光染色评分较高,角膜上皮缺损程度严重,而C、D及E组大鼠经过4周治疗,角膜上皮荧光染色评分明显下降,但与F组间仍有明显差距。尽管C、D组的角膜荧光染色评分与E组相比差异无统计学意义,但是从第3周开始C、D组的角膜荧光染色评分低于E组(表1,图3),提示羊膜匀浆提取液和羊膜凝胶均可在一定程度上减少干眼大鼠的角膜上皮着染程度,提高角膜上皮的完整性。于裂隙灯下观察角膜上皮染色状况(图4),同样可观察到A、B组大鼠角膜上皮呈大片着染,而C、D组大鼠角膜上皮仅见少量点状着染,与F组较为接近,提示羊膜匀浆提取液及羊膜凝胶能有效缓解角膜上皮缺损。
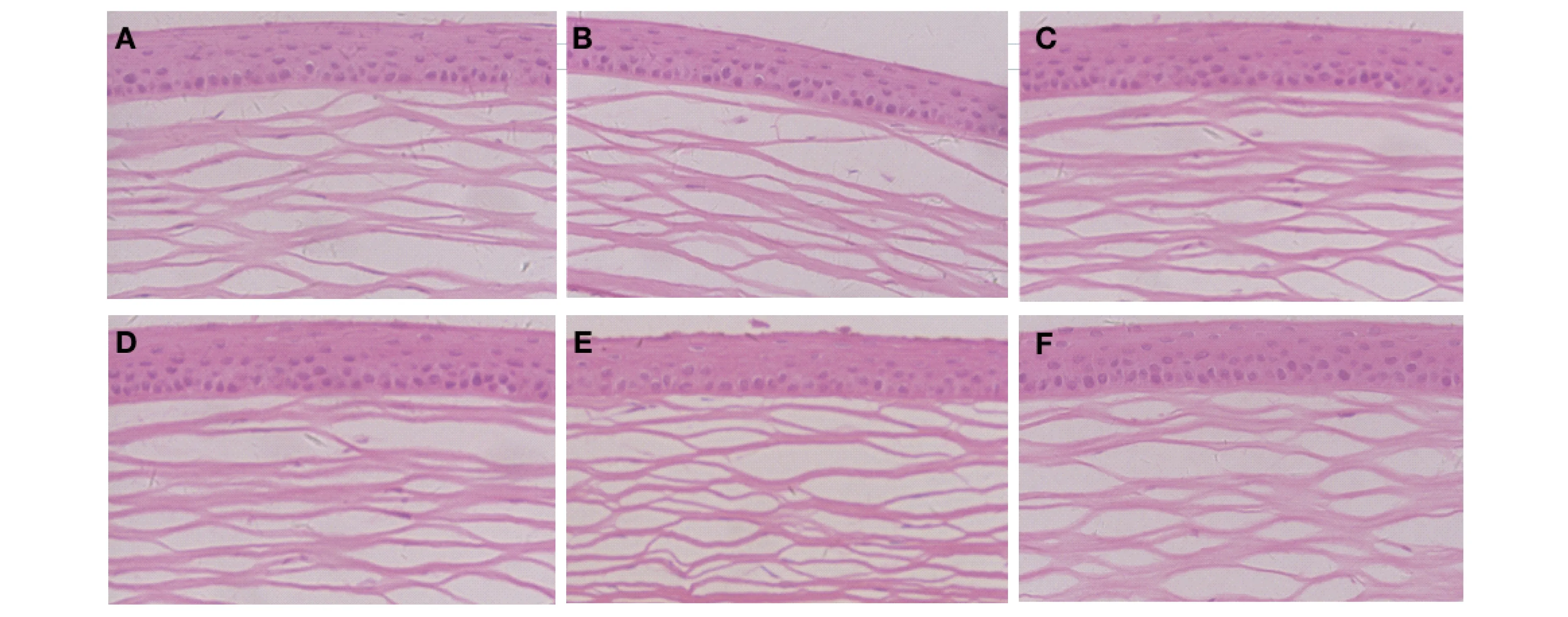
HE染色光镜下观察角膜组织变化(×200),A、B组大鼠角膜上皮细胞分层模糊,角膜上皮欠光滑且变薄(2~4层),最薄处仅1~2层细胞,上皮表面轻度不规则;C、D组大鼠角膜上皮较为光滑,细胞排列较为规则(4~5层);E组大鼠角膜上皮细胞与A、B组相比排列整齐,而分层较C、D组少;F组为正常小鼠,上皮分层良好(5~6层),细胞排列紧密整齐,形态较为完整(图5)。
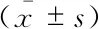
表1 大鼠分组治疗前后的干眼指标观察Tab1 Change of dry eye index before and after treatment in all groups of rats
(1)After 4 weeks of treatment.By wilcoxon rank-sum test.SIT:Schimers I test;BUT:Break-up tome;FL:Fluorescein staining.
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.SIT:Schimers I test.(1)P<0.05;(2)P<0.001.
图1 6组大鼠各时间点(A)及第4周(B)泪液分泌情况
Fig 1 The tear secretion of the rats in 6 groups at each time point(A)and the 4thweek after treatment(B)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.BUT:Break-up time.(1)P<0.05;(2)P<0.001.
图2 6组大鼠各时间点(A)及第4周(B)泪膜破裂时间变化
Fig 2 The tear break-up time of the rats in 6 groups at each time point(A)and the 4thweek after treatment(B)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.FL:Fluorescein staining.(1)P<0.001.
图3 6组大鼠各时间点(A)及第4周(B)角膜荧光染色情况
Fig 3 Corneal fluorescein staining of the rats in 6 groups at each time point(A)and the 4thweek after treatment(B)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图4 裂隙灯下6组大鼠用药4周后角膜荧光染色情况
Fig 4 Fluorescein staining of the rats in 6 groups after 4 weeks of treatment under slit-lamp
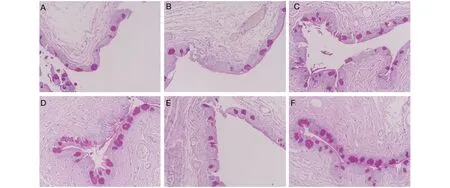
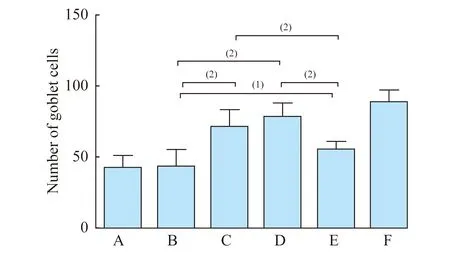
结膜PAS染色及杯状细胞计数光学显微镜下观察结膜组织(×200):A、B组大鼠结膜表面欠平整,杯状细胞大小不一,数量较少;C、D组大鼠结膜表面较为光滑,杯状细胞数目增多,大小趋于正常;E组大鼠结膜杯状细胞数目有少量增加,但显著少于C、D组;F组为正常小鼠,结膜上皮表面光滑,细胞排列整齐,杯状细胞大小较为一致,分布均匀(图6)。我们对各组大鼠结膜杯状细胞进行计数(图7):A、B组的结膜杯状细胞数目无明显差异,C、D组的结膜杯状细胞个数与B组相比,差异有统计学意义(P<0.05),提示羊膜匀浆提取液及羊膜凝胶可促进结膜杯状细胞增殖,并且羊膜凝胶促进杯状细胞增殖的作用明显优于人工泪液。
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图5 光镜下6组大鼠用药4周后角膜HE染色情况(×200)
Fig 5 Corneal HE staining after 4 weeks of treatment under light microscope(×200)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图6 光镜下6组大鼠用药4周后结膜PAS染色情况(×200)
Fig 6 Conjunctival PAS staining of the rats in 6 groups after 4 weeks of treatment under light microscope(×200)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.(1)P<0.01;(2)P<0.001.
图7 6组大鼠治疗4周后的结膜杯状细胞计数
Fig 7 Number of goblet cells of the rats in 6 groups after 4 weeks of treatment
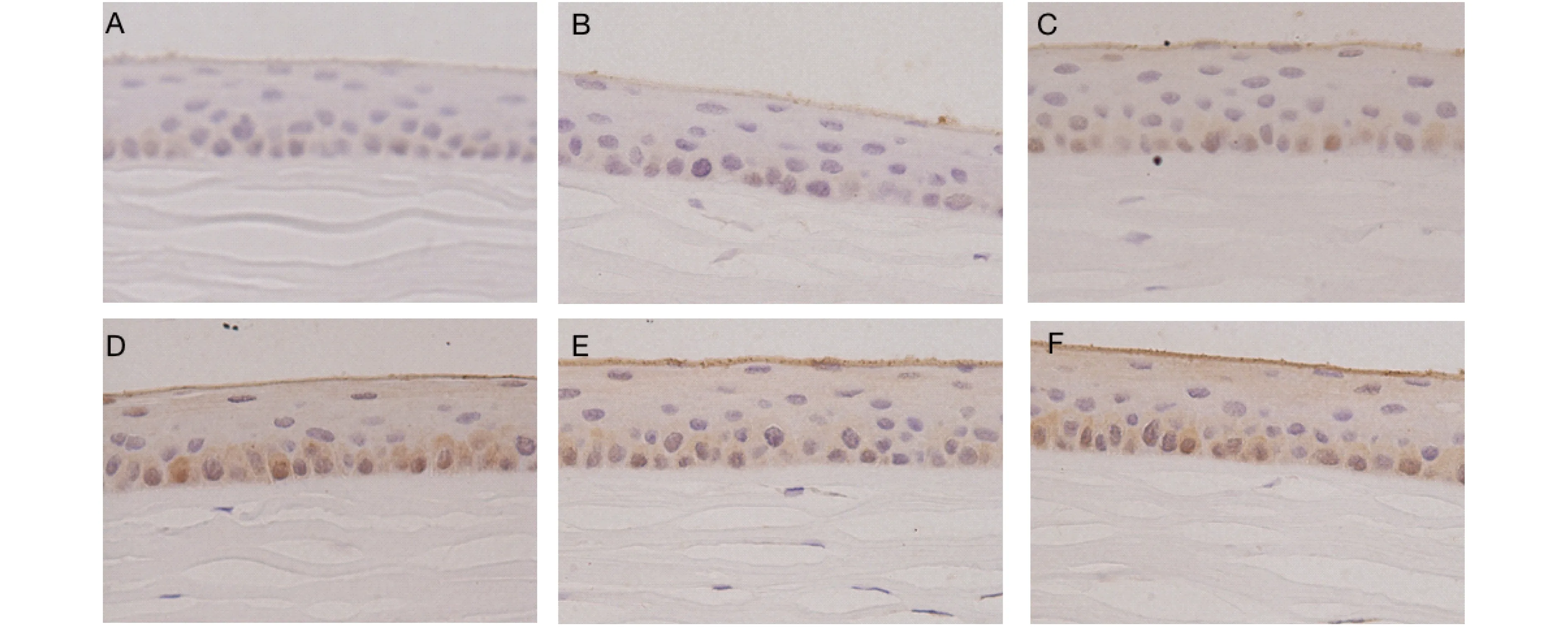
角膜上皮MUC1表达MUC1为最常见的跨膜黏蛋白,在角膜全层均有表达。我们于光学显微镜下观察角膜组织鳞状上皮化生情况(×400),表达 MUC1的细胞呈棕色染色。A、B组大鼠角膜可见MUC1免疫组化染色程度较轻,MUC1表达较少。C、D、E组大鼠角膜的MUC1免疫组化染色明显增强,其中D组大鼠MUC1表达最接近于F组正常大鼠(图8),提示羊膜凝胶可促进角膜上皮黏蛋白的分泌。
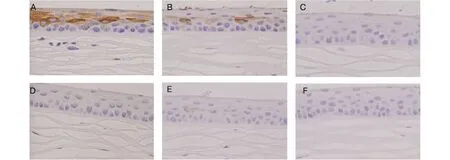
角膜上皮K10表达角膜上皮的鳞状化生是中重度干眼的典型病理表现,K10是常用的角化标记物,其表达水平常用于推测鳞状上皮化生的活跃程度。我们于光学显微镜下观察角膜组织鳞状上皮化生情况(×400),表达 K10的细胞胞质呈棕色染色。A、B组大鼠角膜上皮均可见K10高表达,而E组大鼠角膜上皮的K10表达相对较弱,C、D组大鼠角膜上皮的K10表达较接近于正常大鼠,几乎未表达K10(图9),提示羊膜匀浆提取液及羊膜凝胶可减轻结膜上皮鳞状化生程度。
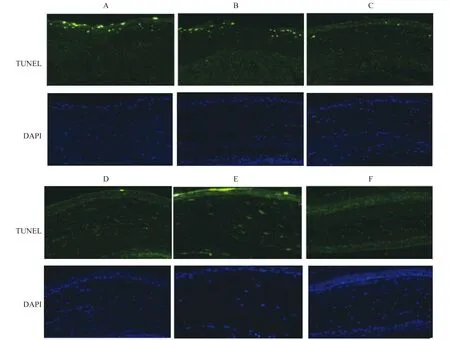
角膜上皮细胞凋亡状况细胞凋亡是干眼发生发展的重要因素之一。我们通过 TUNEL 试验观察各组大鼠治疗4周后角膜上皮细胞的凋亡状况,并判断羊膜匀浆提取液及羊膜凝胶抑制角膜上皮细胞凋亡的效果:凋亡细胞呈绿色荧光,DAPI复染细胞核呈蓝色荧光。A、B组大鼠角膜上皮可见较多凋亡细胞,E 组大鼠角膜上皮也可见凋亡细胞,但数量较A、B组少,而C、D组大鼠角膜上皮的凋亡细胞明显减少(图10),提示羊膜匀浆取液及羊膜凝胶可一定程度上抑制角膜上皮细胞凋亡。
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图8 光镜下6组大鼠用药4周后角膜上皮MUC1的表达(×400)
Fig.8 MUC1 expression in corneal epithelium of the rats in 6 groups under light microscope after 4 weeks of treatment(×400)
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图9 光镜下6组大鼠用药4周后角膜上皮K10的表达(×400)
Fig 9 K10 expression in corneal epithelium of the rats in 6 groups under light microscope after 4 weeks of treatment(×400)
讨 论
干眼是一种涉及多种病理机制的多因素眼表疾病,任何原因引起的泪膜异常均可引起干眼,导致眼表上皮微绒毛减少、结膜杯状细胞丢失甚至会引起角结膜鳞状上皮化生及上皮细胞的凋亡。近年来干眼的发病率逐渐升高并呈年轻化趋势。
羊膜呈半透明,无血管、神经及淋巴,几乎无抗原性,是重建眼表的良好生物学材料。本研究在羊膜匀浆提取液的基础上制作羊膜凝胶,将其应用于BAC诱导的大鼠干眼模型,发现其可促进干眼大鼠的泪液分泌,维持泪膜稳定性,还能够降低荧光素钠角膜着染的程度,保护角膜上皮完整性,可明显改善大鼠干眼症状。
泪膜主要由睑板腺分泌的脂质层、泪腺及副泪腺分泌的浆液层及眼表上皮杯状细胞分泌的黏液层所构成。正常泪膜具有润滑眼表、保护角膜及结膜上皮、抑制微生物生长等作用,并且能为角膜提供必需的营养物质。MUC5AC是泪膜黏蛋白层的骨架成分,通过黏附在角结膜表面,起到润滑角结膜上皮及保护眼表的作用。干眼引起的慢性或严重炎症可以减少杯状细胞[9],影响其分泌黏蛋MUC5AC,导致干眼患者的MUC5AC及其mRNA水平与正常人相比明显下降[10]。由于泪膜中的黏蛋白MUC5AC含量与结膜穹窿部的杯状细胞数量密切相关,我们通过对结膜杯状细胞进行PAS染色,计数穹窿部的杯状细胞数目,间接反映MUC5AC的分泌水平,以评估干眼的严重程度。结果发现,A、B组大鼠的结膜穹窿部只见散在的、紫红色着染的杯状细胞,而经过4周治疗的C、D组大鼠结膜杯状细胞广泛分布于穹窿部上皮细胞之间,密度明显增加,排列较规则,说明羊膜匀浆提取液及羊膜凝胶可以通过促进结膜杯状细胞增殖,维持泪膜的稳定性。除MUC5AC外,MUC1也是泪膜黏蛋白层的重要组分。与正常标本相比,在BAC诱导的干眼或干燥综合征模型中MUC1表达均有下降[11]。我们采用免疫组化染色法观察镶嵌在上皮细胞膜上的 MUC1表达。结果表明,羊膜匀浆提取液及羊膜凝胶可维持角膜上皮MUC1的高表达,有助于维持泪膜的稳定性,而泪膜的改善又提供了更好的角膜上皮保护作用。
A:Dry eye control group;B:Solvent control group;C:Amniotic membrane extract treated group;D:Amniotic membrane gel treated group;E:Artificial tear drops treated group;F:Normal control group.
图10 6组大鼠用药4周后角膜上皮TUNEL试验结果(×200)
Fig 10 TUNEL assay results in corneal epithelium of the rats in 6 groups after 4 weeks of treatment(×200)
角膜的最外层表面由非角质化上皮组成,可作为防止泪液流失和病原体渗透的保护屏障,并为视力提供透明介质。正常情况下,眼表上皮还可分泌黏蛋白及多种生长因子和趋化因子。鳞状上皮化生是有分泌作用的非角化复层扁平上皮向无分泌作用的角质化复层上皮转化的一种病理过程,可表达角化上皮标记物K10,是眼表病情恶化的重要表现之一。它常见于中重度干眼,角膜缘干细胞功能障碍和维生素A缺乏症等眼表疾病,往往伴随着慢性炎症反应、黏蛋白减少等一系列病理改变。本实验免疫组化结果显示,A、B组的大鼠角膜和结膜上皮均呈K10表达强阳性。经羊膜匀浆提取液及羊膜凝胶治疗4周后,大鼠角结膜上皮K10表达减少,提示羊膜提取液及羊膜凝胶可通过抑制鳞状上皮化生,从而缓解干眼症状,改善眼表损伤,且两种治疗方式间未见明显差异。
细胞凋亡是一种生理性的细胞死亡,以去除不必要的或异常的细胞[12]。角膜和结膜上皮细胞的凋亡与干眼密切相关[13-14]。我们研究了大鼠角膜上皮细胞的凋亡状况,通过TUNEL染色发现C、D组凋亡细胞明显少于A、B组,提示羊膜提取液及羊膜凝胶在大鼠干眼模型中通过抑制角膜上皮细胞凋亡起到保护角膜的作用。
综上所述,羊膜凝胶对BAC诱导的大鼠干眼模型具有一定的疗效,可通过促进角膜上皮细胞增殖,抑制上皮细胞凋亡增加,也可通过促进杯状细胞增殖和维持MUC1表达来补充泪膜,并能减轻角结膜上皮细胞鳞状化生,其治疗效果与羊膜匀浆液无明显差异,在干眼的治疗中可能具有很好的应用前景。
