肺癌合并慢性阻塞性肺疾病(COPD)患者围手术期优化管理的研究进展
2019-05-16胡湘麟综述审校
胡湘麟(综述) 杨 冬(审校)
(复旦大学附属中山医院呼吸科 上海 200032)
原发性支气管肺癌简称肺癌,是起源于支气管黏膜或腺体的恶性肿瘤,其发生率和死亡率均居肿瘤的首位[1]。肺癌起病隐匿、进展迅速,待出现临床症状时病情多已进入晚期。早期发现并行根治性手术是当前肺癌治疗最有效的方式。然而,部分可手术切除的肺癌患者术前就已合并有冠心病、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等心肺系统疾病,患者的心肺储备功能严重受损,对麻醉和手术的耐受能力明显降低[2]。其中,肺癌合并COPD的情况复杂,尤其值得临床医师关注和重视。
COPD是肺癌发生的独立危险因素,COPD可通过慢性炎症、基因突变、氧化/抗氧化失衡和纤毛运动功能障碍等潜在机制来增加肺癌发生的风险[3]。临床队列研究发现,在COPD患者中每年约有1.7%会发生肺癌,且肺癌发生的风险与COPD的严重程度有关[4]。在手术治疗的肺癌患者中有20%~40%合并COPD[5-6]。COPD不仅降低肺癌患者的生活质量,增加手术风险,而且在术后并发症、术后肿瘤复发转移和术后生存等方面也存在负面效应,严重削弱手术治疗的效果[7-8]。因此,在围手术期间优化对COPD的管理、减轻COPD的不利影响是肺癌合并COPD患者进行手术治疗的必然要求。本文通过总结合并COPD对肺癌患者围手术期的影响,就近年来为优化肺癌合并COPD患者围手术期管理而开展的一系列措施作一综述。
合并COPD的可手术肺癌患者的临床特征相对于未合并COPD的可手术肺癌患者,合并COPD的可手术肺癌患者中男性所占比例更大,患者平均年龄更高,有吸烟史的人数也更多[5,8-10]。肺功能检查显示,肺癌合并COPD患者的肺功能指标如第1秒用力呼气容积(forced expiratory volume in one second,FEV1)占预计值的百分比(FEVl% pred)、FEV1与用力肺活量(forced vital capacity,FVC)之比(FEV1/FVC)以及肺CO弥散量(diffusion capacity for CO of the lung,DLCO)占预计值的百分比(DLCO% pred)均明显差于未合并COPD的肺癌患者[5,7-8]。而在COPD的严重程度上,根据COPD全球倡议(global initiative for chronic obstructive lung disease,GOLD)分级标准,肺癌合并COPD的患者以轻度(GOLD 1级)和中度(GOLD 2级)最为常见[5,7],这也验证了de Torres等[4]通过队列研究发现的处于GOLD 1级和2级的患者具有更高的肺癌发生率。
国内外数据表明,在接受手术治疗的肺癌合并COPD患者中65%~80%临床分期处于Ⅰ~Ⅱ期,但肺癌患者所处的临床分期与患者是否合并COPD不相关(P>0.05)[8-10]。在肺癌的组织分化方面,COPD肺癌组以中低分化的肺癌更为常见,提示COPD相关肺癌较非COPD的肺癌可能具有更高的恶性潜能[10]。在肺癌的组织分型方面,COPD肺癌组以肺鳞癌最为常见,而非COPD肺癌组则以肺腺癌最为常见[8-9]。Sekine等[5]进一步发现中重度COPD肺癌组以肺鳞癌最常见,而非COPD肺癌组和轻度COPD肺癌组则以肺腺癌最常见。
合并COPD对肺癌患者围手术期的影响
降低或推迟手术机会 Hashimoto等[11]通过对ⅠA~ⅢA期肺癌患者的回顾性研究发现,尽管这些患者肿瘤分期都符合根治性手术的标准,但COPD肺癌组患者的手术率(64.1%)显著低于非COPD肺癌组(81.7%)。COPD肺癌患者气道阻塞程度越重,手术率越低。多变量分析显示,重度COPD是影响肺癌患者手术治疗的独立因素(OR=0.025,95%CI:0.004~0.167)。Seda等[12]在回顾性研究中表明,合并COPD会明显推迟肺癌患者的手术时间,推迟的中位天数长达38天,这可能与肺癌患者合并COPD时需要更长时间的术前准备和评估有关。总之,肺癌合并COPD患者的肺功能减退,患者可能因此失去手术机会或延迟手术。
增加术后并发症 肺癌患者术后可发生多种肺部并发症,如肺部感染、肺不张、胸腔积液、气管切开、支气管胸膜瘘、持续性肺漏气甚至是急性呼吸窘迫综合征等,而合并COPD会明显增加这些并发症的发生风险[12-16]。Kim等[8]研究表明,对于肺癌合并COPD患者,即便COPD尚处在早期阶段(FEVl%≥70% pred),其术后肺部并发症的发生率(30.1%)也显著高于非COPD的肺癌患者(10.0%)。肺癌术后肺部并发症的发生率与COPD的严重程度呈正相关[5,17],中重度COPD肺癌组(GOLD 2~3级)术后肺部并发症的发生率(46.0%)显著高于轻度COPD肺癌组(24.0%)和非COPD肺癌组(17.1%)[17]。多变量分析显示,中重度COPD是肺癌患者术后发生肺部并发症的独立风险因素(OR=3.88,95%CI:1.85~8.14)[17]。此外,合并COPD亦是肺癌患者术后发生房颤或室上性心动过速等心律失常的危险因素[5,18]。由此可见,COPD与肺癌的术后并发症关系密切,合并COPD可增加肺癌患者术后并发症的发生,这可能与肺癌患者合并COPD时肺部存在大量痰液潴留有关。
促进术后肿瘤复发转移 气道慢性炎症是COPD的基本特征之一,多种炎症介质和细胞因子参与形成促进肺癌发生发展的微环境,如果这种炎症微环境一直持续,就可能在术后肿瘤复发转移中继续发挥效应。多项回顾性研究表明,COPD是肺癌术后肿瘤复发转移的重要危险因素,COPD肺癌组术后肿瘤复发转移率(21.3%~26.2%)显著高于非COPD肺癌组(13.5%~15.3%)[19-21],且COPD越严重,患者术后肿瘤复发转移率越高[21]。合并COPD的肺癌患者具有更高的术后脑部转移性复发风险(OR=7.88,95%CI:1.5~41.3),而未合并COPD的肺癌患者则更倾向于骨和肝的转移性复发(OR=4.13,95%CI:1.1~15.8)[20]。Qiang等[21]研究显示,中重度COPD肺癌组的5年无复发生存率(46.4%)显著低于轻度COPD肺癌组(70.4%)和非COPD肺癌组(78.4%)。中重度COPD是肺癌患者术后无复发生存的独立不良预后因素(OR=2.20,95%CI:1.07~4.48;HR=1.718,95%CI:1.086~2.919)[17,21]。以上结果表明,合并COPD会增加肺癌患者术后肿瘤复发转移风险,COPD可能在肺癌术后肿瘤复发转移中发挥促进作用。
缩短术后生存期 COPD肺癌患者的术后远期生存明显不及非COPD肺癌患者[19,22]。Zhai等[6]研究证明,COPD肺癌患者的术后5年总生存率(54.4%)和术后5年无进展生存率(50.1%)均显著低于非COPD肺癌患者(69.0%vs.60.6%),且COPD与不良预后的关系在男性肺癌患者(校正HR=1.50,95%CI:1.12~2.01)和肺鳞癌患者(校正HR=1.50,95%CI:1.04~2.15)中表现更为紧密。肺癌患者的术后总生存期还与COPD的严重程度有关。Sekine等[5]和Bugge等[7]研究发现,与非COPD的肺癌患者相比,轻中度COPD肺癌患者的术后总生存期并无明显差异,但重度COPD肺癌患者的术后总生存期则显著缩短。多变量分析显示,重度COPD是影响肺癌患者术后总体死亡率的独立风险因素(HR=2.774,95%CI:1.778~4.328)[5]。重度COPD肺癌患者与轻中度COPD以及非COPD的肺癌患者相比,术后远期死亡风险(HR=1.69,95%CI:1.12~2.55)增加69%[7]。由此可见,合并COPD,尤其是重度的COPD,对肺癌患者的术后远期生存影响重大,COPD可缩短肺癌患者的术后远期生存期,这可能与合并COPD的肺癌患者更容易发生术后并发症和术后肿瘤复发转移有关。
肺癌合并COPD患者围手术期优化管理的措施合并COPD对肺癌患者的手术机会、术后并发症、术后肿瘤复发转移和术后远期生存等方面造成严重的不良影响。围手术期间可通过吸入支气管扩张剂、联合吸入糖皮质激素、合理使用抗生素、静脉给予氨溴索和戒烟等措施来优化对COPD的管理,从而提高肺癌合并COPD患者的手术机会或降低术后并发症。优化COPD管理是否也能降低患者的术后肿瘤复发转移以及延长术后远期生存,目前尚缺乏直接的研究证据。由于合并COPD对肺癌患者的围手术期造成诸多不利影响,针对COPD的管理在肺癌合并COPD患者的围手术期管理中至关重要。加之可明显提高患者心肺耐力的肺康复训练,在完善术前风险评估、优化手术方式和技术并辅以其他有利因素的情况下,将会有更多的肺癌合并COPD患者安全接受手术并获得良好的术后效果(图1)。
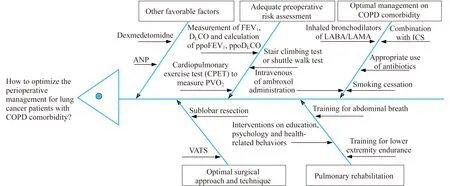
图1 优化肺癌合并COPD患者围手术期管理的鱼骨图
Fig 1 Fishbone diagram of how to optimize the perioperative management for lung cancer patients with COPD comorbidity
优化对COPD的管理
吸入支气管扩张剂 以噻托溴铵为代表的长效抗胆碱能药物(long-acting muscarinic antagonist,LAMA)和以沙美特罗、福莫特罗为代表的长效β2受体激动剂(long-acting beta-agonist,LABA)是COPD稳定期治疗时的常用支气管扩张药物。Kobayashi等[23]的回顾性研究表明,术前2周吸入噻托溴铵可明显提高肺癌合并COPD患者的FEVl和FVC等肺功能指标,从而使原本处在临界肺功能的患者重新获得手术治疗的机会。围手术期间吸入噻托溴铵还可有效预防肺癌合并COPD患者术后心肺并发症的发生。围手术期间吸入噻托溴铵的COPD肺癌患者术后肺部并发症的发生率(2%)和心血管并发症的发生率(16%)均显著低于未吸入的COPD肺癌患者(18%,33%)。吸入噻托溴铵的COPD肺癌患者术后炎症指标(如白细胞计数和C反应蛋白)水平均较未吸入者明显降低,提示吸入噻托溴铵可能通过减轻COPD的肺部炎症反应而减少术后肺部并发症[24]。吸入噻托溴铵还可增强COPD肺癌患者的术后左室舒张功能,这可能是该类患者术后心血管并发症较少的原因之一[25]。Leiro等[26]也在前瞻性研究中表明,肺癌合并COPD患者围手术期间联合吸入LABA和LAMA后,同样可能提高肺功能和增加手术机会。对于合并中重度COPD的肺癌患者,围手术期联合吸入噻托溴铵和沙美特罗除能提高肺功能外,还可有效维持患者的术后生活质量[27]。吸入支气管扩张剂发挥上述效应的原因可能在于,支气管扩张剂能缓解COPD肺癌患者的气道痉挛,降低气道阻力,改善肺的过度充气状态,减少痰液的产生及其在肺部的潴留,从而增加手术机会并减少术后并发症。
联合吸入糖皮质激素 COPD是一种以持续性气流受限为特征的慢性气道炎症性疾病,吸入支气管扩张剂虽能有效改善COPD的气流受限情况,但对控制COPD的慢性炎症反应却起效甚微。吸入型糖皮质激素(inhaled corticosteroid,ICS)作为一种广泛使用的非特异性抗炎药物,能有效抑制COPD的炎症反应,减轻呼吸膜水肿,并增强气道平滑肌细胞β2受体的敏感性,通过与LABA/LAMA互补协同作用,能提高肺功能、减少COPD急性加重、改善呼吸系统症状并提高健康状况[28]。在肺癌合并COPD患者的吸入治疗中,在LABA/LAMA的基础上加入ICS同样能够取得更优的效果。Bolukbas等[29]通过前瞻性随机对照试验将肺癌合并COPD患者分为两组,分别予以噻托溴铵/福莫特罗/布地奈德三联吸入治疗(n=24)和噻托溴铵/福莫特罗二联吸入治疗(n=22),尽管两组患者的肺功能指标均有所提高,但三联吸入组中FEV1% pred 提高大于10%的患者比例(50.0%)显著多于二联吸入组(9.1%);此外,三联吸入组术后肺部并发症的发生率(11.1%)显著少于二联吸入组(42.9%),表明围手术期联合吸入ICS不仅能更有效地提高COPD肺癌患者的肺功能,还能更进一步地减少术后肺部并发症。由COPD所介导的慢性炎症既是肺癌发生的潜在机制,又是肺癌术后肿瘤复发的促成因素,因此抗炎治疗可能在COPD或肺癌合并COPD患者中发挥特别的作用。目前已有部分观察性研究初步提示,规律、足量应用ICS可能会对COPD相关肺癌起到预防作用[30-31]。在围手术期间(特别是术后),长期合理使用ICS是否能通过抑制COPD的炎症反应而起到预防肺癌术后肿瘤复发转移的作用,理应在未来得到积极的探究。
合理使用抗生素 Yamada等[32]的回顾性研究表明,合并COPD的肺癌患者术前存在气道致病性细菌定植的比例(19.9%)显著高于非COPD肺癌患者(10.9%),且COPD肺癌患者术后肺炎发生率(15.2%)显著高于非COPD肺癌患者(3.6%),COPD是肺癌患者发生术后肺炎并发症的风险因素。肺癌患者术前存在气道致病性细菌定植可能与患者发生术后肺炎密切相关(OR=3.363,95%CI:1.467~7.711)[33]。由于术后肺炎是造成肺癌患者围手术期死亡的主要因素,术后并发肺炎的肺癌患者术后5年总生存率(47.2%)较未并发者(67.3%)显著下降。Yamada等[32]认为,对于肺癌合并COPD患者,应在术后针对金黄色葡萄球菌和革兰氏阴性杆菌预防性使用抗生素,以减少术后肺炎的发生和潜在致病菌的不利作用。目前肺癌合并COPD患者围手术期使用抗生素尚缺乏前瞻性的研究结果,相关结论还有待更加深入的研究和证实。
静脉给予氨溴索 盐酸氨溴索作为COPD管理中的祛痰类药物,能够降低痰液黏稠度并增加支气管纤毛摆动,从而易于痰液排出,且在一定程度上发挥着抗炎、抗氧化和促进肺泡表面活性物质分泌的作用。临床小样本随机对照试验发现(氨溴索组和对照组各30例),肺癌手术当天至术后3天,大剂量静脉注射盐酸氨溴索(1 000 mg/d)能有效改善FEV1% pred、FEV1/FVC%和DLCO%等术后肺功能指标,降低术后肺部并发症,减少术后住院天数和住院费用,氨溴索可能增加肺组织中的抗生素浓度,通过与抗生素协同而起到有效减少术后肺炎的作用[34]。Wang等[35]认为,围手术期间静脉给予大剂量的氨溴索特别适合合并有基础肺疾病(如COPD)而又需行心肺相关手术的患者。对于合并有COPD的肺癌患者,为了减少其术后肺部并发症,Wang等[35]推荐可在围手术期间常规地静脉给予大剂量的氨溴索,但此结论需在临床上更进一步论证和探究。
戒烟 吸烟是肺癌和COPD的共同危险因素,戒烟既是预防肺癌的有效方式,又是COPD管理的重要措施。然而,肺癌患者术前是否需要戒烟却历来受到争议。传统观点认为,吸烟会促进肺癌患者的痰液分泌,增加肺癌患者术后并发症的发生[36]。现时吸烟的肺癌患者术后肺部并发症的发生风险约为从未吸烟者的5.42倍;而已戒烟的肺癌患者术后肺部并发症的发生风险则下降到从未吸烟者的2.8倍[22]。有学者更为细致地指出,肺癌患者术前戒烟应当具有足够长的持续时间。术前短期内戒烟(≤2周)的肺癌患者由于失去平常香烟烟雾所引起的刺激性咳嗽,反而可能导致痰液黏稠和不易排出,更容易陷入术后肺部并发症的风险之中。Raviv等[37]建议,在推迟肺癌手术可行的情况下,让肺癌患者术前戒烟1~2个月最优。但是,最新研究发现,肺癌患者术前是否戒烟以及戒烟所持续的时间长短与肺癌患者的术后肺部并发症之间并无相关关系,术前戒烟并无减少肺癌术后肺部并发症的作用[38-39]。有关临床指南曾明确指出,无需为戒烟而刻意推迟肺癌患者的手术时间[40]。肺癌合并COPD患者在遵循此原则的情况下应注意到,围手术期间COPD相关吸入治疗只有在戒烟的前提条件下才会有效,如吸入噻托溴铵并不能改善术前继续吸烟者的肺功能指标[23]。对于肺功能尚不足以满足手术要求的COPD肺癌患者术前应积极加强吸入治疗,并在吸入治疗的过程中严格配合戒烟这一辅助因素,在术后彻底告别烟草。
肺康复 围手术期肺康复是指通过指导患者进行一系列的呼吸训练和有氧运动,从而提高患者围手术期心肺耐力和身体状况的治疗项目,其主要内容包括:予以患者腹式呼吸训练,以改善肺通气,并增强呼吸肌肌力、有助于术后咳痰和咳嗽;予以患者跑步、爬楼梯等下肢耐力训练,以增强心力储备,并有助于术后早期下床活动;予以患者教育、心理和健康行为干预,以减轻患者对肺癌手术的恐惧和担忧等[41]。术前肺康复在肺癌患者的围手术期管理中具有重要的作用。Divisi等[42]研究认为,术前肺康复能有效提高肺癌合并COPD患者的心肺功能参数,解除心肺功能不足对肺癌手术的约束,从而使更多的肺癌合并COPD患者能够接受手术。Stefanelli等[43]研究发现,术前肺康复改善肺癌合并COPD患者峰值氧耗量(peak VO2,PVO2)的作用能够一直持续到术后。术前肺康复可能具有降低肺癌术后并发症、促进术后快速康复的作用[44]。Kobayashi等[23]指出,肺癌合并COPD患者在有限的术前时间,单纯的运动肺康复可能并不会取得最佳的效果,术前肺康复与术前吸入相互结合可作为术前药物吸入治疗的重要补充。Lai等[45]提出相似观点,提倡物理肺康复与药物肺康复相统一的综合肺康复模式。

优化手术方式和技术
亚肺叶切除术 合并COPD的肺癌患者由于术前已存在肺功能不足,在保证根治性手术的基础上,还应尽量保留患者的正常肺组织和肺功能。在肺功能较差的早期肺癌老年患者中,亚肺叶切除术能够取得与肺叶切除相似的术后生存效果[47-48],且亚肺叶切除组术中失血更少,手术时间和术后住院时间更短[48]。在正确掌握肺癌亚肺叶切除相关适应证的前提下[49],对于处在高风险组的肺癌合并COPD患者,亚肺叶切除可能是一种相对更优的手术方式。
电视辅助胸腔镜手术 与传统的开胸手术相比,电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)具有创伤小、安全性高、术后并发症少和恢复快等诸多优点。Jeon等[50]报道,经VATS治疗的肺癌合并COPD患者术后肺部并发症的发生率(1.1%)显著少于开胸手术组(12.1%),且VATS治疗组的手术时间和术后住院时间更短。因此,VATS可以作为肺癌合并COPD患者手术治疗时所优先选择的技术[50]。
其他有利因素
右美托咪定 COPD患者肺组织过度充气,肺泡周围毛细血管受压减少,肺部通气/血流比例失调,构成死腔样的无效通气。肺癌手术时需要进行单肺通气,更加不利于患者的术中氧合功能。研究表明,肺癌合并COPD患者术中应用右美托咪定可有效改善呼吸力学参数,减少死腔样通气和提高氧合指数,并有降低术后肺部并发症的作用[51]。
心房钠尿肽 长期伴有缺氧和/或二氧化碳潴留的COPD患者交感神经兴奋性往往增强,术后发生心血管事件的风险增高。心房钠尿肽(atrial natriuretic peptide,ANP)是由人心房肌细胞所合成的一种肽类激素,除传统的抗交感活性外,还能改善左室舒张功能,具有确切的围手术期心脏保护作用。研究发现,ANP具有抗炎和减轻急性肺损伤的作用[52]。Nojiri等[52]研究发现,术前接受低剂量ANP处理的肺癌合并COPD患者,其术后心肺相关并发症的发生率(14%)显著低于未经ANP处理的患者(36%),术前低剂量ANP可能通过抗交感效应和抗炎效应而对患者的术后心肺相关并发症起到预防作用。
在诊断方面的问题尽管高达60%的早期肺癌患者均合并COPD[7],但COPD在肺癌患者中的诊断和检出却严重不足。根据复旦大学附属中山医院的调查数据显示[53],在肺癌合并COPD患者中COPD的诊断率仅有7.1%,非呼吸科医师(主要为胸外科)对COPD的诊断率(2.9%)明显低于呼吸科医师(34.8%)。相对于COPD这种长期慢性稳定疾病,肺癌往往高度恶性且危及生命,非呼吸科医师可能重视肺癌而忽略COPD。肺癌和COPD作为两大类呼吸系统疾病,均存在气短、咳嗽等呼吸系统症状,肺癌合并COPD时COPD症状可能会被肺癌症状所掩盖,从而不易引起非呼吸科医师对COPD的注意。因此,对于入院的可手术早期肺癌患者,建议在术前常规进行肺功能测定以及支气管舒张试验[9],并在呼吸科医师的专业指导下,明确诊断是否合并COPD,从而有效防止COPD漏诊。本文通过总结可手术肺癌患者合并COPD时的临床特征,提醒临床医师考虑肺癌合并COPD的情况,对于高龄、男性、具有吸烟史或组织分型为肺鳞癌的肺癌患者,应当尤其注意有无合并COPD。
在治疗方面的问题COPD在肺癌患者中的诊断不足会导致其在肺癌围手术期间治疗不充分,且非呼吸科医师对COPD的规范化治疗水平明显不及专业的呼吸科医师[9,53],以致于临床实践中COPD对肺癌患者围手术期的危害未能得到真正的减轻。在当前肺癌合并COPD的治疗方面,还面临着许多值得探讨和优化的问题:首先,针对肺癌合并COPD患者联合应用哪几种措施最为合适?如是否需要在吸入LABA/LAMA的基础上加入ICS?是否需要再联合氨溴索等?即COPD管理措施在联合应用上的优化问题。其次,各种COPD管理措施在肺癌患者术前多久开始应用?在肺癌患者有限的术前时间内,至少应持续应用多久?以及术后是否继续应用?即COPD管理措施在应用时间上的优化问题;管理措施中各种药物的使用剂量该如何确定?如何通过剂量的调整使肺癌患者在短期内迅速达到最有效的COPD管理?如围手术期间静脉给予氨溴索就特别强调是在大剂量(1 000 mg/天)的情况下才发挥肺保护效应[35],即COPD管理措施在应用剂量上的优化问题。最后,对于处在围手术期的肺癌合并COPD患者,实施COPD管理还应特别注意相关不良反应,如吸入ICS在抗炎的同时还会抑制免疫,加之患者术后的抵抗能力降低,使用不当反而可能增加肺部感染的概率。由此可见,肺癌患者围手术期间COPD的管理远比一般患者的复杂,需要强大的呼吸科专业知识和能力才能处理。且在实际的临床工作中,不同肺癌患者合并COPD的严重程度不一,呼吸科医师应根据具体病情实施个体化的COPD管理,在上述措施的联合、时间和剂量等问题上因地制宜地作出选择。在本文中我们也只是重点“定性”而非具体“定量”地探讨了肺癌合并COPD患者的围手术期优化管理。
结语美国胸科学会(ATS)和欧洲呼吸学会(ERS)所联合发布的官方声明[54]明确指出,呼吸科医师在管理肺癌肺部合并症(如COPD、胸腔积液、肺部感染和呼吸衰竭等)中的重要作用。而Deepak等[55]的研究则更直接地确认了呼吸科医师在管理肺癌合并COPD患者中的关键作用,在呼吸科医师专业化的管理下,早期肺癌合并COPD患者可获得更高的手术治疗率和更低的死亡风险。肺癌合并COPD患者的围手术期管理涉及到呼吸、胸外、康复和麻醉等多个学科,关键性的COPD管理和肺康复主要着力于术前和术后,而胸科手术和麻醉等术中措施对优化肺癌合并COPD患者的围手术期管理同样起到决定性的作用。这就要求呼吸科医师与胸外、康复和麻醉等多学科团队协作,并在团队中发挥主导作用,打造以肺癌合并COPD患者为中心的疾病单元,多维度地拓展患者的益处。在患者术前、术中和术后的上下游管理过程中,多学科团队共同优化肺癌合并COPD患者的围手术期管理。
