氨基酸转运载体2(ASCT2)对胃癌细胞增殖的影响及其潜在机制
2019-05-16周楚灵王晓庆姜英华
周楚灵 王晓庆 姜英华 刘 锋
(复旦大学生物医学研究院医学系统生物学研究中心 上海 200032)
胃癌是一种常见的恶性肿瘤,在男性和女性中的发病率排名分别为第4和第5,致死率排名分别为第3和第5[1]。2015年中国的胃癌死亡病例高达50万[2]。
谷氨酰胺是人体中含量最丰富的氨基酸,可以为多种氨基酸、蛋白质、核苷酸及其他生物大分子的合成提供前体,包括谷胱甘肽(glutathione,GSH)[3]。当谷氨酰胺转换为亮氨酸时能激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,对细胞生长造成显著影响[4]。研究表明谷氨酰胺能影响多种肿瘤生长,如卵巢癌[5]、肝癌[6]和肺癌[7]。
氨基酸转运载体2(amino-acid transporter 2,ASCT2)是一种定位于细胞膜上的Na+依赖的中性氨基酸转运蛋白质,介导细胞对于中性氨基酸(包括谷氨酰胺)的摄取[8]。ASCT2对细胞内谷氨酰胺水平的维持有重要的作用,细胞内高水平谷氨酰胺对于维持mTOR信号通路的激活有关键作用。ASCT2被证明在多种癌症中通过控制谷氨酰胺的转运而调节细胞生长,如前列腺癌[9]、三阴性基底样乳腺癌[10]和结肠直肠癌[11],是潜在的治疗靶标。
本文通过体外实验探究ASCT2在胃癌细胞中的表达及其在胃癌细胞增殖过程中的作用,以期为胃癌的诊断治疗提供证据。
材料和方法
主要试验仪器CO2细胞培养箱(NUAIRE US AutoFlow和Thermo Scientfic Forma),细胞计数仪(Beckman),LAS-3000成像系统(FUJIFILM),扫描仪(GE Healthcare Image scanner Ⅲ),多功能酶标仪(BioTek),CKX41倒置显微镜、倒置荧光显微镜DP70、光学显微镜(Olympus),BT25S/BS2202S电子精密天平(Sartorius),5810R型/5424型离心机(Eppendorf),IQ5定量PCR仪(Bio-Rad),PCR仪(杭州博日科技有限公司),电泳仪(PowerPacTMUniversal,Bio-Rad)。
材料和试剂MGC803和HEK293FT细胞系购自上海中国科学院细胞库;SGC7901由上海交通大学于颖彦老师惠赠;AGS由上海芯片中心张庆华教授惠赠;PRMI1640培养基和DMEM/High glucose培养基(Gibco);细胞培养皿/板(Corning);胎牛血清、0.25%胰蛋白酶和青霉素链霉素溶液(Hyclone);Lipofectamine 2000转染试剂、Trizol、Alexa Fluor-488标记的抗兔IgG和Alexa Fluor-594标记的抗鼠IgG(Invitrogen);限制性核酸内切酶和T4 DNA连接酶及PCR聚合酶(NEB);感受态细胞DH5α(北京天根生化);pENTER载体(山东维真生物),PCR 产物回收试剂盒、DNA凝胶回收试剂盒及质粒小抽试剂盒(QIAGEN);PVDF 膜(Millipore);DAPI和封片剂(碧云天);SYBR Premix Ex TaqTM(Roche);氯仿和结晶紫(Amresco)。
细胞培养MGC803、AGS和SGC7901细胞系使用PRMI1640培养基培养,HEK293FT用DMEM/高糖培养基培养。培养基使用前均加入10% FBS和1%青霉素/链霉素,细胞置于37 ℃、5% CO2的细胞培养箱中培养。
稳定细胞系的建立从Sigma官网(https://www.sigmaaldrich.com)下载shASCT2序列,由上海捷瑞生物有限公司合成,上游引物:5’-CCGGC-TGGATTATGAGGAATGGATACTCGAGTAT-CCATTCCTCATAATCCAGTTTTTG-3’,下游引物5’-AATTCAAAAACTGGATTATGAGGAA-TGGATACTCGAGTATCCATTCCTCATAATC-CAG-3’。构建含有shASCT2序列的质粒,用pLKO.1-shLuciferase与质粒分别转化DH5α感受态细胞,扩增之后平板涂布,挑选测序正确的转化子扩大培养,利用质粒试剂盒抽提。利用HEK293FT细胞包装含有pLKO.1-shLuciferase和shASCT2质粒的病毒,测试病毒滴度,把病毒加入到每孔含有3×105个细胞的6孔板中,同时每孔加入6 μg/mL聚凝胺,8 h后更换完全培养基,36 h后用含嘌呤霉素的完全培养基筛选48 h;更换成正常的完全培养基,直至有克隆株形成,用Western blot或RT-PCR鉴定稳定细胞系建立情况。
构建及扩增瞬时过表达载体使用pENTER(维真生物)构建ASCT2过表达载体。转化DH5α感受态细胞,涂板培养并进行菌落PCR,挑选阳性菌落测序验证,测序正确后扩大培养,利用质粒试剂盒抽提备用。
抗体p70S6K、Phospho-P70S6K、GSK3、Phospho-GSK3、mTOR、Phospho-mTOR(CST);GAPDH(CWBIO);β-actin(PTG);羊抗鼠(二抗)、羊抗兔(二抗)(Santa Cruz)。
细胞荧光免疫取生长状态良好的细胞,用胰蛋白酶消化,进行细胞计数。在24孔板中放入细胞爬片,每孔接种1×105个细胞,培养箱中培养过夜,用1×PBS浸洗玻片3次,每次3 min;弃1×PBS,加入固定液(4%多聚甲醛,用1×PBS配制),室温放置15 min;1×PBS浸洗玻片3次,每次3 min,每孔加入0.5% Triton X-100(用1×PBS配制),室温放置30 min;1×PBS浸洗玻片3次,每次3 min,每孔加入500 mL 5% BSA(用1×PBS配制)溶液,室温放置1 h;弃去封闭液,每一细胞爬片上滴加ASCT2和Ki67一抗,4 ℃孵育过夜;1×PBS浸洗玻片3次,每次3 min,弃1×PBS后分别滴加荧光标记的二抗,室温避光孵育1 h;1×PBS浸洗玻片3次,每次3 min;每孔加入DAPI,室温避光染核1 min;1×PBS浸洗玻片3次,每次3 min。封片后在荧光显微镜下观察采集图像,使用ImageJ合并图像,使用Image-Pro 10软件进行半定量计算荧光值。
RNA提取和qRT-PCR检测使用Trizol法提取细胞内的总RNA,逆转录为cDNA。qRT-PCR 10 μL反应体系为:cDNA模板1 μL,SYBR Premix Ex TaqTM(2×)5 μL,上下游引物共1 μL(引物浓度为10 μmol/L),ddH2O 3 μL。PCR反应条件为:95 ℃、10 s;95 ℃、5 s,60 ℃、20 s,72 ℃、15 s,40个循环;60~95 ℃、15 s。
MTT法检测取生长状态良好的对数期细胞,进行消化计数,根据细胞大小调节细胞数目,按每孔1 000个细胞接种于96孔板中,周边孔加入1×PBS,共5块板,置于细胞培养箱中培养;24 h后取出1块板,每孔加入20 μL MTT溶液(0.5 g/mL,0.45 μm滤膜过滤,锡箔纸避光保存),4 h后去除培养液,每孔加入200 μL DMSO,震荡5 min,使细胞内的结晶充分溶解;酶标仪于490 nm波长下测定吸光度(D)值,绘制细胞生长曲线,重复步骤5次。
Western blot检测将经过定量的蛋白质与蛋白上样缓冲液按比例混合,置于沸水浴中5 min,12 000×g离心5 min,将管壁上蒸发的水离心至管底,震荡混匀后上样。以恒压90 V进行电泳,直到溴酚蓝指示剂到达分离胶底部时停止。将PVDF膜用甲醇活化1 min,连同滤纸、电转夹板浸泡在电转液中;将电转夹板取出,从正极到负极按照白板、海绵垫、2层滤纸、PVDF膜、分离胶、2层滤纸、海绵垫和黑板的顺序将电转夹板固定好,放入电转槽中,恒压100 V 2 h后,将PVDF膜用5%BCA封闭,室温上摇床1 h,一抗孵育,4 ℃过夜,回收一抗,TBST洗膜,室温下用二抗孵育1 h,弃二抗,TBST洗膜,用LAS-3000成像系统曝光。Western blot实验重复3次,使用Image-Pro 10软件计算灰度值。
平板克隆形成实验取生长状态良好的对数期细胞,消化后计数,以每孔250个细胞数接种于6孔板中。细胞培养箱中持续培养,3~4天更换一次抗生素,去除培养基,1×PBS洗涤3次,固定液固定细胞15 min,去除固定液,1×PBS清洗3次,用0.05%结晶紫溶液染色15 min,1×PBS洗涤后风干,拍照记录,使用Image J软件计算形成的细胞克隆数目。
统计学方法所有数据采用SPSS 11.0软件进行统计处理。对照组与实验组间采用t检验,差异显著性检验水平设为双尾,P< 0.05为差异有统计学意义。
结 果
ASCT2在胃癌细胞系中的表达在人类胃癌细胞系和胃黏膜上皮细胞系GES1中检测ASCT2的mRNA和蛋白质水平,结果显示相比于GES1细胞系,ASCT2在所有胃癌细胞系中均有高转录水平以及蛋白质表达水平(图1)。
ASCT2在胃癌细胞系中的RNA干扰与过表达使用ASCT2 shRNA慢病毒及过表达载体转染胃癌细胞系AGS、MGC803和SGC7901。结果表明,相对于shRNA-NC转染的细胞,ASCT2 shRNA质粒显著抑制ASCT2在AGS、MGC803和SGC7901中的蛋白质水平;相对于pENTER-NC转染的AGS、MGC803和SGC7901,pENTER-ASCT2质粒转染后ASCT2蛋白质水平显著上升。结果表明ASCT2 RNA干扰与过表达技术有效(图2),图中数字为ASCT2蛋白质表达的相对灰度值。
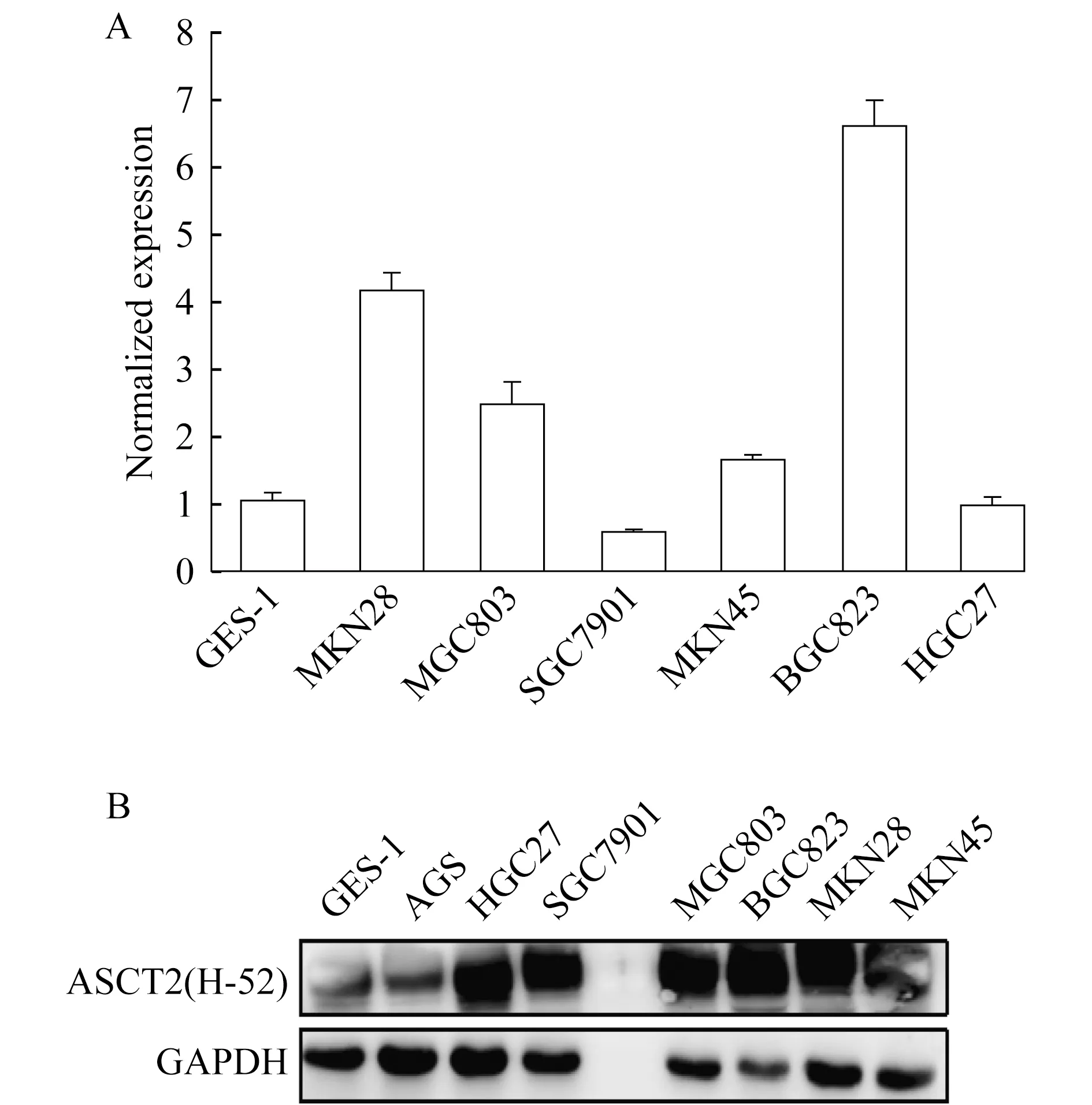
RT-PCR and Western blot were used to detect ASCT2 mRNA(A)and protein(B)expression.
图1 在胃癌细胞系和胃上皮细胞系(GES1)中ASCT2的mRNA(A)和蛋白质(B)表达情况
Fig 1 ASCT2 mRNA(A)and protein(B)expression in gastric cancer cell lines and gastric mucosal epithelial cell line(GES1)
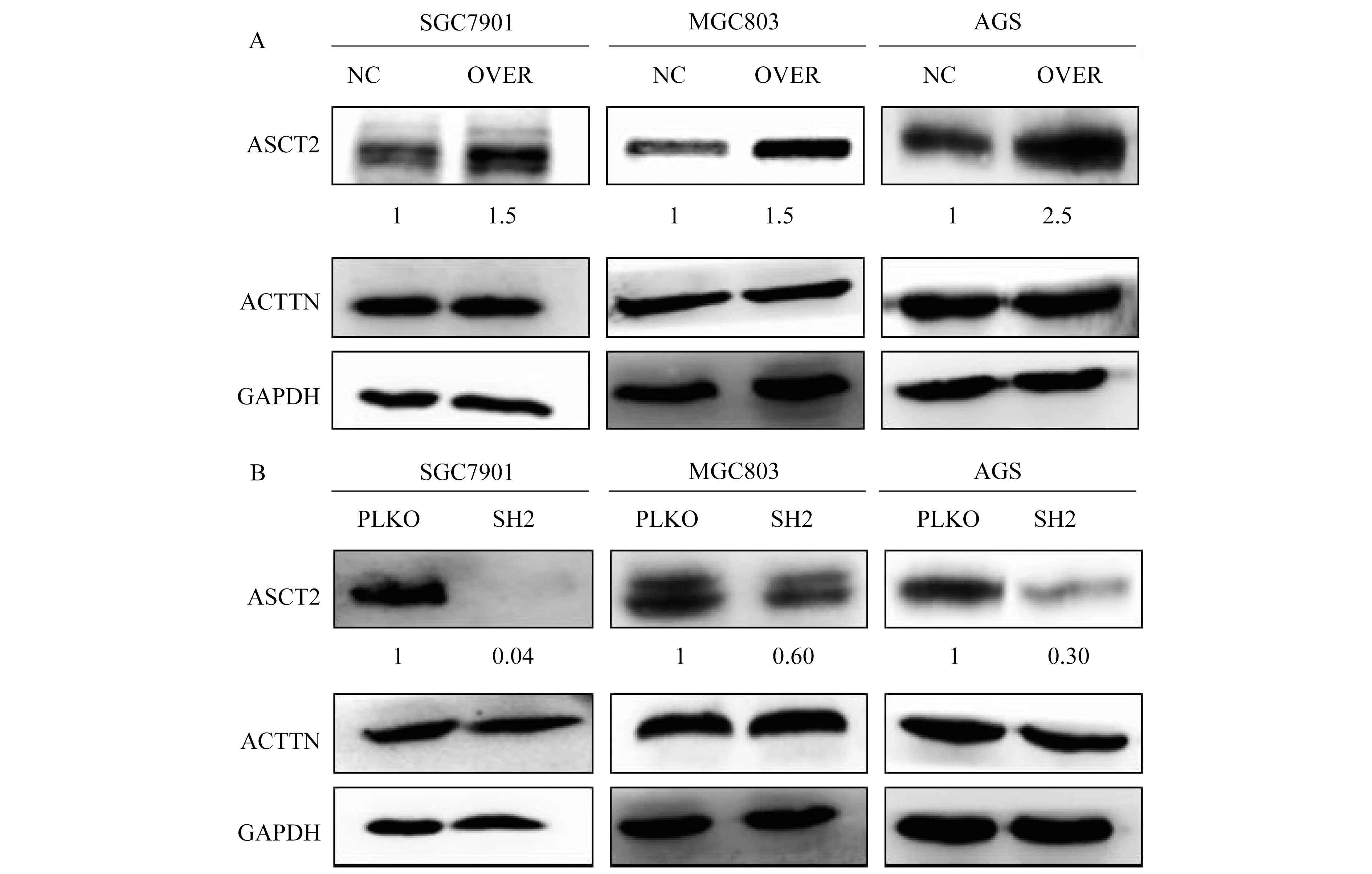
Western blot was used to verify the over-expression(A)and silencing(B)ofASCT2 in gastric cancer cells.
图2 在胃癌细胞系中过表达及稳定沉默ASCT2
Fig 2 Over-expression and stable silencing ofASCT2 in gastric cancer cell lines
在AGS和SGC7901中ASCT2对Ki67表达的影响Ki67是细胞增殖所必需的核蛋白,与核糖体RNA的转录相关,灭活Ki67能导致核糖体RNA合成受到抑制,在G0期中不存在,在细胞周期的所有活动阶段(G1,S,G2)都存在,特别是在细胞周期中最活跃的S期,细胞内的Ki67蛋白质大量增加[12]。相比于对照组(转染pENTER-NC),实验组(转染pENTER-ASCT2)Ki67+细胞比例明显增多(图3)。
ASCT2对MGC803和SGC7901增殖和克隆形成的影响由于ASCT2能显著影响胃癌细胞中Ki67蛋白质的表达水平,我们推测ASCT2也会影响胃癌细胞的增殖与克隆形成能力。用shRNA敲低ASCT2基因表达后,通过MTT实验连续5天检测转染的MGC803与SGC7901的增殖情况。结果发现转染ASCT2 shRNA MGC803和SGC7901的增殖比转染shRNA NC的细胞显著降低(图4A)。克隆形成结果表明,用ASCT2 shRNA转染的MGC803和SGC7901胃癌细胞比来自shRNA-NC组的细胞形成的克隆数目更少(图4C)。而相对于使用pENTER-NC质粒转染的MGC803与SGC7901细胞,使用pENTER-ASCT2质粒转染后的细胞无论增殖还是克隆形成都具有显著的优势(图4B和4D)。这些结果表明ASCT2能显著影响胃癌细胞MGC803和SGC7901的增殖与克隆形成能力。

Using Ki67 staining in SGC7901(A)and AGS(B)after the up-regulation of ASCT2(pENTER-ASCT2)was detected by cellular immunofluorescence assay.
图3 上调ASCT2增加Ki67+细胞的比例(×100,×400)
Fig 3 Up-regulation of ASCT2 raise Ki67+cell percentage(×100,×400)
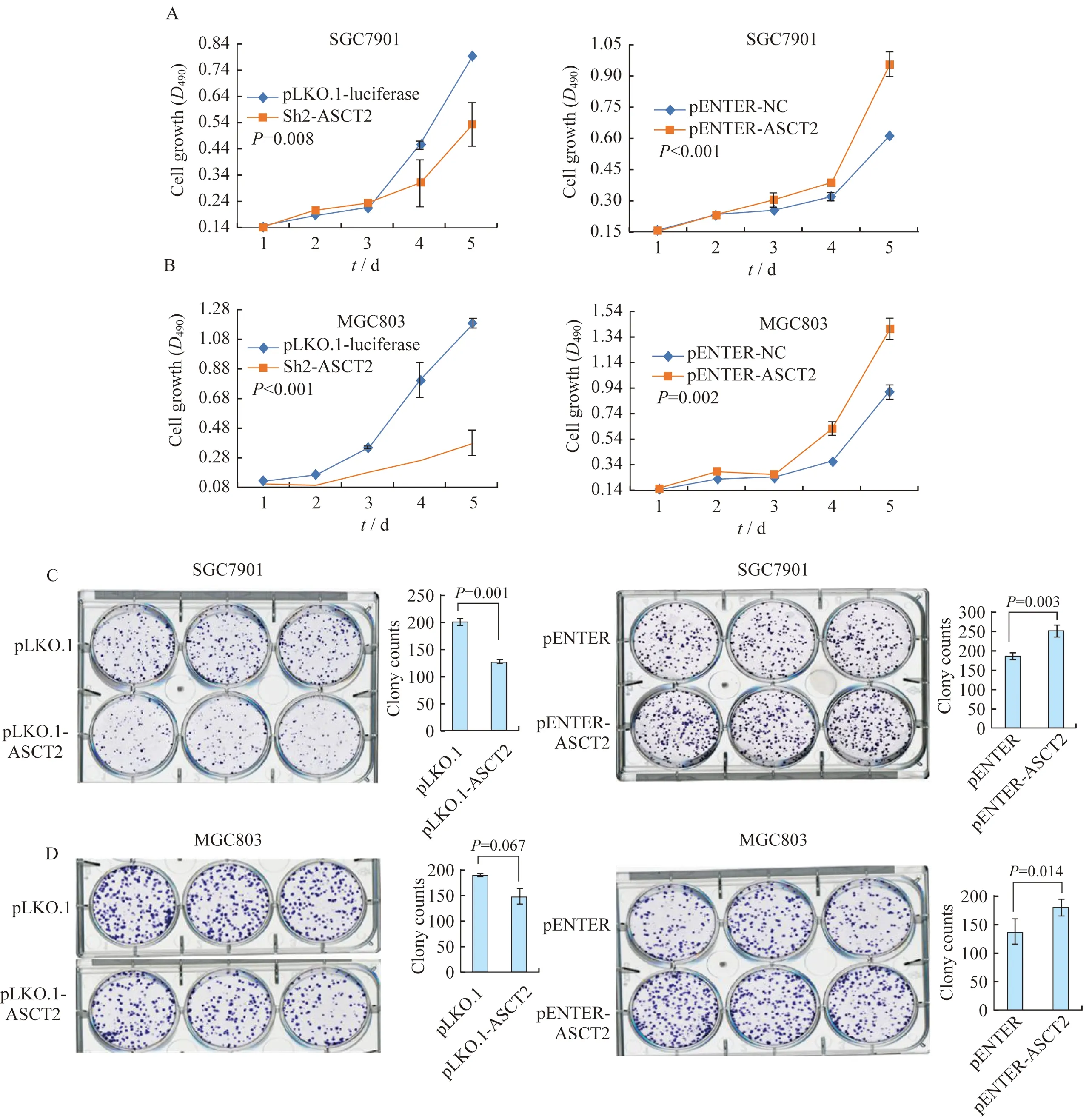
A:Cell growth of SGC7901 was inhibited after ASCT2 silencing(P=0.008);while it was promoted after ASCT2 over-expression(P<0.001);B:Cell growth of MGC803 was inhibited after ASCT2 silencing(P<0.001),while it was promoted after ASCT2 over-expression(P=0.002);C:Cell clonal formation of SGC7901 was inhibited after ASCT2 silencing(P=0.001),while it was promoted after ASCT2 over-expression(P=0.003);D:Cell clonal formation of MGC803 was inhibited after ASCT2 silencing(P=0.067),while it was promoted after ASCT2 over-expression(P=0.014).
图4 ASCT2对胃癌细胞MGC803和SGC7901增殖及克隆形成的影响
Fig 4 The effect of ASCT2 on cell proliferation and clonal formation of gastric cancer cell line MGC803 and SGC7901
ASCT2调控激活胃癌细胞的mTOR/p70S6K1通路在AGS、MGC803和SGC7901细胞中过表达ASCT2将激活细胞mTOR/p70S6K1信号通路,mTOR和PDK1的磷酸化显著增高,进而促进下游基因p70S6K1与P21的表达;稳定沉默ASCT2后,mTOR和PDK1的磷酸化显著降低,下游基因p70S6K1和P21的蛋白质表达受到抑制(图5)。
Western blot was used to detect the protein expression of mTOR signaling pathway and its downstream genes in AGS,SGC7901 and MGC803 after silencing(A)and over-expression(B)of ASCT2.
图5 ASCT2激活胃癌细胞的mTOR信号通路
Fig 5 ASCT2 activates the mTOR signaling pathway in gastric cancer cells
讨 论
幽门螺杆菌是胃癌最重要的环境风险因素,被世界卫生组织认定为Ⅰ类致癌物,据统计全球约90%的非贲门胃癌新病例归因于这种细菌[13]。研究表明胃癌的发生是因为多基因表达异常和多途径导致[14]。胃癌的早期诊断率不足10%,细胞表面膜蛋白在肿瘤的发生发展过程中举足轻重。ASCT2作为氨基酸转运受体定位于细胞膜上,对中性氨基酸(如L-丙氨酸、L-丝氨酸、L-苏氨酸、L-半胱氨酸以及L-谷氨酰胺)的Na+依赖性摄取呈现出高亲和力[15]。有研究表明ASCT2通过谷氨酰胺转运从而对mTOR信号通路进行调节。在肝癌中,ASCT2的沉默能减弱谷氨酰胺的摄入,抑制mTORC1,从而影响细胞的生长[16]。ASCT2在多种癌症中都高表达,并对癌细胞生长有重要影响,如肺癌[17]、前列腺癌和三阴性基底样乳腺癌等。
本文利用shRNA和pENTER控制ASCT2在胃癌细胞系中的表达,利用RT-PCR、Western blot、细胞免疫荧光、克隆形成以及MTT试验研究ASCT2对胃癌发生发展的影响及其潜在调控分子机制。我们发现ASCT2能调控胃癌细胞的生长,当过表达ASCT2时胃癌细胞系的生长增殖、克隆形成能力都大大增强,反之当干扰ASCT2的表达时则表现出相反的结果。
mTOR是mTORC1和mTORC2复合物的主要组成分子,也是mTOR信号通路的关键分子,该信号通路对营养物质吸收、生长因子刺激和细胞能量代谢等进行整合,促进细胞代谢及细胞生长[18],还控制细胞周期进展[19]。此外,p70S6K1(mTOR的通路的下游分子)的磷酸化能促进细胞生长和细胞周期相关蛋白质的生物合成[20]。我们发现ASCT2过表达或沉默之后能显著影响在AGS、MGC803和SGC7901细胞内mTOR/p70S6K1信号通路的磷酸化,Western blot检测mTOR信号通路发现,当过表达ASCT2时,在AGS、MGC803和SGC7901细胞内mTOR和PDK1的磷酸化水平大大增加,下游分子p70S6K1的磷酸化水平也相应增加,同时调控生长关键因子P21的表达上升。相比于对照组,使用shRNA稳定干扰ASCT2的细胞系中,ASCT2的表达显著下降,mTOR和PDK1的磷酸化水平减弱。
ASCT2过表达能激活mTOR信号通路,促进p70S6K1磷酸化,从而促进胃癌细胞的生长和增殖;反之,抑制ASCT2的表达能抑制mTOR信号通路,导致胃癌细胞的生长和增殖都受到抑制。结果表明,ASCT2能够通过调控mTOR信号通路对胃癌细胞的生长和增殖产生影响。
