小鼠肠腺瘤类器官培养及其辐射敏感性
2019-05-16李远闯富国祥潘梦雪饶欣欣徐小雅高建军华国强
李远闯 富国祥 潘梦雪 郭 强 饶欣欣 徐小雅 周 轶 高建军 华国强
(复旦大学放射医学研究所放射生物学部 上海 200032)
结直肠癌是常见的胃肠道恶性肿瘤之一,其中肠腺癌占绝大多数[1]。近年来,结直肠癌发病率及死亡率呈逐年升高趋势,成为威胁人类健康的重要因素[1-4]。肠腺瘤(adenoma)又称腺瘤性息肉,是肠道良性肿瘤,有恶变风险,被认为是腺癌的早期形式[5-6]。因此从腺瘤出发研究腺癌的发生、发展具有重要意义。
类器官(organoids)培养是基于体外3D培养技术发展起来的一种成体干细胞培养体系,能模拟在体器官或特异组织的分化发育[7]。肠道类器官培养是将分离得到的肠道隐窝或干细胞植入含有多种生长因子的基质胶(matrigel)中,在基质3D支撑下生成具有肠道上皮样结构的微型空心球体,并能正常出芽繁殖。该类器官包含所有种类的肠道功能上皮细胞,能最大程度模拟肠道组织,故称为“迷你肠”[8-9]。除正常肠道类器官外,也可培养结直肠腺瘤、腺癌等肠道肿瘤类器官[10-11]。
本研究利用氧化偶氮甲烷(azoxymethane,AOM)和葡聚糖硫酸钠(detrain sodium sulfate,DSS)诱导小鼠发生结直肠腺瘤。参考小肠类器官培养技术,建立小鼠腺瘤类器官培养方法,观察电离辐射的作用,以期为基于腺瘤类器官的基因操作及结直肠肿瘤研究提供参考。
材料和方法
实验动物、主要试剂和仪器6~8周龄雄性SPF级C57BL/6j小鼠,购自上海南方模式生物科技股份有限公司(合格证号:312024300000732)。
AOM、Ⅸ型胶原酶、N-乙酰半胱氨酸购自美国Sigma公司;透明质酸酶购自北京索莱宝科技有限公司;DSS购自美国MP Biomedical公司;Ⅱ型分散酶、B27、N2购自美国Invitrogen公司;EDTA购自美国Ambion公司;DMEM培养基、改良型DMEM/F12培养基、FBS、HEPES、GlutMax、双抗(青霉素/链霉素)购自美国Gibco公司;EGF、R-spondin1、Noggin购自北京义翘神州科技有限公司;基质胶购自美国Corning公司;兔抗Ki-67抗体、抗β-catenin抗体购自美国BD Biosciences公司。
超净台(苏州安泰空气技术有限公司);CO2细胞培养箱(美国Thermo公司)、低温离心机(美国Beckman公司);石蜡包埋机、切片机(德国Leica公司);倒置荧光显微镜(德国Zeiss公司)。
结直肠腺瘤诱导参考文献[12],小鼠一次性腹腔注射AOM(12.5 mg/kg)。5天后相继更换饮用水(含2%、1.5%和1%DSS,W/V),每个浓度饮用5天,中间间隔2周正常饮水。至第90天对小鼠进行开腹探查,收集肠腺瘤标本备用。实验操作符合复旦大学实验动物伦理要求。
腺瘤类器官培养取新鲜小鼠腺瘤标本,于10 cm培养皿中切碎,经PBS漂洗后富集于50 mL离心管中,于消化液(DMEM培养基,含1%FBS、500 U/mL Ⅸ型胶原酶、1.5 mg/mL Ⅱ型分散酶)中37 ℃振荡消化30~40 min。更换PBS,振摇20~30次,并于光学显微镜下监测隐窝分离情况。收集分散良好的腺瘤隐窝,用含双抗PBS漂洗3次,200×g离心5 min,用预冷的基质胶重选,接种于24孔培养板,加入腺瘤培养液(改良型DMEM/F12培养基,含100 ng/mL Noggin、50 ng/mL EGF、1×B27、1×N2、1×双抗、1×GlutaMax、10 mmol/L HEPES和500 μmol/L N-乙酰半胱氨酸),于5% CO2、37 ℃饱和湿度条件下进行体外培养。每3天换液1次,期间用倒置相差显微镜观察类器官生长情况,并择机传代或冻存。选择长势良好的培养孔,弃培养基,用预冷的PBS轻轻吹散基质胶,收集悬液,PBS漂洗2次,4 ℃、200×g离心5 min,计数类器官数量,用相应体积预冷的基质胶重悬并接种。
小肠类器官培养参考文献[10],取同周龄小鼠,处死后于胃下2 cm处截取约10 cm空肠肠段。PBS冲洗肠腔,纵向切开并剪成长约0.5 cm的小片段,收集备用。PBS(含双抗)漂洗,于含5 mmol/L EDTA的PBS中消化40 min(冰浴)。PBS(含双抗)漂洗,去除绒毛等碎片,更换PBS,振摇后获得小肠隐窝悬液。过滤后于4 ℃下69×g离心5 min,用预冷的基质胶重悬并接种,添加小肠类器官培养液(改良型DMEM/F12培养基,含500 ng/mL R-spondin1、100 ng/mL Noggin、50 ng/mLEGF、1×B27、1×N2、1×双抗、1×GlutaMax、10 mmol/L HEPES和500 μmol/L N-乙酰半胱氨酸),培养和观察步骤同前。
大肠类器官培养参考文献[10],取同一小鼠,截取结直肠约5 cm。PBS冲洗肠腔,纵向切开并剪成长约0.5 cm的小片段,收集备用。PBS(含双抗)漂洗,于消化液(DMEM培养基,含1%FBS和500 U/mL Ⅸ型胶原酶)中37 ℃水浴中消化30~40 min。PBS(含双抗)漂洗,去除绒毛等碎片,更换PBS,用力振摇20~30次,获得大肠隐窝悬液。过滤,4 ℃下69×g离心5 min,用预冷的基质胶重悬并接种,添加大肠类器官培养液(50%Wnt条件培养液+50%改良型DMEM/F12培养基,含500 ng/mL R-spondin1、100 ng/mL Noggin、50 ng/mL EGF、1×B27、1×N2、1×双抗、1×GlutaMax、10 mmol/L HEPES和500 μmol/L N-乙酰半胱氨酸)。
免疫组化染色取腺瘤或类器官用4%多聚甲醛4 ℃固定,常规脱水、浸蜡、包埋、切片,厚度为5 μm。取石蜡切片脱蜡水化后分别行HE、Ki67和β-catenin染色[13]。Ki67、β-catenin染色前在柠檬酸钠抗原修复液(江苏碧云天生物技术有限公司)中95 ℃修复20 min,待冷却至室温后以3% 过氧化氢(PBS稀释)作用10 min,去除内源性过氧化物酶。PBST洗片,室温下10%驴血清封闭1 h,加入兔抗Ki67抗体(1∶500)和β-catenin抗体(1∶200)作为以抗,4 ℃孵育过夜。隔日以PBST洗片,用鼠兔通用型免疫组化显色试剂盒(基因科技上海股份有限公司)进行二抗孵育和显色,封片后观察。
类器官存活实验将小鼠腺瘤类器官和大、小肠类器官分别传代接种到48孔细胞培养板,每孔200~300个,24 h后用 X线照射仪(RAD-320,PXI)照射,照射剂量分别为0、3、6、9、12 Gy,照射条件:SSD 50 cm,250 kV,12 mA,剂量率245 cGy/min。继续培养7天,显微镜下计数每孔存活类器官数量:坏死类器官絮团状轮廓残影基础上新生的成球或出芽状、折光性佳的类器官即判断为存活类器官(N7),与照前类器官数(N0)比较,计算类器官存活率(survival rate,SR)。计算公式:SR=(N7/ N0)× 100%。用GraphPad Prism 6.0 软件拟合剂量-反应曲线。
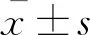
结 果
诱导小鼠肠腺瘤经AOM/DSS诱导的腺瘤均位于结肠靠近直肠处,诱导程序见图1A,肉眼可见结直肠上皮内出现异常增生息肉状结构(图1B)。20只小鼠中成瘤19只,成功率为95%,其中腺瘤个数超过5个的小鼠为14只(图1C)。

A:Experimental scheme;B:Macrograph images of mouse colon adenomas;C:Number of adenomas developed in mice.
图1 AOM/DSS诱导小鼠肠腺瘤
Fig 1 Intestinal adenomas in mice induced by AOM/DSS
取腺瘤组织,经HE染色,可见清晰的腺体状结构,腺体周围细胞核增大(图2)。经Ki67免疫染色显示,诱导产生的腺瘤具有较高的增殖活力。β-catenin 免疫组化染色结果显示,腺瘤细胞β-catenin入核明显,而腺体周围的正常组织细胞入核不明显(图2)。
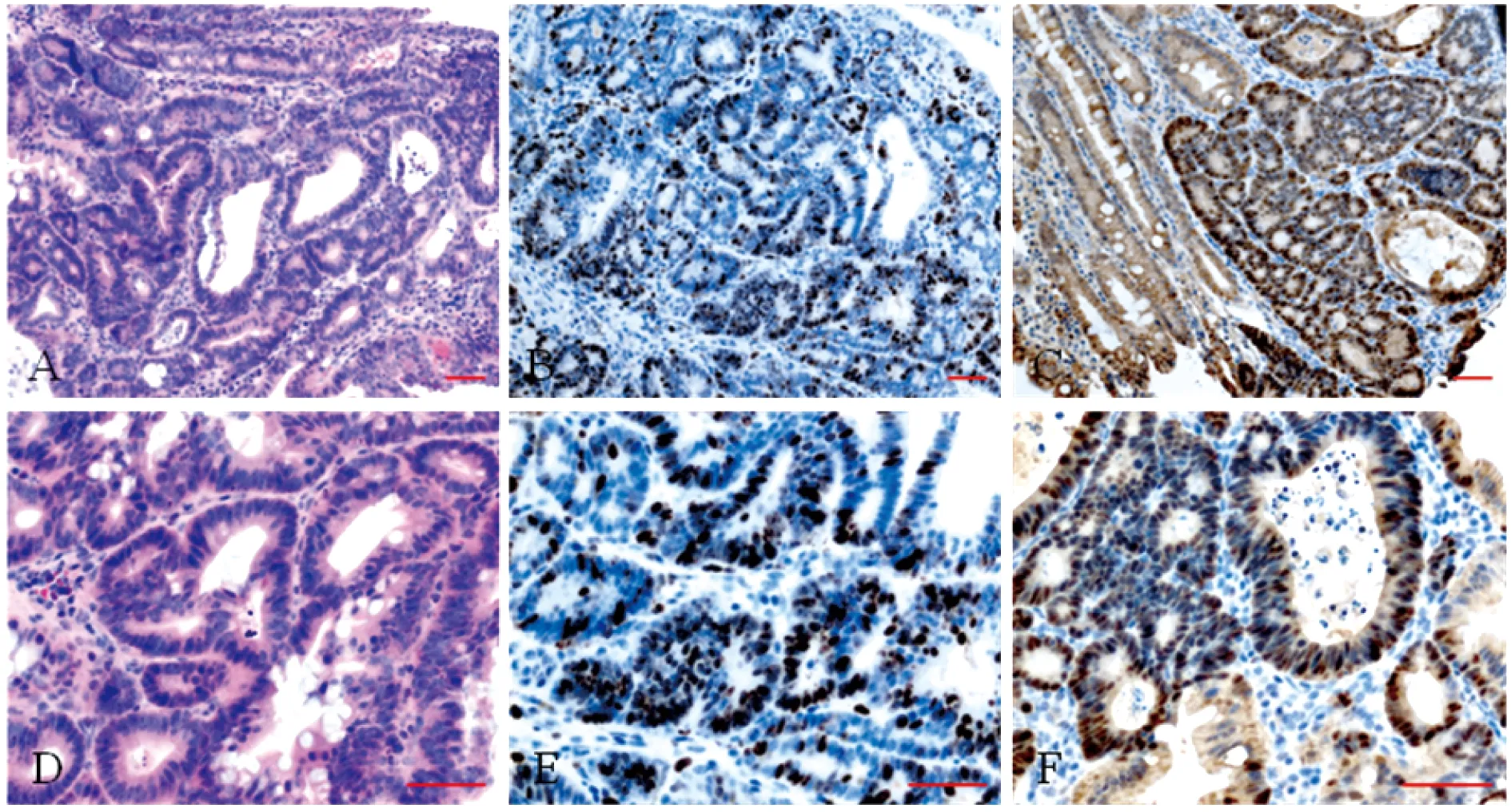
A:HE staining(×200);B:Ki67 staining(×200);C:β-catenin staining(×200);D-F:High power fields of A-C(×400).
图2 小鼠肠腺瘤HE染色和Ki67、β-catenin免疫组化染色结果
Fig 2 HE staining and immunohistochemical staining for Ki67 and β-catenin of intestinal adenoma in mice
培养腺瘤类器官采用小鼠小肠和大肠培养基对腺瘤组织消化获得的腺瘤细胞进行3D培养。在小鼠小肠培养基中去除R-spondin1后,小鼠腺瘤类器官球体结构维持良好,生长稳定(图3A)。取该类器官行Ki67和β-catenin免疫组化染色,结果显示腺瘤细胞Ki67阳性,且β-catenin入核特征明显(图3D、3E)。与腺瘤组织染色结果一致,表明该类器官仍保留了腺瘤的主要生物学特征。

A:Adenoma organoids(×50);B:Small intestinal organoids(×50)and its high power field;C-E:HE,Ki67 and β-catenin staining of adenoma organoids(×400).
图3 小鼠腺瘤类器官及其HE染色和Ki67、β-catenin免疫组化染色结果
Fig 3 The adenoma organoids of mice and their HE staining,immunohistochenical staining for Ki67 and β-catenin
小肠类器官培养液中不含Wnt3a,导致正常小肠上皮干细胞分化,培养中小肠类器官出现芽状结构(图3B);而腺瘤细胞可能存在Wnt通路激活型突变,使得腺瘤类器官仍保持球形增殖状态,这也与腺瘤细胞β-catenin的高入核率及Ki67的高阳性率结果相一致。
腺瘤类器官的辐射敏感性体外培养腺瘤类器官和大、小肠类器官,X线照射后受损类器官出现萎缩、塌陷,轮廓逐渐崩解,仅残留絮团状残影。照射后第7天,各类器官存活比例随辐射剂量增加而降低,其中小肠类器官降低最明显,9 Gy以上剂量组未发现存活的小肠类器官(图4A~4O)。6 Gy和9 Gy剂量组腺瘤类器官存活率分别为24.55%±1.84%和11.96%±1.42%,高于同剂量大肠类器官的16.52%±1.29%(t=6.203 9,P<0.01)和5.46%±1.22%(t=6.008 2,P<0.01)(图4P)。腺瘤类器官剂量存活曲线较大肠类器官右移,较小肠类器官明显右移(图4Q)。
讨 论
采用AOM/DSS方法可诱导小鼠产生结直肠腺瘤,与利用APC基因缺失小鼠自发形成腺瘤[11]比较,此法更为稳定且成瘤率高。腺瘤全部位于结直肠部位,且瘤体体积大,便于手术完整摘取。从HE染色结果来看,AOM/DSS诱导的腺瘤具有明显的腺体状结构,与腺癌的形态非常接近。AOM/DSS诱导产生的小鼠腺瘤主要涉及WNT通路APC等信号分子的突变[5-6],该突变也常发生于腺癌早期,可用于结直肠癌早期发病机制研究。
为有效分离腺瘤隐窝,Sato等[11]剪取载瘤的肠段,首先于PBS(含2 mmol/L EDTA)中使正常肠上皮细胞脱落,再用胶原酶消化瘤体,收集隐窝。而我们则通过手术方式直接剥离腺瘤标本,剪切小块后立即消化,成功获得腺瘤隐窝,简便易行。
类器官培养是基于体外3D培养技术发展起来的一种成体干细胞培养体系,可模拟在体器官或特异组织的分化发育[7]。肠道类器官培养是将分离的肠道隐窝或干细胞植入含有多种生长因子的基质胶中,在基质3D支撑下生成具有肠道上皮样结构的微型空心球体[8]。Wnt通路对肠道上皮干细胞的增殖至关重要[8-9,14]。小肠干细胞可分化出潘氏细胞,后者可为干细胞增殖提供必要的Wnt配体(如Wnt3a等)[9,14-16],故可在不添加Wnt3a的培养基中生长;而大肠上皮干细胞则在其中无法长期生存,也不能形成类器官。培养基中缺少Wnt3a,也可从小肠类器官的形态变化中得到侧证,即随着干细胞分化而出现的芽状结构。R-spondin是Wnt信号的激动剂,腺瘤细胞由于存在APC等基因突变,其Wnt通路常被激活,不需Wnt3a和 R-spondin也可引起细胞过度增殖,使得腺瘤类器官持续保持球形增殖状态。因此我们选择在小肠培养基中去除R-spondin1,可以避免大肠干细胞的混杂和干扰。小鼠腺瘤类器官球体结构维持良好,生长稳定。经Ki67和β-catenin免疫染色结果证实,腺瘤细胞的高Ki67阳性率和高β-catenin入核率与腺瘤组织染色结果相一致,表明该类器官仍保留了腺瘤组织的主要生物学特征。

A-E:Small intestinal organoids 7 days after 0,3,6,9 and 12 Gy of X rays exposure;F-J:Colon organoids after 0,3,6,9 and 12 Gy of irradiation;K-O:Adenoma organoids after 0,3,6,9 and 12 Gy of irradiation(bright field,×200);P:Survival rate of organoids,(1)P<0.01,n=3;Q:Survival curves of organoids post irradiation.
图4 腺瘤、大肠和小肠类器官的辐射生存反应
Fig 4 Survival of adenoma organoids,colon organoids and small intestinal organoids post-irradiation
既往研究表明大肠较小肠对射线更为耐受[13]。给予小鼠腹腔局部15 Gy X线处理后,小肠上皮形态崩塌,几乎无隐窝出现,而大肠在19 Gy X线作用下,仍可产生新生隐窝。在类器官培养的基础上,我们初步观察了腺瘤类器官对电离辐射的反应。6 Gy以上X线照射后,类器官出现萎缩、塌陷,轮廓逐渐崩解,仅残留絮团状残影。照射后第7天,各类器官存活比例随辐射剂量增加而降低,其中小肠类器官减少更明显,9 Gy及以上剂量组未发现存活的小肠类器官,而大肠类器官在9 Gy照射后约有5 %存活,腺瘤类器官则有近12 %的存活率,并且存活的腺瘤类器官具有更完整的形态。腺瘤类器官剂量存活曲线较大肠类器官右移,较小肠类器官明显右移,反映其具有更高的辐射耐受水平。本研究中类器官的培养条件不同,大肠类器官采用含Wnt3a的培养基,其对辐射敏感性的影响仍有待研究。
综上所述,使用AOM/DSS诱导小鼠产生结直肠腺瘤模型的方法稳定、高效,由此建立的腺瘤类器官保留了腺瘤组织的主要生物学特征,可模拟在体腺瘤对电离辐射等干预的反应,培养方法可靠实用。以此为基础的基因操作可为结直肠肿瘤发病机制的研究提供基础。
致谢童顺高老师指导X线照射实验。
