小鼠多亚型热休克蛋白/肽疫苗联合PD-L1免疫检查点抑制剂的抗肿瘤实验研究*
2019-05-11李浩江王振勇沈师高超张彬王泽昊眭翔崔雪梅袁玫刘舒云郭全义王桂琴
李浩江 王振勇 沈师 高超 张彬 王泽昊 眭翔 崔雪梅 袁玫 刘舒云 郭全义王桂琴
肉瘤是来源于间叶组织的恶性肿瘤,于长骨两端多见,尤以股骨下端、胫骨上端及肱骨上端最多见。目前肉瘤的治疗以外科手术切除为主,放化疗配合为辅。但是手术和放化疗具有严重不良反应,一旦肺部转移,治疗效果更差。抗肿瘤免疫研究发现免疫系统影响着肿瘤的发生和生长。肿瘤疫苗治疗肿瘤的免疫疗法是利用肿瘤细胞表达特异性蛋白而被机体免疫系统识别,消除肿瘤的治疗方法[1]。即通过刺激机体免疫系统产生抗肿瘤的免疫反应[2]。
热休克蛋白是高度保守的蛋白质,存在于所有生命体的细胞中。根据基因序列的同源性、蛋白分子的结构以及分子大小,热休克蛋白分属不同的家族[3]。热休克蛋白主要存在于细胞质、内质网(ER)和细胞外基质中[4-5]。肿瘤与正常组织相比,HSPs的表达升高,其中HSP70、HSP90和HSP27已被证明在肿瘤细胞中表达升高并且抑制肿瘤细胞死亡,促进肿瘤细胞生长,参与化疗耐药[6-7]。从细胞中释放的HSPs(其中HSP70和gp96)也表现出了激活特异性免疫反应的免疫原特性[8],可以诱导免疫系统识别肿瘤细胞。但是HSPs本身并不具有抗原性,而仅是作为抗原肽的载体,表明热休克蛋白携带的相关小肽是负责肿瘤排斥反应的重要环节[8],其诱导的特异性抗肿瘤免疫反应依赖于宿主的APC和T淋巴细胞的存在。
新近的实验证据表明,在肿瘤的发生中,B7H1(PD-L1)抑制了机体特异性免疫的抗肿瘤作用。作为B7家族的共刺激分子在对T细胞的调节中具有重要的影响[9]。在许多肿瘤组织中,B7H1表达随抗肿瘤细胞因子的产生而上调。肿瘤相关的B7H1被认为通过与免疫细胞表面PD-1受体相互作用而促进肿瘤细胞的免疫逃逸[10-12]。在mHSP/P免疫刺激作用的基础上,加入PD-L1免疫检查点抑制剂,对抗肿瘤的同时可抑制机体免疫的负调控作用,为临床术后开发新的辅助治疗策略提供依据。
1 材料与方法
1.1 材料
1.1.1 动物和细胞系 斯贝福公司(北京)购得6~8周龄18~22g的雌性C57小鼠[SCXK(京)2016-0002],饲养于中国人民解放军302医院。实验动物护理和使用获得伦理委员会批准。MCA207肉瘤细胞株来自美国斯坦福大学宗康拉教授赠予。L929细胞为中国人民解放军总医院骨科研究所提供。
1.1.2 抗体及器材 HSP70/HSP90/Gp94/PD-L1抗体购自美国Abcam公司。PD-L1抑制剂购自德国默克公司。DMEM 1×培养基,PBS 1×购自美国康宁公司,胎牛血清购自北京元亨圣马生物技术研究所。蛋白质层析柱(离子层析柱、高分辨率分子层析柱、亲和免疫层析柱)和WB电泳以及转膜槽购自于美国博士德公司。HSP70、HSP90、HSP96、HSP110 Elisa试剂盒购自于CUSABIO公司,IFN-γ和TNF-α Elisa试剂盒购自中国联科公司。使用的实验仪器共聚焦显微镜,WB曝光影相机,蛋白层析仪来自于中国人民解放军总医院转化研究中心。
1.2 方法
1.2.1 免疫组织化学、Elisa实验测定肿瘤中各亚型热休克蛋白的表达 MCA207细胞复苏后,以5×105µ/mL细胞浓度注入每只小鼠右后肢皮下,在肿瘤生长14天时处死,取出肿瘤组织经多聚甲醛液体固定12~24 h后切冰冻切片。PBS清洗切片后加3%双氧水去除过氧化物酶,2%羊血清和0.5%Triton封闭切片1~2 h,加一抗(抗HSP70、抗HSP90、抗Grp94)孵育过夜。次日滴加Maxvision试剂,室温下孵育10 min,后滴加DAB显色液反应3 min。最后自来水冲并洗苏木素复染,中性树胶封片后显微镜下观察。取肿瘤组织10~20 g,然后加40 mL细胞裂解液(RIPA、COCKTAIL、PMSF按100:2:1)裂解,4℃离心1 h后取上清。上清经滤网和滤器(0.2µm)过滤后Elisa试剂盒检测HSP70/HSP90/Grp94含量。测试遵循试剂盒说明书完成。
1.2.2 mHSP/P和Grp94/P的制备、鉴定及细胞毒性测定 体外培养肉瘤细胞株MCA20,并经过流式细胞学活性测定后注入动物体内,培养至组织后取出(具体操作同前)。液氮中研磨并经裂解液处理,在此基础上滤网过滤组织颗粒制备成蛋白悬液。Grp94/P制备过程:首先对制备的蛋白悬液通过阴离子层析柱(缓冲液A:Tris 20 mmol/L;B:Tris 20 mmol/L,NaCl 1 mol/L pH=8.5)分离蛋白,收集有明显蛋白峰出现的截断。用亲和层析柱(缓冲液A:20 mmol/L Tris,pH=7.5;B:20 mmol/L柠檬酸,pH=3.0)分离出Grp94/P。mHSP/P制备过程:同前,首先使蛋白悬液通过阴离子层析柱,再用分子层析柱(缓冲液Tris 20 mmol/L,pH=8.5)对经离子层析柱纯化的蛋白做二次纯化,分别收集不同截断的洗脱蛋白进行SDS-PAGE实验鉴定蛋白性质,含有HSP70、HSP90、Grp94截断的样品混合制备mHSP/P。对制备的mHSP/P和Grp94/P的生物毒性进行检测,流式细胞仪检测mHSP/P(10、20、30µg/mL)和Grp94P(100、200、300 ng/mL)细胞毒性,具体操作根据试剂盒提示完成。
1.2.3 mHSP/P和Grp94/P抗肿瘤的动物实验 评价mHSP/P和Grp94/P疫苗的抗肿瘤活性,小鼠随机分为3组(每组10只小鼠):生理盐水对照,Grp94/P,mHSP/P。接种肿瘤细胞后一天,1组注射生理盐水(0.3 mL),2组接种Grp94/P(300 ng/只),3组接种mHSP/P(30µg/只)。通过肿瘤生长曲线和小鼠生存曲线联合评价治疗作用。用卡尺每3天一次测量肿瘤横径(A)和长径(B),体积(V)由公式V=(A2B/2)计算。有肿瘤发生,在治疗后肿瘤未生长或肿瘤消失被认为治疗有效。Elisa试剂盒测定3组小鼠肿瘤组织中的IFN-γ和TNF-α的变化。
1.2.4 MCA207上PD-L1的表达 MCA207肿瘤细胞加入IFN-γ干预。对刺激前后免疫荧光染色测定PD-L1的改变,WB实验测定不同浓度IFN-γ(0、10、20、30µg/mL)干预下PD-L1表达的变化。
1.2.5 mHSP/P联合PD-L1抑制剂治疗中CD4+,CD8+T淋巴细胞的测定 小鼠随机同前分为3组:生理盐水对照组,mHSP/P组,mHSP/P+PD-L1免疫检查点抑制剂组。在接种肿瘤细胞后一天,1组注射生理盐水(0.3 mL),2组接种制备mHSP/P(30µg/只),3组接种制备的mHSP/P(30µg/只)与PD-L1抑制剂(60µg/只)。4周时处死小鼠,冰冻切片免疫荧光染色观察CD4+T、CD8+T淋巴细胞在肿瘤组织中的浸润。
1.3 统计学分析
所有实验均设置3次及以上的重复检测。统计分析涉及使用GraphPad Prism 5。采用方差分析比较实验组和对照组血液中的IFN-γ、TNF-α分泌水平,P<0.05为差异具有统计学意义。小鼠生存曲线由GraphPad Prism 5绘制并进行生存分析。
2 结果
2.1 MCA207肉瘤细胞中HSP70、HSP90、Grp94的表达
免疫组织化学染色显示肉瘤组织中表达3种热休克蛋白HSP70、HSP90、Grp94(图1)。Elisa定量测定3种蛋白,发现在肉瘤组织中Grp94的含量与前两者相比较高(表1,P<0.05)。
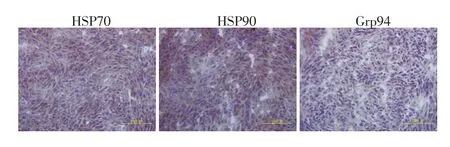
图1 肉瘤中热休克蛋白HSP70、HSP90、Grp94的免疫组织化学染色(IHC×200)
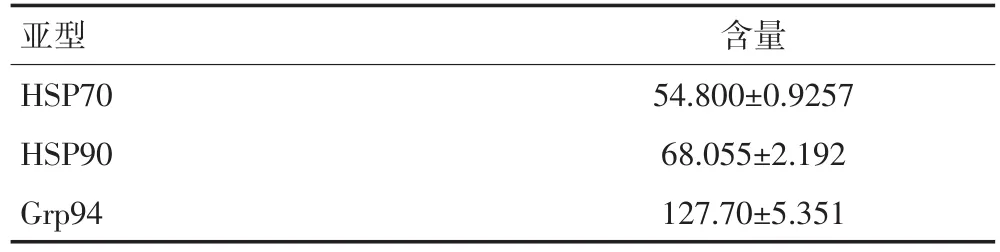
表1 Elisa实验测定肿瘤组织中HSP含量的 (ng/mL)
2.2 制备mHSP/P和Grp94/P
蛋白悬液经过离子层析后又分别经过分子层析柱和亲和层析,组织液通过阴离子层析柱后(图2A)蛋白主要出现在A17~A30,通过WB鉴定三种蛋白亚型主要出现在A19~A20截断。分子层析柱在离子层析柱的结果下对A19~A20截断蛋白纯化,分子层析柱中蛋白主要出现在A20~A30(图2B),通过WB鉴定HSP70主要出现在A25~A26截断,HSP90主要出现在A25~A27截断,Grp94主要出现在A23~A24截断,分别收集各截断组合成为mHSP/P。在离子层析的结果下通过亲和层析柱,在A4截断成功获得了Grp94/P(图2C),在检测mHSP/P和Grp94/P的细胞毒性中,实验证实mHSP/P未表现出细胞毒性(图3A)。流式细胞学实验证明mHSP/P和Grp94/P均未表现出细胞毒性(图3B,均P>0.05)。
2.3 mHSP/P比Grp94/P刺激机体产生更多抗肿瘤细胞因子
对荷瘤小鼠经mHSP/P和Grp96/P刺激14~16天时测定小鼠血清中IFN-γ和TNF-α含量。Elisa实验结果显示:TNF-α在对照组中为130.5±5.6,Grp94/P组中为186.29±5.6,mHSP/P组中为470.28±28.5,IFN-γ在对照组中为26.75±5.25,Grp94/P组中为44.32±4.9,mHSP/P组中为63.25±5.0(表2)。mHSP/P与Grp94/P组相比能产生更多的IFN-γ和TNF-α(图4,P<0.05)。
2.4 mHSP/P比Grp94/P更能延缓肿瘤的生长及延长小鼠的生存时间
动物实验中(图5A),mHSP/P组与Grp94/P组相比更有效抑制肿瘤的生长(图5B)。mHSP/P组与Grp94/P组相比,明显较对照组延长了小鼠的生存期(图5C),对照组和Grp94/P以及mHSP/P平均存活时间分别为(36±6)、(52.5±5.5)、(66±5.1)天。通过mHSP/P治疗有效地延缓了肿瘤生长。
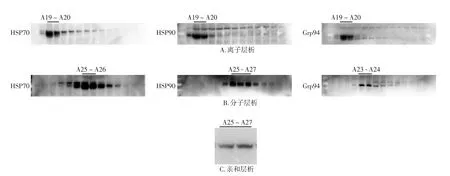
图2 mHSP/P和Grp94/P的制备和鉴定
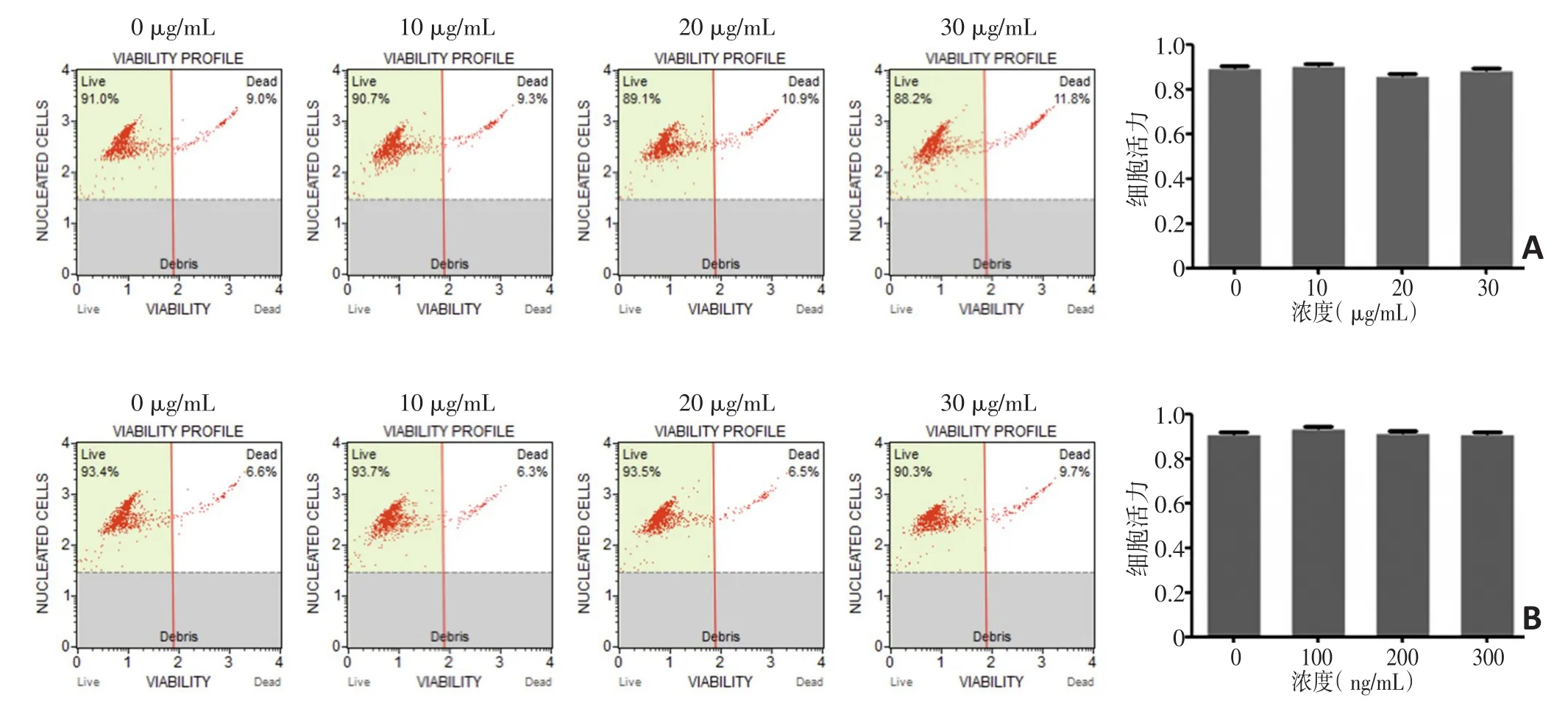
图3 流式细胞术测定mHSP/P肉瘤疫苗和Grp94/P肉瘤疫苗的细胞毒性

表2 三组不同的治疗方案中IFN-γ和TNF-α表达的差异 (pg/mL)
2.5 细胞因子IFN-γ刺激MCA207肉瘤细胞上PDL1的表达升高
本研究表明,MCA207在没有IFN-γ刺激时,细胞表面PD-L1处于低表达状态,在IFN-γ刺激后,免疫荧光染色发现PD-L1的表达升高(图6A)。WB实验也显示MCA207肉瘤细胞在不同浓度的IFN-γ刺激下PD-L1出现逐渐升高的趋势(图6B)

图4 mHSP/P肉瘤疫苗和纯Grp94/P肉瘤疫苗刺激抗肿瘤细胞因子IFN-γ和TNF-α的产生,*:P<0.05
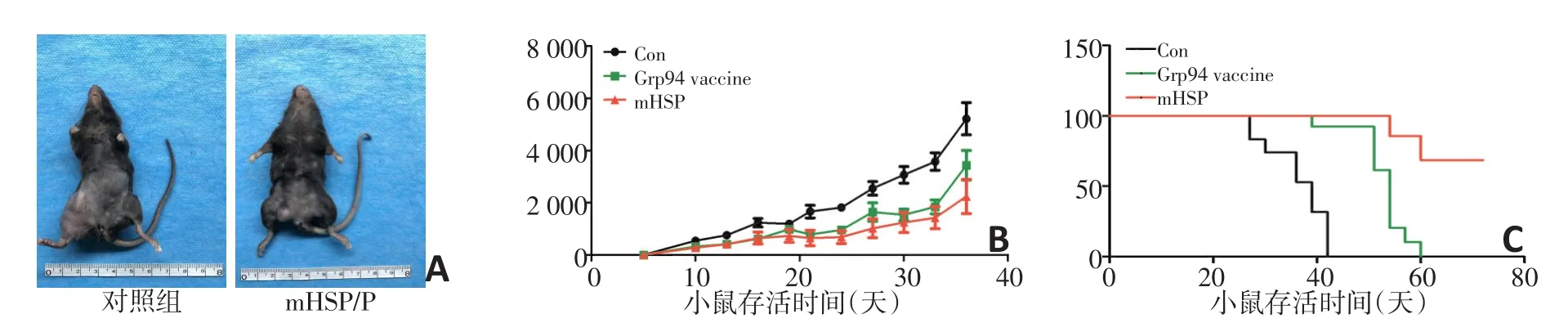
图5 mHSP/P肉瘤疫苗和纯化的Grp94/P肉瘤疫苗的抗肿瘤作用

图6 PD-L1的表达变化
2.6 mHSP/P联合PD-L1抑制剂促进淋巴细胞的杀伤作用
本研究结果显示CD8+T细胞在mHSP/P+PD-L1组中比mHSP/P组和对照组增加。同时CD4+T细胞也有增多的趋势。进一步对肿瘤的中心和边界细胞染色鉴定发现,实验组无论在边界还是在肿瘤内部,免疫细胞浸润数目均要高于对照组(图7)。
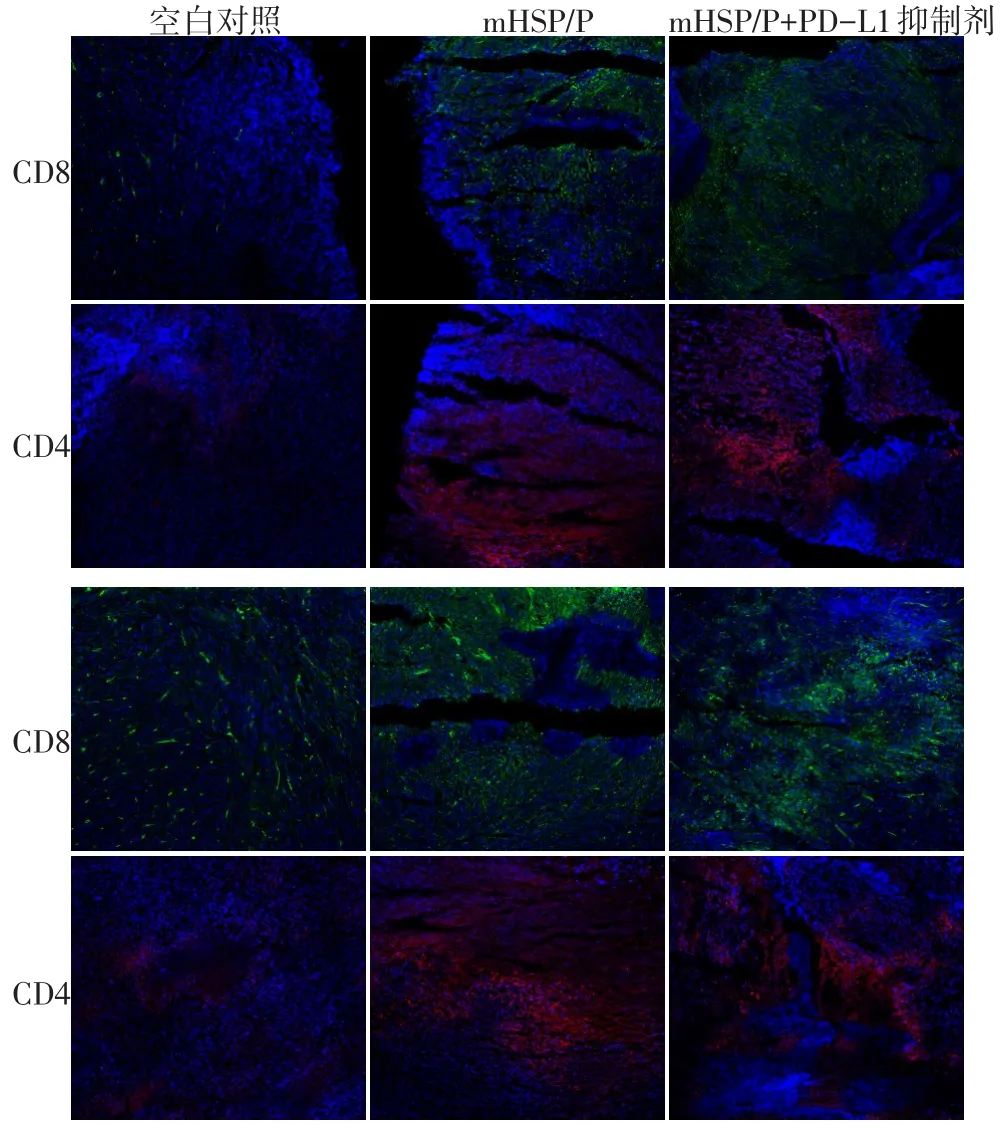
图7 免疫荧光染色标记肿瘤组织中CD8和CD4细胞的侵袭(CD8用绿色荧光标记,CD4用红色荧光标记)
3 讨论
以往实验发现刺激免疫反应抗肿瘤作用的热休克蛋白包括HSP110、HSP90、HSP70和HSP60。大分子的HSP(如HSP110、Grp94)较小分子结合抗原肽的数量更多,具有更有效的免疫刺激抗肿瘤作用。在实验中发现Grp94作为疫苗较其他常见亚型具有含量丰富、分子量较常见亚型大、可以结合抗原肽数量多的优势。Grp94是内质网腔中的肽结合受体,能够促进MHC-Ⅰ类分子与肽分子的结合。本研究成功制备了mHSP/P和Grp94/P,并且发现mHSP/P比Grp94/P拥有更强的抗肿瘤特性[13]。若以消除术后微小残留病为目标,这种方法作为辅助治疗可起到防止肿瘤术后复发的作用[14-16]。
既往研究中发现HSP疫苗刺激抗肿瘤细胞因子(IL-1β、IL-12、TNF-α和IL-6)的释放,使得研究人员对于热休克蛋白疫苗介导的细胞因子产生了兴趣[17]。本研究发现mHSP/P组和Grp94/P组中IFN-γ、TNF-α的产生均高于对照组,且mHSP/P组高于Grp94/P组。但是,IFN-γ的出现在对抗肿瘤的同时也促进了肿瘤细胞上PD-L1的表达增高。PD-L1的激活可促使免疫细胞失活以及肿瘤免疫逃逸的发生。
以往的实验发现,疫苗诱导的特异性抗肿瘤免疫依赖于宿主体内抗原提呈细胞(APC)和T淋巴细胞的存在。Grp94/P被证明通过APC激活或直接相互作用能够调节自然杀伤(NK)细胞活性,同时激活中性粒细胞和单核细胞。随着研究的逐渐深入,热休克蛋白的联合治疗可能为临床抗肿瘤提供最有希望的途径。本课题组以往实验表明,热休克蛋白疫苗联合的治疗方式要优于单独肿瘤疫苗治疗[18]。随着FDA批准了CTLA-4、IPILIMUMAB作为第一种单克隆抗体拮抗剂治疗转移性黑色素瘤[19]的使用,热休克蛋白联合免疫检查点抑制剂的抗肿瘤效果更加突出。本研究在肉瘤治疗中利用mHSP/P联合PDL1抑制剂,发现疫苗激活了免疫细胞。后续将对负调控细胞,如Treg等做进一步的抗肿瘤作用研究,这对探索PD-L1抑制剂在其中的联合作用至关重要。
临床试验中可以用自体肿瘤制备肿瘤疫苗,因材料的来源于自体肿瘤组织,精减了伦理审批步骤[20]。本课题组前期研究提出混合化的热休克蛋白由于包含不同亚型和携带更多的抗原肽而较纯化疫苗具有更强的免疫刺激抗肿瘤作用[18]。本研究存在的问题是纯化的Grp94/P疫苗在制备过程中会出现大量的损失而很难准确估计最后的得量。
热休克蛋白肿瘤疫苗作为肿瘤免疫疗法,旨在提高肿瘤术后患者的免疫反应。在肉瘤的治疗中,通过外科切除的方式,提取肿瘤组织中特有的mHSP/P,在此基础上联合PD-L1免疫检查点抑制剂,可以有效地抑制肿瘤的发展,在刺激免疫系统对抗肿瘤的同时降低了自身存在的负向调节作用。
