TAZ促进胃癌中血管生成及相关机制的研究*
2019-05-11白婧如赵秀兰孙冉张丹芳刘铁菊张艳辉董学易车娜梁晓辉程润芬刘爽
白婧如 赵秀兰 孙冉 张丹芳 刘铁菊 张艳辉 董学易 车娜 梁晓辉 程润芬刘爽
胃癌是全球第五大常见癌症,尽管随着诊断与治疗技术的不断提高,胃癌的发病率有所下降,但其总体预后仍较差[1]。肿瘤的新生血管为肿瘤细胞提供丰富的营养,在肿瘤的生长、侵袭、转移中发挥重要作用[2]。内皮依赖性血管是最为“经典”的血管生成模式,很多信号分子参与其形成的调控,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是较为明确的可以促进其形成的调控因子,而VEGF的分泌又受到多种因子的调控[3-4]。
β-catenin是典型Wnt通路的效应分子,广泛存在于内皮细胞、成纤维细胞等,与多种恶性肿瘤的发生发展密切相关[5]。β-catenin通常定位于细胞膜,参与细胞骨架的形成。在肿瘤细胞中,β-catenin表现为膜表达的缺失,其细胞核的异位表达激活Wnt信号通路,从而入核与不同靶基因结合,在肿瘤中发挥不同作用[6]。多项研究表明,β-catenin在多种肿瘤中可以促进VEGF的分泌,进而促进肿瘤血管生成[7-9]。
TAZ,又称为WWTR1(含有WW结构域的转录调节因子1),作为Hippo信号通路的关键下游效应分子,最初通过其与14-3-3蛋白质相互作用而被发现[10]。近期研究表明,TAZ作为一种转录共激活剂,在多种肿瘤中高度表达,发挥着不同的致癌作用[11-12]。此外,越来越多研究发现TAZ在血管生成中发挥重要作用[13-14]。
目前,TAZ在胃癌中的作用机制尚未明确,关于TAZ与β-catenin在血管生成中作用的研究仍较少。本研究旨在通过分析探讨TAZ在胃癌中的作用机制,为胃癌血管生成方面的研究提供新的见解。
1 材料与方法
1.1 材料
1.1.1 组织标本 收集天津医科大学总医院和天津医科大学肿瘤医院2001年1月至2013年1月经手术切除后送检的胃癌标本150例,所有患者术前均未接受放化疗。
1.1.2 细胞株 人胃癌细胞系MGC803购自中国医学科学院基础研究所,MKN28购自江苏凯基生物技术股份有限公司,HUVEC细胞购自美国ATCC公司,293T细胞购自上海复旦大学中山附属医院。
1.1.3 实验试剂 DMEM、RPMI-1640和Opti-MEM培养基均购自美国Neuronbc公司,胎牛血清(FBS)购自美国Gibco公司。慢病毒包装试剂盒和质粒均购自美国GeneCopoeia公司,TAZ过表达质粒(EXZ0976-Lv201),TAZ过表达对照质粒(EX-NEGLv201),TAZ降表达质粒(HSH017916-LvRH1GP),TAZ降表达对照质粒(CSHCTR001-1-LvRH1GP)均购自美国GeneCopoeia公司。Transwell小室购自美国FALCON公司,Matrigel胶购自美国Invitrogen公司。兔抗人TAZ抗体购自美国Abcam公司,兔抗人βcatenin抗体购自美国Abcam公司,鼠抗人CD34购自北京中山金桥生物技术有限公司,小鼠抗人GAPDH抗体购自美国Santa Cruz公司,二抗购自北京中山金桥生物技术有限公司。
1.2 方法
1.2.1 免疫组织化学法 石蜡包埋,切片,每片厚度5µm。切片经二甲苯脱蜡,无水乙醇脱苯后,用3%甲醇过氧化氢封闭内源性过氧化物酶30 min,之后95%乙醇-80%乙醇-无水逐级脱水,EDTA 9.0抗原修复液微波修复,血清封闭于室温20 min,滴加一抗TAZ(1:200)于4℃孵育过夜。次日用PBS液冲洗3次,滴加兔二抗孵育1 h后,DAB显色15 min,水洗,苏木复染细胞核,水洗,脱水透明,封片。
判定标准:采用Mattern积分法对免疫组织化学染色结果进行评分,每个标本在显微镜(×400)下,随机选取10个视野,分别记录标本的阳性细胞百分比及染色强度。阳性细胞百分比判定规则如下:阳性细胞<25%为0分,25%~50%为1分,51%~75%为2分,>75%为3分。将染色强度按以下标准分为0~3级:无阳性着色为0,浅黄色为1级,黄色为2级,棕黄色为3级。最后通过染色强度与染色范围的乘积确定最终得分,<3为阴性,≥3为阳性。
1.2.2 细胞培养 HUVEC、MGC803、293T及MKN28细胞培养:添加10%FBS、1%双抗(100 U/mL青霉素,100 U/mL链霉素)的DMEM或RPMI-1640培养基。细胞均培养于37℃、5%CO2培养箱中。
1.2.3 细胞转染及建立稳转细胞系 常规方法培养293T细胞后,用含灭活血清培养基继续培养2~3 d,根据慢病毒试剂说明书添加试剂与TAZ上下调质粒,之后待293T细胞中观察到荧光颗粒后,收集病毒液,并做标记。将胃癌细胞传代于6孔板中,用含灭活血清的培养基培养24 h,然后按照转染试剂说明书添加相应试剂及病毒液,12 h后更换普通完全培养基。转染48 h后用荧光倒置显微镜观察转染效率,用嘌呤霉素进行药筛。
1.2.4 共培养及条件培养基的制备 HUVEC与肿瘤细胞共培养实验需要采用条件培养基(conditioned medium CM)。用上述稳定转染的肿瘤细胞在无血清培养基中饥饿培养24 h,然后用5%FBS培养基替代。取其上清液,1 000 r/min离心10 min去除细胞碎片,用0.22µm滤器过滤后即为条件培养基,于4℃保存。
1.2.5 Western blot法检测 将细胞裂解后提取的蛋白等量上样于10%聚丙烯酰胺分离凝胶中电泳,之后湿转90 min于PVDF膜。用含5%脱脂奶粉的TBST室温封闭1 h后,添加抗体TAZ(1:500),β-catenin(1:5 000),GAPDH(1:2 000),4℃孵育过夜。次日待恢复室温后回收一抗,TBST洗膜3次,添加相应二抗孵育1~2 h,洗膜3次后加发光液,避光显影,拍照。应用Image J软件分析蛋白条带。
1.2.6 Transwell迁移实验 实验用无血清培养基制备细胞悬液,并调整细胞密度至1×105个/mL。小室上层内加入200µL细胞悬液,下层内加入500µL含有血清的完全培养基,置于培养箱中培养24 h后用冷甲醇固定20 min,擦除上层细胞后用0.4%结晶紫染色,镜检,计数并统计数据。
1.2.7 三维培养 实验前将培养基与Matrigel胶1:1混合,添加40µL平铺于96孔板,放置培养箱中过夜。次日,消化细胞并重悬至1×105个/mL,将细胞悬液以200µL/孔加入到96孔板内,之后放入培养箱中培养,待显微镜观察成管后拍照计数。
1.2.8 MTT实验 实验按照试剂盒说明书进行,将培养好的96孔板于酶联免疫检测仪上,检测每孔490 nm的吸光值(OD),记录统计。
1.2.9 酶联免疫吸附试验(ELISA) 将转染后的胃癌细胞及其相应的对照组细胞提前无血清饥饿培养后,分别收集上清液,按照ELISA试剂盒说明书按步骤操作,设计3个复孔,最后加入终止液反应30 min后,用酶标仪读取450 nm OD值。
1.3 统计学分析
上述实验均重复3次,采用SPSS 22.0软件进行统计学分析。计量资料分析均采用t检验法,应用Kaplan-Meier法进行生存分析,并用χ2检验统计TAZ与临床病理资料的关系。以P<0.05为差异具有统计学意义。
2 结果
2.1 TAZ在胃癌中的表达
用免疫组织化学法检测TAZ、β-catenin在150例胃癌组织中的表达水平,结果显示TAZ主要表达定位于肿瘤细胞胞核内,β-catenin表达于细胞膜和细胞核中(图1)。150例胃癌组织中TAZ阳性表达率为43%,βcatenin阳性表达率为54.7%。此外,在TAZ阳性组中βcatenin阳性表达率为67.2%,在TAZ的阴性组中βcatenin阳性表达率为32.8%,β-catenin在TAZ阳性组中表达明显高于TAZ阴性组,TAZ的表达与β-catenin具有相关性,差异具有统计学意义(表1)。
通过免疫组织化学法用CD34对内皮细胞进行标记,采用t检验比较高表达TAZ组与低表达TAZ组微血管密度(microvessel density,MVD)计数。结果显示,高表达TAZ组MVD数量明显多于低表达TAZ组,TAZ的表达与MVD具有相关性(图2,P<0.05)。
分析TAZ与150例胃癌患者临床病理资料的关系。结果显示,TAZ的表达与年龄、性别和肿瘤直径大小无关,而与肿瘤分级、TNM分期和远处转移及复发相关(表2)。此外,Kaplan-Meier生存分析结果表明,TAZ表达阳性患者较TAZ阴性患者的生存时间相对较短,差异具有统计学意义(P=0.028,图2)。

图1 免疫组织化学法检测人胃癌组织中TAZ与β-catenin表达情况(×200)

表1 TAZ与β-catenin的相关分析 例

表2 TAZ的表达与胃癌临床病理特征的关系 例
2.2 TAZ促进内皮细胞成管、增殖及迁移的能力
通过对共培养的内皮细胞进行三维培养,结果显示,内皮细胞与TAZ上调的MKN28细胞CM共培养后,成管能力较对照组明显增强,相反,内皮细胞与TAZ下调的MGC803细胞CM共培养后,成管能力较对照组明显减弱。
Transwell迁移实验结果显示,TAZ下调组的内皮细胞迁移数量少于对照组,而在TAZ上调组中,内皮细胞迁移数量明显较对照组增多,差异具有统计学意义(P<0.05,图3)。
MTT实验结果见图4,TAZ上调组较TAZ下调组更有利于内皮细胞的增殖,TAZ上调后,内皮细胞的增殖能力明显增强,而下调肿瘤细胞中TAZ的表达,内皮细胞的增殖能力减弱。

图2 胃癌中TAZ与MVD的关系及生存分析图

图3 TAZ对内皮细胞管道形成能力及迁移能力的影响
2.3 TAZ表达升高增强胃癌细胞中β-catenin的表达
细胞免疫荧光结果显示,在MKN28细胞系中,上调TAZ的表达,β-catenin的表达也随之增强,而在MGC803细胞中,下调TAZ的表达,β-catenin的表达也降低。
Western blot结果与免疫荧光结果相一致,转染TAZ过表达质粒的MKN28细胞,与对照组相比,βcatenin的表达水平上升;转染TAZ降表达质粒的MGC803细胞,β-catenin的表达水平较对照组降低(图5)。
2.4 TAZ表达升高促进VEGF蛋白的表达
通过ELISA法检测MKN28(过表达TAZ或对照)和MGC803(下调TAZ或下调对照)中VEGF蛋白的表达情况。结果显示,MKN28细胞中TAZ的过表达与对照组相比,VEGF表达增加,MGC803中TAZ下调明显抑制了VEGF的表达(图6)。
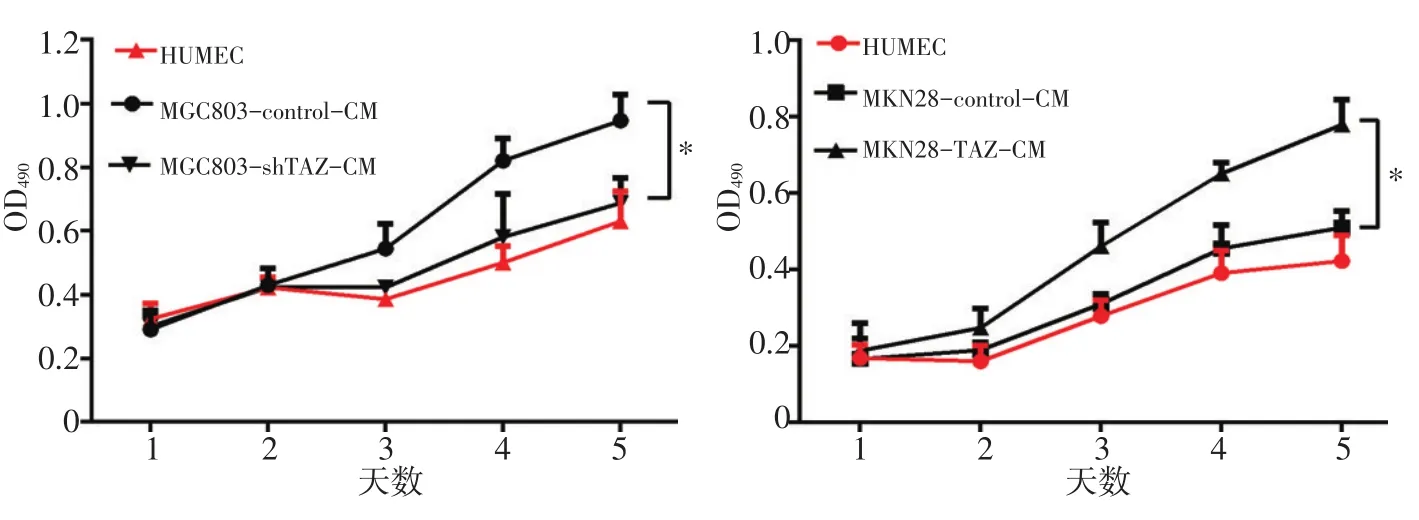
图4 TAZ对内皮细胞增殖能力的影响;

图5 免疫荧光与Western blot检测TAZ与β-catenin的表达变化
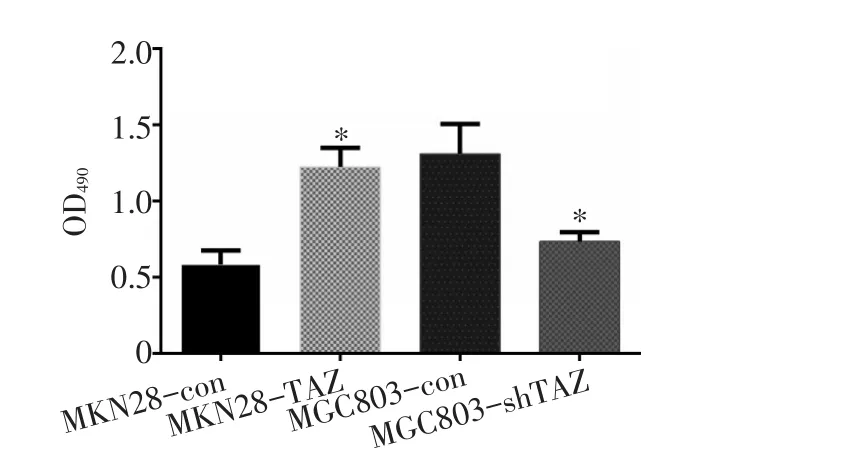
图6 ELISA法对各组肿瘤细胞培养基中VEGF因子检测情况;*:P<0.05
3 讨论
近年来,TAZ被发现在多种肿瘤中表达水平升高,如乳腺癌、肺癌、大肠癌和胶质瘤等,通过多条信号通路途径在不同的肿瘤中发挥着致癌作用。在Hippo通路激活后,TAZ被LATS1/2磷酸化,由此在细胞质中保持静止状态。相反,Hippo通路未激活或由多个内在和细胞外信号抑制其作用时,导致TAZ的去磷酸化和核定位[10,12]。有研究表明,TAZ在乳腺癌中高表达,上调TAZ促进乳腺癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)、侵袭迁移及增殖等[15]。TAZ通过子宫内膜癌细胞中GAB2的中间体,从而进一步调节PI3K/AKT途径[16]。此外,高表达TAZ被发现存在于非小细胞肺癌中,且与其分化程度差、预后差、生存期短有关[17]。本研究中发现TAZ在胃癌组织中高表达,且与肿瘤分级、转移等相关。
大量研究表明,TAZ在调控血管生成中发挥重要作用[13]。在小鼠的视网膜中敲除YAP/TAZ基因,会导致小鼠视网膜血管发育缺陷[18]。YAP/TAZ还可以通过调节内皮细胞增殖和重排,从而促进新生血管的稳定性[19]。在肿瘤中TAZ通过Hippo、Wnt和GPCR等信号通路对肿瘤的分化、转移、生长和干细胞特性的维持发挥重要作用[20]。本研究通过免疫组织化学法用CD34对内皮进行标记,进行MVD计数。结果显示,TAZ蛋白在胃癌中的表达与MVD相关,提示TAZ可能在胃癌血管生成中发挥作用。在共培养后进行一系列细胞功能实验发现,内皮细胞与TAZ高表达的胃癌细胞共培养后,其成管、增殖和迁移能力得到促进。免疫组织化学法检测发现,在人体胃癌标本中β-catenin表达与TAZ表达具有高度相关性。
多项研究表明,β-catenin为Wnt信号通路中的关键因子并参与基因的调控。TAZ在细胞质中磷酸化状态能抑制Wnt/β-catenin靶基因的表达,而核TAZ脱磷酸化可激活Wnt/β-catenin通路[21]。来自大肠杆菌的脂多糖通过Wnt/β-catenin诱导的TAZ升高刺激人牙周膜干细胞的成骨分化[22]。当Wnt信号通路激活时,β-catenin向胞核内转移,从而与T细胞因子(transcription factor,TCF)等结合发挥作用[5]。活化的β-catenin易位至细胞核并与TCF复合以促进VEGFA的转录,表明Wnt/βcatenin信号传导调节血管形成[8]。此外,有研究表明,在VEGF启动子区域发现有TCF结合元件,进一步表明β-catenin对VEGF的表达存在一定的调控作用[9]。VEGF主要通过与其受体特异性结合,促使内皮细胞内的信号转导,微血管新生,最终形成新的肿瘤血管网[23]。本研究通过Western blot法和免疫荧光检测结果表明,TAZ的上调可以促进胃癌细胞中β-catenin的表达,相反,降表达TAZ后,β-catenin表达随之降低。此外,通过ELISA实验发现,在胃癌细胞系中上调TAZ的表达促进VEGF蛋白的表达。
综合上述,TAZ在胃癌组织中高表达,且TAZ通过与β-catenin的相互作用,促进VEGF的表达,进而促进内皮细胞的增殖和迁移。本研究从人体组织标本与体外细胞实验两部分探讨了TAZ在胃癌血管生成中的作用,证实了TAZ与β-catenin的相关性。此外,本研究对TAZ在胃癌发生发展中的调控作用进行探究,为胃癌血管生成方面的研究提供新的思路与见解。但是肿瘤血管生成是一个综合而复杂的过程,关于TAZ在胃癌中如何调控β-catenin的表达以及相关通路的相互作用亟需进一步的研究。
