食源性蛋白酶抑制剂结构与功能
2019-05-09张允萍吴子健李丹阳
张允萍,吴子健,李丹阳
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
蛋白酶抑制剂(protease inhibitor,PI)是一类对蛋白酶的活性具有抑制作用的多肽或蛋白质的总称。其来源广泛,特别是源自食品或食材中的PI 不仅具有调节机体蛋白酶活性的作用,进而调节生物机体的代谢活动[1-15];同时也具有抗肿瘤、调节机体免疫力等诸多有益于人类健康的功能。研究与阐述这些食源性蛋白酶抑制剂(foodborne protease inhibitor,FPI)的结构与功能特点对于进一步开发与利用这些FPI 具有十分重要的意义。
1 食源性蛋白酶抑制剂的来源及其分类
天然食源性PI 分布十分广泛,多累积并存在于食源性植物的块茎、种子、叶子以及果实等组织中[16]。目前豆科(Fabaceae)、禾本科(Poaceae)和茄科(Solanaceae)等是PI 主要来源,例如豆科类植物中的大豆、鹰嘴豆、木豆、豌豆以及花生等;禾本科植物中的大麦、小麦、小米、玉米、荞麦、水稻以及高粱等;茄科类植物中的番茄、马铃薯和烟草等;葫芦科中的南瓜;以及凤梨科中的菠萝。其中豆科类植物种子中的PI 占其总蛋白含量的6%;禾本科类的谷物蛋白中PI 约占10%;随着探寻PI 范围的扩大,研究者还从锦葵科(Malvaceae)、芸香科(Rutaceae)、辣木科(Moringaceae)、桑科(Moraceae)、天南星科(Araceae)和番木瓜科(Caricacea)等类的植物体发现了相应的食源性的PI。
2 蛋白酶抑制剂的作用机理
PI 之所以能够有效地抑制蛋白酶(或称为PI 的靶酶)的酶解活性,主要原因如下:(1)PI 与靶酶相互作用时,两者之间就如酶和底物之间的相互作用形式一样,在共价键以及其他次级键(如:氢键、疏水相互作用等)的作用下,抑制剂上暴露在外的抑制活性中心与靶酶上的酶解活性中心相互接近并结合,最终导致共价或者非共价型“蛋白酶抑制剂-蛋白酶复合物”的形成;(2)PI 与靶酶之间反应的米氏常数很低,导致其与靶酶的亲和力比普通底物与靶酶之间的亲和力大很多,因而会使得PI 要优先于普通蛋白底物与靶酶迅速结合并形成复合物;(3)但是与通常的酶催化反应相比,PI 与靶酶结合后,抑制剂上与靶酶结合的活性中心肽链的裂解速度极慢甚至并不裂解[17],从而闭锁了靶酶的活性中心,使靶酶无法再与其他蛋白底物结合,导致其酶解活性的丧失。
3 蛋白酶抑制剂的分类与结构特点
PI 通常是按照其本身的结构、生物化学性质、或其作用靶酶的特异性等来进行分类的。根据所抑制靶酶的特异性,PI 可分为胰蛋白酶抑制剂、胰凝乳蛋白酶抑制剂、胃蛋白酶抑制剂等[18];根据结构功能和生物化学特性(包括PI 中活性位点的构成、抑制剂蛋白一级结构中二硫键的存在与否、抑制剂与靶酶间的抑制作用机制、抑制剂蛋白的三维结构、以及在热激条件或洗涤剂存在时抑制剂的稳定性),PI 也可以分为Bowman-Birk 型蛋白酶抑制剂(Bowman-Birk-type protease inhibitor,BBPI)、Kunitz 型蛋白酶抑制剂(Kunitztype protease inhibitor,KuPI)、Kazal 型蛋白酶抑制剂(Kazal-type protease inhibitor,KaPI)等[18]。
3.1 Bowman-Birk型蛋白酶抑制剂
BBPI 是一类能够抑制胰蛋白酶和胰凝乳蛋白酶酶活作用的PI,是由Bowman 于1946年从大豆中首次发现,Birk 等于1963年对该类蛋白酶抑制剂的性质与结构进行深入研究,因此两人的名字来命名Bowman-Birk 型蛋白酶抑制剂,该类蛋白酶抑制的分子量通常为8 kDa~17 kDa。该类PI 拥有两个同源重复的结构域,各自含有一个通过二硫键锁扣而形成的表面环区,如图1所示的源自大豆的BBPI,其含有两个P1 环区,即“9 残基-二硫键-环区”(nine-residue disulfide loop),两个环区上的β-折叠短链会直接与所抑制的蛋白酶以非共价形式相互作用,形成“蛋白酶-抑制剂复合物”[19]。BBPI 对蛋白酶的抑制作用符合Laskowski机制:当抑制剂以底物与酶相互作用的方式和酶结合时,两个表面环区上各自有一个刚性肽键能够有效抑制蛋白酶的活性,表现为在pH 值中性条件下,抑制剂与蛋白酶相互作用时,催化常数与米氏常数之间的比值(即 kcat/Km)很大,而两者(kcat和 Km)各自却很小。这类抑制剂不仅可抑制S1 家族蛋白酶,也可抑制部分S3 家族蛋白酶。
BBPI 多见于豆科或禾本科植物的种子中,常按其来源来命名。目前这些抑制剂蛋白三维结构研究非常透彻的有:向日葵环状抑制剂(sunflower cyclic inhibitor)、大豆抑制剂(soybean inhibitor)、大麦种子抑制剂(barley seed inhibitor)、小麦胚芽抑制剂(wheat germ inhibitor)、豌豆种子抑制剂(pea seed inhibitor)和花生抑制剂(peanut inhibitor)。这些BBPI 分子的结构十分相似,氨基酸残基序列上也具有高度同源性[20]。以源自大豆的BBPI 结构(如图1所示)为例来说明,大豆BBPI 分子由71个氨基酸残基构成,其中14个为半胱氨酸残基,且两两配对形成二硫键[16],使得BBPI 具有十分紧密交联共价结构,而正是这些二硫键以及肽链内的氢键使得大豆BBPI 分子形成了两个对称三环区域(tri-cyclic domain)(如图1所示),每个区域中都有一个由9个氨基酸残基构成的典型环区部位,在抑制蛋白酶活力时,这两个环区会与蛋白酶结合,而环口处的两个半胱氨酸残基形成的二硫键会锁扣住环区部分,该环区含两个抑制位点[21],即Lys16 处抑制胰蛋白酶,Leu44 处抑制胰凝乳蛋白酶[22]。1997年 Ware 等发现BBPI 对胰凝乳蛋白酶的抑制作用强于其对胰蛋白酶[23];发生抑制作用时,BBPI 与胰蛋白酶或胰凝乳蛋白酶按照分子个数比1∶1 比例结合,或同时与两种酶结合共同形成“酶-抑制剂复合物”[22]。

图1 大豆BBPI型蛋白酶抑制剂的-级结构序列Fig.1 Primary structure of soybean Bowman-Birk protease inhibitor
3.2 Kunitz型蛋白酶抑制剂
Kunitz 型蛋白酶抑制剂(Kunitz-type protease inhibitor,KuPI)是另一种来源广泛的 PI,豆科类植物的KuPI 含量最为丰富,特别是含羞草亚科(Mimosoideae)、蝶形花亚科(Papilionoideae)及云实亚科(Caesalpinioideae)[24]。KuPI 可特异性抑制蛋白酶,包括胰蛋白酶、胰凝乳蛋白酶等[25],通常分子量约为18 kDa~22 kDa[26],含 170个~200个氨基酸残基,由一条或两条多肽链组成;KuPI 中的半胱氨酸残基数量较少(不超过 4个),通常为 4个、2个或 1个半胱氨酸残基,甚至是没有半胱氨酸残基[24],所形成的链内二硫键虽然少或没有,但分子的构象以及活性区域都十分稳定[27],可能这些KuPI 分子不是靠二硫键而是依靠氢键等其他非共价作用力来稳定构象。KuPI 分子与胰蛋白酶结合位点往往含有特别适合与胰蛋白酶活性位点相互作用的碱性残基,如Lys 或Arg,而且大部分KuPI 分子可与其靶酶按分子个数比为1∶1 的比例形成“蛋白酶-KuPI 复合物”[28-29],也有一些KuPI 分子含有第二个独立的反应位点[30],如刺桐抑制剂(Eritrina variegate inhibitor)可与胰凝乳蛋白酶以分子个数比为1∶2 比例结合形成“酶-KuPI-酶复合物”复合物[31]。
通常在构成分子的多肽链以及二硫键的数量方面,KuPI 又有若干种情况,例如:1)蝶形花亚科(Papilionoideae)及云实亚科(Caesalpinioideae)的 KuPI 抑制剂多为单亚基蛋白,含一条多肽链,如蝶形花亚科正因加豆的胰蛋白酶抑制剂(Inga laurina trypsin inhibitor,INTI),分子量为 20 kDa,含一条肽链和一个二硫键,对胰蛋白酶有抑制作用而对胰凝乳蛋白酶并无抑制,同时其延续了抑制剂的高稳定性——即在高温短时的情况下仍能保持其活力,而在pH=2.0~10.0 区间拥有很高的耐受性[32];2)含羞草亚科(Mimosoideae)的KuPI 为二聚体蛋白,含两条多肽链[33],如:金合欢蛋白酶抑制剂(Acacia confuse trypsin inhibitor,ACTI)由两条肽链组成,A 链和B 链通过链内的二硫键相连,其一级结构如图2示;ACTI 含有175个氨基酸残基,其中A 链含有136个残基,B 链含有39个残基,拥有4个半胱氨酸残基这4个半胱氨酸残基形成2个保守的二硫键[34];3)菝葜紫荆半胱氨酸蛋白酶抑制剂(Bauhiniabauhinioides cysteineproteaseinhibitor,BBCPI)为18 kDa 的中性蛋白,含164个氨基酸残基,不含蛋氨酸即甲硫氨酸,也不含半胱氨酸,因此不能形成二硫键,但同样耐热耐碱,可能氢键对构象的稳定起到至关重要的作用[35]。
大豆中的Kunitz 型蛋白酶抑制剂最早由Kunitz于1947年发现并结晶得到[36-37],目前该蛋白的结构研究最为透彻,该分子由181个氨基酸残基构成(如图2),含两个二硫键(Cys39-Cys86和 Cys136-Cys145),其一级结构如图2所示[38-39]。整个分子的空间构象为一个完整的球状,直径为3 nm~5 nm[39-40],其规正的二级结构是由12 条反平行β-折叠链(相互之间由无规则环区分隔)构成,其中6 条折叠链构成一个三维对称的反平行β-桶),而另外6 条折叠链以三维对称方式构成反平行β-桶的上盖,β-桶的底部是蛋白中的环区部分构成,其中包括氨基端长的环区和羧基端,而且这个有环区构成的底部还含有活性位点(Arg63-Ile64处[41])。
3.3 Kazal型蛋白酶抑制剂
Kazal 型蛋白酶抑制剂(Kazal-type protease inhibitor,KaPI)是一种主要分布于动物组织或禽类卵清中的PI,其名称来源于该类PI 最早发现者Kazal(其于1948年首次发现并鉴定了KaPI)。KaPI 分子通常含有一个或多个特异性的Kazal 结构域,典型的Kazal 结构域的特点(如图3所示)包括:1)通常由 40个~60个氨基酸残基构成[42];2)其通用的氨基酸残基序列为CXa-C-Xb-P-V-C-G-Xc-Y-Xd-C-Xe-C-Xf-C,其中的下标 a、b、c、d、e 和 f 都是氨基酸残基整数倍数字;3)含有6个高度保守的半胱氨酸残基,并形成3个域内二硫键(1-5、2-4、3-6)[43];4)空间结构上,3 股相邻折叠链形成的β-片层与若干肽片段环区共同环绕着1 股α-螺旋;5)Kazal 结构域中有 3个结构域,分别为 A 结构域、B 结构域以及C 结构域(如图3所示),其中B结构域为反应位点环,其含有决定其抑制特异性的P1氨基酸残基以及易剪切肽键,凸起的B 环为KaPI 与相关蛋白酶的契合并形成“KaPI-蛋白酶”复合物提供了便利的接触位点[44]。通常脊椎动物的KaPI 为典型的KaPI,因为其分子所含的结构域是典型的Kazal 结构域,而无脊椎动物KaPI 是另一种非典型的KaPI 分子,其与典型的KaPI 的主要区别在于:1)抑制剂分子中所含的非典型Kazal 型结构域相对较多,例如:栉孔扇贝(Zhikong scallop Chlamys farreri)的Kazal 型蛋白酶抑制剂拥有12个结构域是目前发现含有结构域最多的Kazal 型蛋白酶抑制剂[45];2)各结构域的氨基酸残基个数相对较少;3)结构域内的半胱氨酸残基数目不同;4)一级序列上相邻的半胱氨酸残基间的氨基酸残基数目和种类有差异。当然,上述的差异,特别是后3 种的差异,并不能影响各Kazal 结构域的三维空间结构的相似性。
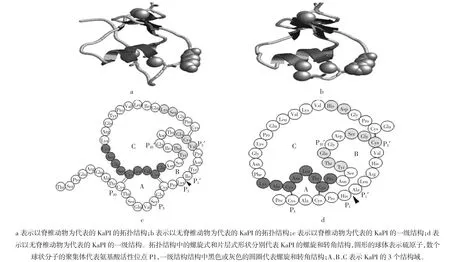
图3 脊椎动物与无脊椎动物Kazal型蛋白酶抑制剂的结构比较Fig.3 Structural comparison of vertebrate and invertebrate Kazal-type protease inhibitors
KaPI 的作用原理也是符合Laskowski 机制,当KaPI 与蛋白酶作用时,P1位点的氨基酸残基的侧链可完全契入蛋白酶活性位点(也称为S1 腔)内,同时分子中Kazal 结构域共有12个接触位点(分别为P6、P5、P4、P3、P2、P1、P1′、P2′、P3′、P14′、P15′以及 P18′)可与蛋白酶接触。抑制剂分子通过非共价键与蛋白酶形成“蛋白酶-KaPI”复合物,并且两者之间的缔合系数非常高,导致KaPI 对蛋白酶的抑制作用非常强烈和紧密,另一个方面,KaPI 分子对蛋白酶抑制特异性主要是由B 环上的P1位点(位于第二个半胱氨酸残基后的第二个氨基酸位置上[46])的氨基酸残基决定(如表1),而其它11个与蛋白酶接触氨基酸残基会有效影响结合效力以及抑制活力。

表1 P1位点氨基酸残基与其对应抑制的蛋白酶种类Table 1 Amino acid residues at P1 position and their corresponding inhibitory protease species
KaPI 通常有多个Kazal 结构域,且结构域之间有一些差异,一般每个独立结构域都有其特殊的活性位点,可独立作用并抑制相应的蛋白酶活性,因而一种KaPI 可同时抑制多种蛋白酶,甚至是不同类型的蛋白酶。另外,KaPI 分子中的各Kazal 结构域链接键相对比较灵活,以至于各结构域之间不会有空间位阻,例如火鸡(turkey)卵类黏蛋白中的3个结构域可分别抑制不同的蛋白酶:结构域1 可抑制灰质葡聚糖蛋白酶;结构域2 可抑制胰蛋白酶,结构域3 可抑制胰凝乳蛋白酶、弹性蛋白酶或者枯草芽孢杆菌蛋白酶[47]。但也有例外存在,一些结构域在空间结构上十分符合Kazal 型结构域的特质,但是它们对蛋白酶并无抑制活性,例如:源自角鲸(P.monodon)的Kazal 型蛋白酶抑制剂SPIPm2 上的Kazal 结构域2 中的P1位点为苏氨酸残基,不能抑制胰蛋白酶和枯草杆菌蛋白酶;源自罗氏沼虾和长红猎蝽的MRPINK 和Rhodinin 的P1位点为亮氨酸残基和甘氨酸残基,然而此域亦无活性。
4 食源性蛋白酶抑制剂的功能
FPI 广泛来源于食源性的动植物以及微生物机体或细胞中,它们不仅能在机体内与各自所抑制的靶酶相互制约并共同作用,来调节机体的生长发育,甚至是抵抗外来的病虫害等不利因素。其功能与生理作用具有多样性。
4.1 蛋白酶活性的调节功能
PI 与内源性靶酶共存于同一个有机体中[18],抑制剂对蛋白酶的活性具有重要的调节功能。例如,植物种子中所贮存的蛋白质是供给未来其萌发所需的氮源,同时种子中存在的抑制剂可有效地控制蛋白酶水解这些贮存蛋白质的进程,既确保了在萌发过程中氮源的持续供应,又预防了各种蛋白酶对种子或幼苗机体不利或无效的水解[48]。
4.2 贮藏蛋白的功能
PI 在动植物以及微生物机体中含量十分丰富,它们既作为水解蛋白的工具,同时其本身也是有用的贮藏蛋白。在机体(无论是禽卵还是植物种子)生长发育过程中,这些PI 也能够被降解,进而缓慢释放出氮源和碳源为机体的生理活动供能[49]。例如,大豆和绿豆种子的PI 含量占总蛋白质的6%~8%;大麦种子的PI含量占总蛋白质的10%;可可种子中的蛋白酶抑制含量可以达到25%~30%[48]。这些种子萌发过程中,都可以检测到PI 的含量在机体中显著降低。
4.3 抗发炎和抗肿瘤作用
植物来源的Bowman-Birk 和Kunitz 的PI 具有抗炎和抗肿瘤作用[50-52]。通常认为PI 可阻止细胞基质过氧化的发生,因而减少免疫细胞释放氧自由基的可能,进而避免了机体细胞磷脂膜遭受过氧化的破坏,不仅能有效降低多形核白细胞的增殖,而且也能防止了由多种蛋白酶所引发的机体炎症反应的产生[53]。例如:2005年Park 等研究表明:BBPI 可有效抑制小鼠肺部或胃肠道肿瘤,以及大鼠食管瘤、仓鼠口腔癌细胞及小鼠淋巴瘤的增长[54];中国黑大豆的Kunitz 型抑制剂可抑制乳腺癌细胞MCF-7 和肝癌细胞HepG2 的增殖[55];正因加豆的 Kunitz 抑制剂(Inga Vera trypsin inhibitor,IVTI)可降低 Caco-2 细胞的增殖[6];大豆中的BBPI 可以保护胃肠道,阻止癌症的恶化。2014年Arques 等的研究发现BBPI 还可有效抑制或预防由辐射/化学致癌物诱发的机体癌变[56]。另外,2004年Kobayashi等的研究[57]发现大豆中的PI 可稳定晚期卵巢癌病人的病情,其可能的原因是在于大豆的PI 能在基因层面以及蛋白表达水平上下调尿激酶型纤维蛋白溶酶原激活物(urokinase-type plasminogen activator,UPA)以及尿激酶型纤维蛋白溶酶原激活物受体(urokinasetype plasminogen activator receptor,UPAR)。
BBPI 分子内部的二硫键能够强有力地保障其结构的稳定性,从而保证了其稳定的蛋白酶抑制活性,所以BBPI 分子可耐受机体胃内的酸性环境,以及胃和小肠中酸性蛋白酶或胰酶等的作用,同时BBPI 还可免受机体肠道微生物菌群酶系的作用及其代谢反应过程。通常这些BBPI 分子可以历经机体消化道的作用,在进入机体大肠部位后仍能保留活性,发挥抗癌和抗发炎的功能。BBPI 作用可使得人体结肠癌细胞HT29 多数处于细胞周期的G0 期和G1 期,从而有效抑制了HT29 细胞的增殖[53]。只有在高温灭活的情况下,结构受到了严重的破坏,BBPI 才会失去其抗癌抗发炎的作用。
4.4 抗凝血、抗菌、抗病毒作用
某些PI 甚至对凝血因子有抑制作用,对肿瘤细胞黏附有阻碍作用,对炎症现象也有抑制作用,因而开发出了以PI 为原料的抗凝血剂。BBPI 还具有抗菌、抗病毒的作用。2001年Ye 等研究发现[58]蚕豆中分离了分子质量为7.5kDa 的Bowman-Birk 型抑制剂,可抑制HIV-1 反转录酶活性,对鼠的脾细胞具有促进增殖的作用同时还具有抗菌作用。分布在巴西自北至南潮湿地区的正因加豆属于豆科植物的含羞草(Mimosoideae)亚科,它的种子中提取的Kunitz 型抑制剂(Inga Vera Trypsin Inhibitor,IVTI)可以抑制真菌和白色念珠菌,也抑制致病细菌,如大肠杆菌[6]。此外,在A549 细胞中发现的PI 除了具有抗氧化和抗肿瘤的能力以外,还有预防由氧化应激引起的疾病的能力。由此,推断PI 可以与常规药物一起用作补充剂,以增加治疗心血管疾病、动脉粥样硬化和癌症等疾病的功效[59]。Kunitz 型抑制剂就是被重点开发的一种PI,从这些抑制剂分离纯化出来的低分子质量的化合物可以设计为涉及蛋白水解过程的检测或治疗的工具[26]。
4.5 预防肥胖作用
在对PI 进一步的深入研究中发现:通过体内大鼠实验表明,来自罗望子种子Kunitz 型蛋白酶抑制剂可以减少体重的增长,并增加血浆胆囊收缩素水平[60],因此有希望成为预防和治疗肥胖的一款植源性提取物。
5 结论与展望
食源性蛋白酶抑制剂来源广泛,种类繁多,功能多样,不仅是生物机体的调节剂,同时还可以发挥抗肿瘤、调节免疫力等多种生理作用。它们拥有能抑制多种酶的生物活性,且不同的FPI 活性和作用的酶也不同。研究不同来源的FPI 的性质和药理作用,开展临床研究,可以开发出疗效更好的新药。利用FPI 独特的结构特点与生物活性在医学上将有更加广泛的应用。
