藏药四味黄芪散对低压低氧诱导大鼠海马自噬损伤的保护作用※
2019-05-08米国霞李晓娜傅振幸杨全余李生花
米国霞,李晓娜,傅振幸,杨全余,李生花*
(1.青海大学医学院基础医学部,青海 西宁 810016,中国;2.加州大学圣地亚哥分校医学院,加利福尼亚 拉荷亚 92037,美国;3.青海大学高原医学研究中心,青海 西宁 810001,中国)
随着对自噬研究的深入,研究人员发现自噬在缺氧诱导的细胞损伤中起着双重作用。某种程度的自噬激活对变性蛋白和老化细胞器的降解有好处,并且提供合成蛋白所需的物质;但是过度激活的自噬又导致神经元自消化和凋亡,进一步加重缺氧细胞的损伤[1]。
微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体膜标志性蛋白,自噬形成时,胞质型 LC3Ⅰ会酶解掉一小段多肽,转变为膜型LC3-Ⅱ,因此,LC3-Ⅱ/Ⅰ比值的大小可反映自噬水平的高低[2]。细胞自噬受体蛋白p62作为泛素化底物和LC3转化之间的衔接蛋白,其蛋白表达水平的高低与自噬活性成反比,是检测自噬活性的一个辅助指标[3]。
缺氧可抑制低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)亚基降解、可调控蛋白激酶Cε(protein kinase c epsilon,PKCε)水平[4]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)被认为是海马中主要的长时程增强(Long-term potentiation,LTP)调节剂,在神经元的分化、生存和突触的形成中起重要作用[5],低氧情况下可受PKCε调控[4]。
激活或抑制自噬活动有望成为人类治疗疾病的新方法,包括神经性疾病。目前尚缺乏一个可调节自噬的药物[6]。藏药四味黄芪散具有脑神经保护作用,其作用机制不明。本研究将探讨藏药四味黄芪散是否通过对海马神经元自噬活动的调控发挥脑神经保护作用。
1 材料与方法
1.1 仪器与试剂
低压低氧氧舱购自中航风雷公司;电泳仪、电泳槽、ECL发光液购自Bio-Rad公司;RIPA、PMSF、4%多聚甲醛(815B0215)、2.5%电镜固定液(P1126)均购自索莱宝公司;转膜液、电泳液购自碧云天公司;蛋白酶抑制剂购自罗氏公司;BCA蛋白定量试剂盒、Marker购自Thermo公司;ELISA试剂盒(E-EL-R0513c)购自武汉伊莱瑞特生物公司;PVDF膜购自Mil-lipore公司;LC3(BST17924827)、P62(BST17464385)、PKCε(BST17775249)、BDNF(BST17304113)均购自博士德生物公司;β-actin(20536-1-AP)购自武汉三鹰公司;LC3(ab48394)、HRP(ab6721)、Cy2(ab6940)、含DAPI的封固剂(ab104139)均购自Abcam公司。
1.2 实验动物
将SPF级健康♂Sprague Dawley大鼠[SCXK(陕)2017-003,购自西安交通大学医学实验动物中心。72只,12周龄,体质量(180±15)g]随机分为常氧对照组(normoxic control group,NC,n=24)、低氧损伤组(hypoxic control group,HC,n=24)、低氧药物组(hypoxic drug group,HD,n=24)。NC、HC、HD按取材时间不同分为3、7、15、30 d组,每组各6只。
1.3 模拟低压低氧条件
模拟海拔5 000 m环境,舱内O2浓度为14.76%,温度(22±2)℃,湿度50%~60%。不间断运行30天。
1.4 药物水剂制备及给药方法

1.5 实验方法
1.5.1 用酶联免疫吸附法(ELISA)检测血清HIF-1α水平
将大鼠用10%的乌来糖(7mL·kg-1)行腹腔注射麻醉后,从腹主动脉取血,静置2 h离心(3000r/min,15min),取上清液分装并保存在-80 ℃冰箱。解冻血清至室温,平衡试剂盒温度至室温。将稀释成500.00、250.00、125.00、62.50、31.25、15.63、7.81、0.00 pg/mL的标准品和稀释2倍的待测血清加入96孔板中,做复孔,覆膜,孵育(37℃,90min);倒去孔内液体,加入100 μL生物素化抗体工作液,孵育(37℃,60min);洗涤液洗3次,加入100 μL酶结合物工作液,孵育(37℃,30min);洗涤液洗5次,加入90 μL底物溶液,孵育(37℃,15min);加入50 μL终止液体后用酶标仪在450 nm波长处测量OD值。
1.5.2 用透射电镜观察海马神经元中自噬体
1.5.3 用免疫荧光法检测自噬蛋白LC3水平
1.5.4 用尼氏染色观察海马CA3区的神经元形态、数量和排列情况
将4%多聚甲醛固定的海马组织切成25 μm薄片;贴于载玻片上,自然晾干;切片依次浸过氯仿和体积分数为0.95、0.80、0.75的乙醇,在质量分数为1%的焦油紫中染色(37℃,10min),用超纯水洗涤(3次),依次过体积分数为0.75、0.80、0.95的乙醇,在氯仿中分色数分钟,再用无水乙醇Ⅰ、Ⅱ依次脱水10 min,于二甲苯Ⅰ、Ⅱ中依次透明15 min后用中性树胶固封。用普通显微镜观察并采集图片。
1.5.5 用蛋白质免疫印迹试验(Western Blot)检测LC3、P62、PKCε和BDNF的蛋白表达水平
1.6 统计学方法

2 结果
2.1 各组血清HIF-1α水平比较
图1显示,与常氧对照组比较,3、7 d低氧损伤组HIF-1α水平显著升高;与低氧损伤组比较,3、7 d低氧药物组HIF-1α水平显著降低。15、30 d 的HIF-1α水平差异在三组间均无统计学意义。

NC:normoxic control group,HC:hypoxic control group,HD:hypoxic drug group;*:HC vs NC,P<0.05;#:HD vs HC,P<0.05

2.2 大鼠海马神经元自噬体鉴定
图2显示,透射电镜下自噬小体呈现双层膜包被的圆形或椭圆形结构,多位于细胞核、线粒体和粗面内质网附近。自噬小体其内包含了线粒体、粗面内质网、核糖体、高尔基体及不明物质等。自噬前体多呈新月状(图NC7d)或杯状(图HD15d),具有游离的双层膜结构或多层膜结构。内质网的一端与线粒体接触、延长、闭合包裹住线粒体形成自噬小体(图HC3d、HD3d、HC7d、HD7d 、HD30d)。自噬小体与溶酶体融合后形成自噬溶酶体,其间自噬体的内膜被溶酶体酶降解,其表现为单层膜(图NC3d、HC30d)。同时显示,HC7d、HD15d的自噬体表达相对对应组为多。
2.3 海马神经元自噬蛋白LC3免疫荧光标记
用Cy2与DAPI对各组大鼠海马神经元进行免疫荧光双标,Cy2标记LC3蛋白,DAPI标记细胞核。图3显示,共聚焦显微镜下自噬体的数量以点状聚集的方式呈现。根据文献[7]表述,点状聚集的密集程度可以判断细胞自噬的情况,采用计算机软件zen采集点状聚集信号进行分析,以 “细胞群中平均每个细胞所含的点状聚集数目或者点状聚集的总面积”作为细胞免疫荧光的定量比较指标。图4显示了大鼠海马神经元LC3的平均荧光强度,低氧损伤组LC3的表达在3 d和7 d时高于常氧对照组和低氧药物组,在15 d时低于低氧药物组,在30 d时高于常氧对照组,与低氧药物组无差异。
2.4 海马神经元自噬相关蛋白表达
图5显示,p62表达(A):3、7 d低氧损伤组低于常氧对照组和低氧药物组;15 d低氧损伤组高于常氧对照组和低氧药物组;30 d三组间没有统计学意义。LC3Ⅱ/Ⅰ比值(B),3、7 d低氧损伤组高于常氧对照组和低氧药物组;15 d低氧损伤组低于常氧对照组和低氧药物组;30 d三组间没有统计学意义。

Transmission electron microscope,Scale bar=200 nm,NC:normoxic control group,HC:hypoxic control group,HD:hypoxic drug group,M:mitochondria,N:nuclei,ER:endoplasmic reticulum,Go:golgi,Red arrow:autophagosome


Transmission electron microscope,630×,NC:normoxic control group,HC:hypoxic control group,HD:hypoxic drug group,Green:LC3 protein expression,Blue:nucleus


*:HC vs NC,P<0.05;#:HD vs HC,P<0.05
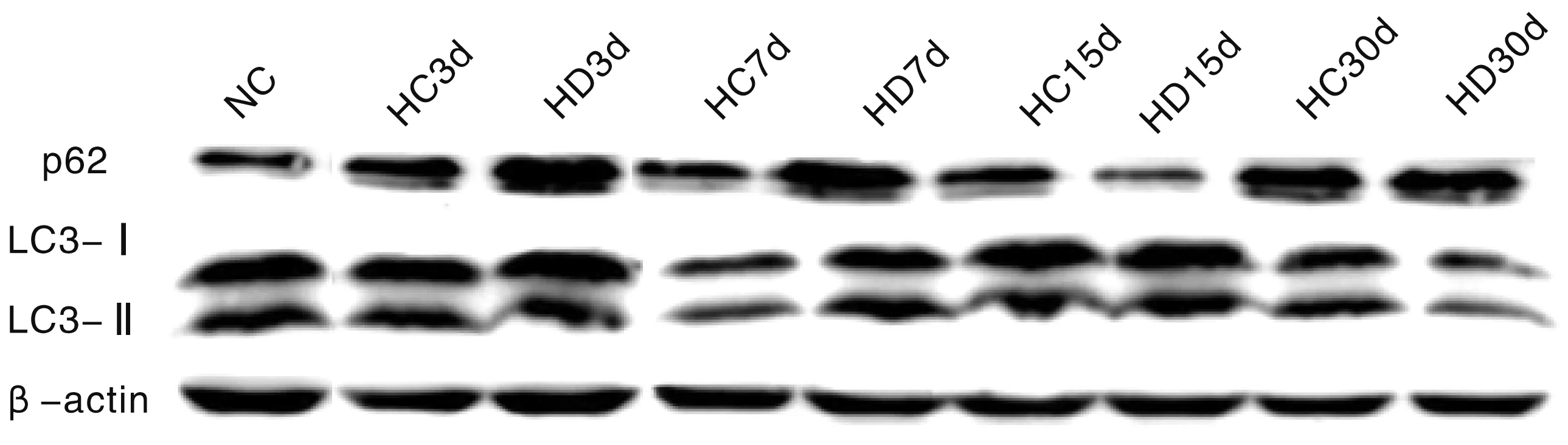

*:HC vs NC,P<0.05;#:HD vs HC,P<0.05
2.5 大鼠海马神经元CA3区尼氏染色鉴定
图6显示,与常氧对照组比较,低氧损伤组随着时间的延长,神经元损伤程度加重,3、7 d组海马神经元排列不齐,数目较少,结构发生肿胀;15、30 d组海马神经元大部分溶解,结构不清,尼氏小体数量几乎没有,部分呈现空泡。与低氧损伤组比较,低氧药物组的海马神经元形态较完整,尼氏小体数量多,排列整齐且密集。
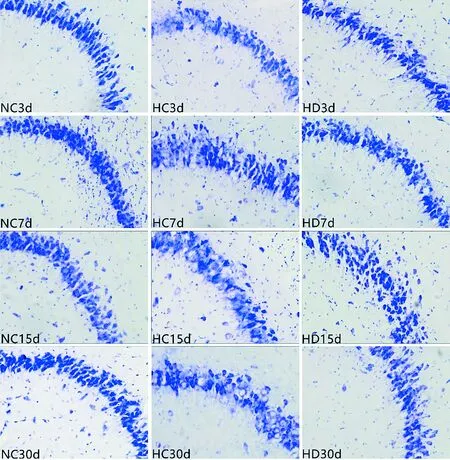
Nissl staining,200×,NC:normoxic control group,HC:hypoxic control group,HD:hypoxic drug group
2.6 海马神经元相关蛋白表达
图7C、D显示,3、7 d,低氧损伤组PKCε、BDNF蛋白表达水平均低于常氧对照组和低氧药物组;15、30 d,低氧损伤组PKCε蛋白表达水平高于常氧对照组和低氧药物组,而低氧损伤组BDNF蛋白表达水平高于常氧对照组,低氧药物组高于低氧损伤组。

*:HC vs NC,P<0.05;#:HD vs HC,P<0.05

2.7 相关性分析
图8显示,低氧损伤组大鼠海马神经元PKCε与BDNF的蛋白表达变化呈正相关(E,r=0.976,P<0.01,n=6);3、7 d低氧损伤组,低氧药物组PKCε和BDNF与LC3Ⅱ/Ⅰ蛋白表达变化呈负相关(F,r=-0.981,P<0.05;G,r=-0.899,P<0.05,n=6)。

E:Correlation analysis of BDNF and PKCε(r=0.976,P<0.01,n=6)in hypoxic control group;F:Correlation analysis of LC3Ⅱ/Ⅰ and PKCε(r=-0.981,P<0.05,n=6),G:Correlation analysis of LC3Ⅱ/Ⅰ and BDNF(r=-0.899,P<0.05,n=6)in hypoxic control and drug group in the third and seventh days
Figure8CorrelationanalysisamongBDNFandPKCε,LC3Ⅱ/ⅠandPKCε,LC3Ⅱ/ⅠandBDNFindifferentgroup
3 讨论
缺氧诱导的自噬作用与缺氧的程度密切相关,研究发现,糖氧剥夺(oxygen-glucose deprivation,OGD)2 h时,在体外培养的大鼠海马神经元中自噬活动的增强可起到一定的保护作用,而OGD 6 h时,自噬活动的增强反而加重神经元损伤[8]。有研究者观察到,在饥饿条件下自噬体约在10 min内出现,约1 h达高峰,半衰期约0.5 h,自噬体向自噬溶酶体转变需7~8 min[9]。这与本研究中的结果相似。我们通过western blot检测发现在低压低氧第3天和第7天时,低氧损伤组大鼠海马神经元的自噬水平高于常氧对照组和低氧药物组,这个结果与免疫荧光实验的结果一致。这表明急性低压低氧可促进海马神经元自噬体的形成和自噬蛋白的过表达,而藏药四味黄芪散能够降低低压低氧诱导的自噬水平。
PKCε、BDNF参与对神经细胞的保护作用。本研究发现,在低压低氧第3天和第7天时,低氧损伤组中PKCε、BDNF表达较低,而药物组表达较高,尼氏染色结果也显示藏药四味黄芪散干预后的神经元细胞结构完整,尼氏小体较多,说明藏药四味黄芪散可促进 PKCε、BDNF高表达并对海马神经元具有保护作用。在第15天和第30天时,PKCε表达在低氧损伤组反而较低氧药物组表达高,这可能是低氧下的PKCε发挥了缺氧预处理的保护作用,而低氧药物组BDNF的表达高于低氧损伤组,而且通过尼氏染色观察,低氧损伤组神经元内的尼氏体消失,细胞核溶解,而低氧药物组的神经元结构完整,因此说明藏药四味黄芪散不仅对急性低压低氧期所致脑神经细胞损伤具有保护作用,而且对慢性低压低氧期也具有保护作用。在低氧损伤组中,PKCε、BDNF变化趋势保持很高的关联性,其相关系数为r= 0.976(P<0.01)。有研究表明在脑缺血预处理(ischemic-preconditioning,IPC)中PKCε发挥作用,可调节BDNF水平[4],使机体通过短期缺氧应激反应对随后长时间的缺血损伤产生明显的保护作用[10]。在全脑缺血/缺氧期间,PKCε通过BDNF/TrkB路径增加记忆蛋白活性调节细胞骨架蛋白的表达,降低细胞兴奋性毒性导致的损伤,达到了保护神经的作用[11]。这和我们的研究结果一致。
对PKCε与自噬作用的研究存在不同观点。早期Toton Ewa等人[12]发现抗癌药物沙波廷能够显著降低PKCε过表达细胞中的自噬的形成,表明PKCε具有促进Zapotin抑制自噬活动的作用。但另有观点[13]认为,用siRNA技术沉默PKCε的基因,可诱导自噬表达下降,促进抗凋亡蛋白Bcl 2的表达增加。Chen Ai 等人[14]也发现PKCε的下游信号BDNF可通过激活自噬水平发挥缺氧对神经元损伤的保护作用。而本研究相关性分析结果显示,在急性低压低氧期,PKCε、BDNF与LC3蛋白水平变化呈负相关,可能自噬蛋白与PKCε、BDNF蛋白具有相互调节的关系,但这还需要进一步研究。
综上所述,在急性低压低氧期,藏药四味黄芪散调节自噬水平对低压低氧所致海马神经元的损伤具有明显的保护作用,其机制可能是通过上调PKCε、BDNF蛋白水平,下调自噬水平而发挥了保护作用;而在慢性低压低氧期没有看到明显的自噬调节作用,可能是通过其他路径发挥保护作用,或许与慢性低氧期药物浓度水平下降有关。
(致谢:感谢青海大学高原医学研究中心、青海大学医学院基础医学研究中心在本课题研究中所提供的帮助和支持)
