泡型包虫病患者血清miRNA差异表达初步分析※
2019-05-08曹得萍张雪飞马俊英王永顺詹培珍
刘 佳,曹得萍,张雪飞,马俊英,马 霄,王永顺,雷 雯,王 威,詹培珍,张 震
(1.青海大学医学院,青海 西宁 810001;2.青海省地方病预防控制所,青海 西宁 811602;3.青海省包虫病研究重点实验室,西宁 810001)
包虫病目前的诊断方式主要为超声学检查,辅助诊断方式为血清学检测。但超声检查对于操作人员的专业技术要求较高,而血清学检测方法又存在灵敏度和特异性问题。因此,寻找高灵敏度的早期泡型包虫病诊断生物学标志物十分必要。本研究采用Illumina高通量测序技术对泡型包虫病患者和健康者血清miRNA进行检测,并对差异表达miRNA调控的靶基因进行初步预测和功能及通路富集性分析。
1 对象与方法
1.1 研究对象
收集青海大学附属医院泡型包虫病患者血清样本3例,其中,男性1例,女性 2例,平均年龄为40.33±2.05岁。采集血清前患者均未行任何治疗。5例健康对照血清样本来自青海大学附属医院体检健康者,其中男性2例,女性3例,平均年龄为40±3.56岁。本研究已获得青海大学附属医院伦理委员会批准,研究对象均签署知情同意书。
1.2 检测方法
1.2.1 血清标本处理
在泡型包虫病患者治疗前和健康者体检时用一次性真空采血管采集空腹外周静脉血 5 mL离心(2000r/min)8 min,提取血清。
1.2.2 血清miRNA的提取
使用Trizol(美国Thermo Fisher Scientific公司)提取8份血清总RNA。使用超微量紫外分光光度计(NanoDrop ND-2000,美国Thermo Scientific公司)对提取后的样品总RNA进行质量检测,RNA的纯度以OD260/OD280值在1.8~2.0之间为合格。将质检合格的样品送至杭州联川生物科技股份有限公司进行miRNA高通量测序。
1.2.3 高通量测序及数据处理
小RNA文库制备采用TruSeq Small RNA Sample Prep Kits(Illumina,San Diego,USA)试剂盒。文库制备工作完成后,对构建好的文库使用高通量测序仪(Illumina Hiseq2500)进行测序。测序数据使用ACGT101-miR(LC Sciences,Houston,Texas,USA)软件进行处理。
1.2.4 差异表达miRNA的筛选
对差异表达基因的筛选以|log2(Foldchange)|>1(即两倍差异倍数)且P-value≤0.05为阈值。数据分析应用ACGT101-miR(LC Sciences,Houston,Texas,USA)及SPSS18.0(IBM,USA)软件进行。
1.2.5 靶基因的预测及功能与通路富集性分析
使用TargetScan[1-3]、miRanda[4-6]两款软件对显著性差异的miRNA分别进行靶基因预测,最后取此两款软件的交集作为差异miRNA靶基因。对靶基因进行GO功能注释和KEGG Pathway功能注释。应用超几何检验进行GO和KEGG pathway差异表达富集分析,以P-value≤0.05为阈值,满足此条件视作靶基因显著富集。
2 结果
2.1 小RNA长度分布
对高通量测序所得的有效数据进行长度分布统计,显示大部分数据分布在18~26 nt,符合Dicer 酶切割的典型特征,见图1。
2.2 差异miRNA表达分析
泡型包虫病患者与健康者血清中差异表达的miRNA共有9个(|log2(Foldchange)|≥1,P-value≤0.05)。其中上调表达的有1个,下调表达的有8个,见表1。
2.3 差异表达miRNA火山图分析
通过绘制火山图以了解差异表达miRNA的整体分布情况,见图2。其中横坐标代表miRNA在不同样本中差异表达倍数变化,纵坐标代表miRNA表达量变化差异的统计学显著性;红色代表上调的显著差异表达基因,蓝色代表下调的显著差异表达基因,灰色代表非显著性差异表达基因。
2.4 GO功能富集分析和KEGG通路富集分析
使用TargetScan、miRanda两款软件对有显著性差异的miRNA分别进行靶基因预测,最后取此两款软件的交集作为差异miRNA的最终靶基因。GO功能富集分析结果表明,这些靶基因主要参与转录调节、信号转导等生化过程,蛋白结合、金属离子结合等分子功能的调节,以及细胞核、细胞质、细胞器等的构成及细胞膜的调节。将这些靶基因对应的GO注释功能按照参与的生化过程、细胞成分和分子功能分为三类,并且将每一类中的GO功能按照注释到的靶基因个数从高到低排序并做图,横坐标是GO功能注释分类,纵坐标是靶基因所占百分比,见图3。

图1小RNA长度分布图
Figure1Length distribution of small RNA
表1泡型包虫病患者与健康者血清差异表达miRNA

Table 1Serum miRNAs differential expression between patients with alveolarechinococcosis and healthy

图2差异表达miRNA火山图
Figure2volcano of deferentially expressed miRNAs
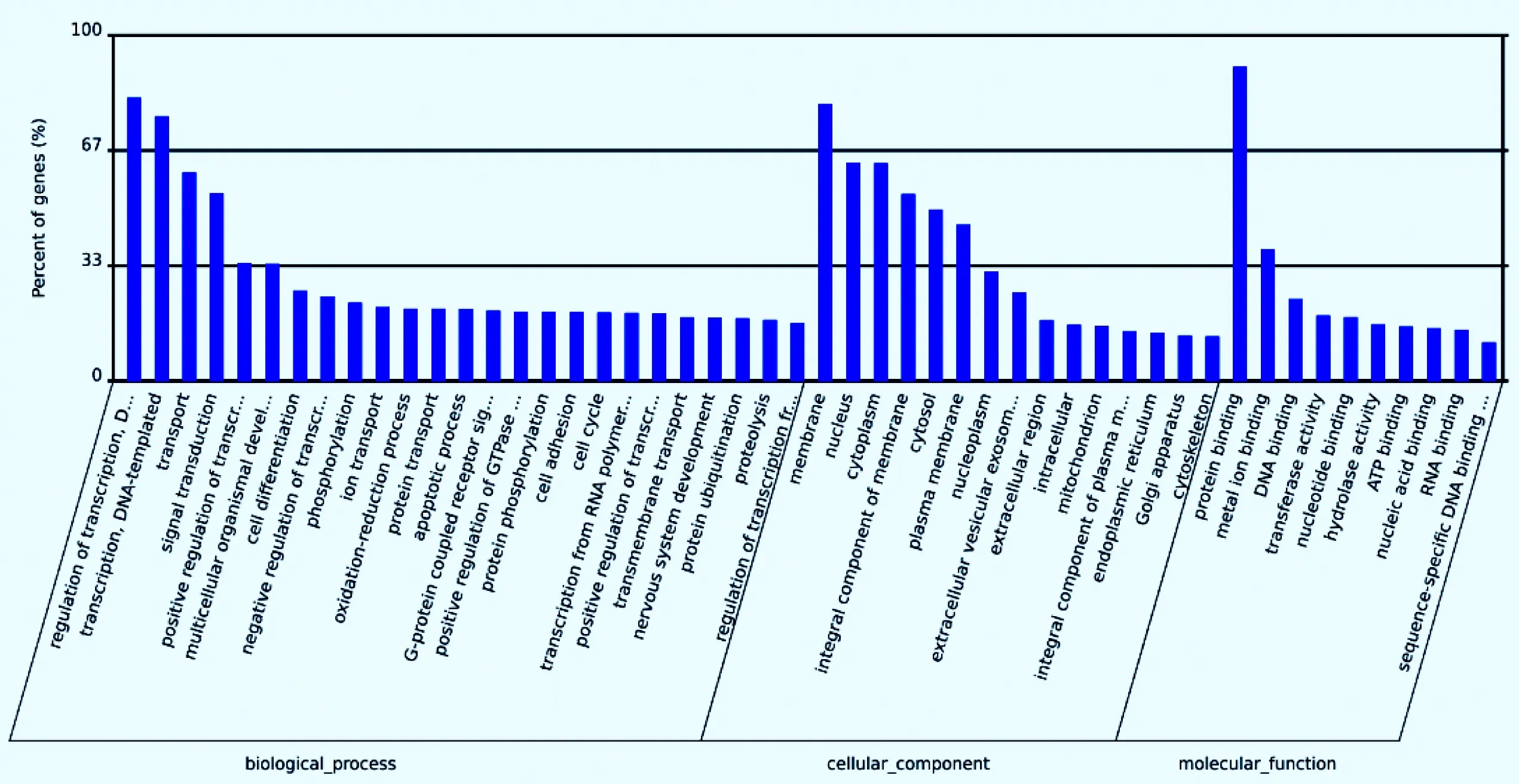
图3 GO富集性柱状图
KEGG通路富集分析结果显示,这些由差异性miRNA调节的靶基因主要参与MAPK信号途径、钙离子信号途径、mTOR信号途径等信号通路。此外,这些靶基因在黏着斑连接、胆碱代谢及细胞吞噬等功能中富集程度较大。将KEGG通路富集分析结果以散点图展示:富集系数(Rich Factor)表示位于该KEGG的差异基因数/位于该KEGG的总基因数,Rich Factor值越大,KEGG富集程度越大,见图4。图5、6分别是靶基因参与的MAPK信号途径与钙离子信号途径的KEGG信号通路分析图。其中红色方框为表达差异miRNA调控的靶基因。

图4KEGG富集性散点图
Figure4KEGG enrichment scatterplot

图5 MAPK信号通路分析图

图6 钙离子信号通路分析图
3 讨论
miRNA是真核生物中一类具有调控功能的内源性非编码RNA,其长度为18~25个核苷酸。miRNA通过抑制或降解与其相对应的靶基因的翻译功能,从而参与疾病发生、发展、转移等的各个阶段[7]。此外,在疾病的每个阶段除有与miRNA相对应的靶基因发生改变外,也有调控这些靶基因的miRNA发生变化[8-9]。有文献也认为,在寄生虫病中,宿主miRNA的表达谱通常会在感染寄生虫后发生改变[10]。目前有关泡型包虫病患者血清特异性miRNA的研究罕有报道,故本研究以泡型包虫病患者血清中miRNA的表达差异情况作为出发点进行初步研究分析。
本次研究使用高通量测序方法检测了泡型包虫病患者与健康者血清中miRNA的表达情况,其中有9个血清miRNA呈差异表达,提示泡型包虫病患者血清和健康者血清miRNA的表达具有差异性。产生这种差异性的原因可能为:一是由于宿主自身组织细胞中的miRNA因为感染寄生虫而发生改变,进而影响血清中miRNA的表达量;二是由于寄生虫在感染宿主后,可以将其自身miRNA释放至宿主血液中,进而导致宿主血清miRNA改变[11]。
本研究通过对有差异性miRNA调控的靶基因进行GO功能富集分析发现,这些靶基因参与的主要功能中,蛋白结合功能与寄生虫病发生密切相关。研究显示,寄生虫代谢产物中的蛋白质可作用于宿主并与寄生虫的侵袭有关[12]。另有研究表明,寄生虫可通过摄取宿主体内的蛋白质来减轻发生在宿主体内的炎症反应,从而建立长期感染[13]。
KEGG通路富集分析结果显示,差异性miRNA调控的靶基因主要参与的通路为MAPK信号途径与钙离子信号途径。MAPK信号途径是在肝脏的纤维化发生机制中发挥着重要作用的途径[14],钙信号途径中发挥重要作用的Ca2+信号蛋白在寄生虫病的免疫调控机制中起关键作用[15],而泡型包虫病的主要发病部位为肝脏,其病理表现为泡球蚴寄生部位的组织常发生坏死、周围因存在淋巴细胞和其他组织细胞的浸润而伴有慢性炎症反应,从而导致周围组织的纤维化和钙化。
综上所述,本研究表明,泡型包虫病患者血清miRNA的表达具有差异性。经本研究筛选出的泡型包虫病患者血清差异表达的miRNA可能能够作为泡型包虫病早期诊断的新的生物标志物。GO功能和KEGG通路富集分析结果提示血清差异性miRNA调控的靶基因与泡型包虫病的免疫应答及病理改变密切相关,但其关联性仍需进一步明确。本研究虽获得了一些与泡型包虫病相关的有意义结果,但研究样本数量小,血清miRNA差异表达谱及靶基因功能仅作为初步分析,仍需进一步扩大样本对相关结果加以验证并进行深入探究。
