不同诱变方法选育高产G-418菌株的比较
2019-05-05钟艾玲田敏刘艳全易欣龙燕雷叶明王富强刘亚洲
钟艾玲 田敏,* 刘艳全 易欣 龙燕 雷叶明 王富强 刘亚洲
(1 抗生素研究与再评价四川省重点试验室,四川抗菌素工业研究所,成都大学,成都 610052;2 微生物药物生物合成技术国家地方联合工程研究中心,成都雅途生物技术有限公司,成都 610041)
G-418又名遗传霉素(geneticin),是由小单孢菌产生的结构类似于庆大霉素和新霉素的氨基糖苷类抗生素[1-2]。它对原核和真核细胞均具有细胞毒性,能抑制细胞的增值,诱发细胞凋亡等[3-4]。目前G-418作为高端生化试剂被大量应用于分子生物学研究领域,同时也可作为抗革兰阴性菌感染新药研究的基础结构物质。
从自然中分离筛选的小单孢菌生物合成G-418能力较低[5-6],远不能满足工业化生产需求。本研究以G-418产生菌棘孢小单孢菌为研究对象,采用多种不同作用机理的诱变方式,比较确定对该G-418产生菌具有最佳效果的诱变方式和剂量,并同时筛选出高产G-418小单孢菌菌株,为实现G-418工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
出发菌株为棘孢小单孢菌(Micromonospora echinoapora),活性鉴定菌株枯草芽孢杆菌(Bacillus subtilis)。
1.1.2 培养基
(1)固体平板培养基 酵母粉1.0g,葡糖糖1.0g,NaCl 8.5g,琼脂20.0g,加热溶解于水后定容至1000mL,调pH7.0~7.2,121℃灭菌30min。
(2)生物活性检定培养基Ⅰ[7]蛋白胨5.0g,牛肉膏3.0g,磷酸氢二钾3.0g,琼脂20.0g,加热溶解后定容至1000mL,调pH7.0~7.2,121℃灭菌30min。
(3)种子培养基 酵母浸粉10.0g,葡萄糖1.0g,可溶性淀粉30.0g,加热溶解于水后定容至1000mL,调pH7.0~7.2,121℃灭菌30min。
(4)发酵培养基 淀粉40.0g,葡萄糖16.0g,蛋白胨8.0g,NH4NO33.0g,酵母粉6.0g,0.5%CoCl2·6H2O溶液250μL,玉米粉6.0g,轻质CaCO33.0g,加热溶解于水后定容至1000mL,调pH7.0~7.2,121℃灭菌30min。
1.2 方法
1.2.1 棘孢小单孢菌孢子菌悬液的制备
取培养5d的棘孢小单孢菌新鲜斜面,用10mL生理盐水洗下,将孢子液转入另一只带有玻璃珠的三角瓶中,34℃,220r/min,震荡30min,过滤,制成孢子浓度107~108CFU/mL的孢子悬液。
1.2.2 UV诱变条件确定
移取5.0mL制备好的孢子悬液于直径9cm培养皿中,培养皿置于已预热30min的紫外箱,并放置在功率为15W的紫外灯(波长265nm)、照射距离为30cm下,照射时间分别为0、10、30、60、90和180s。每次诱变设置3个平行。处理后的孢子悬液稀释后涂布于固体平板培养基,34℃恒温避光培养7~10d,计数菌落。
1.2.3 NTG诱变条件确定
移取NTG溶液与孢子悬液等体积混匀,使NTG终浓度为2.0mg/mL,分别震荡处理10、30和60min。然后加入100%硫代硫酸钠解毒处理10min。未使用诱变剂处理的孢子悬液与处理后的孢子悬液稀释后涂布于固体平板培养基,34℃恒温避光培养7~10d,计数菌落。
1.2.4 微波诱变条件确定
将制备好的孢子悬液分装至5支试管中,插入冰块中,置于2450MHz,750W家用微波炉中,中等功率强度照射时间分别为10、30、60和90s。未使用诱变剂处理的孢子悬液与处理后的孢子悬液稀释后涂布于固体平板培养基,34℃恒温培养7~10d,计数菌落。
1.2.5 超声诱变条件确定
将制备好的孢子悬液分装至4支试管中,置于频率为50Hz超声波仪(KH2200型) 中分别处理10s、 30s、60s和120s。未使用诱变剂处理的孢子悬液与处理后的孢子悬液稀释后涂布于固体平板培养基,34℃恒温避光培养7~10d,计数菌落。
1.2.6 不同生长时间种子孢子悬液紫外诱变条件确定
将斜面菌种接种至种子瓶培养(34℃、220r/min),移取发芽期、生长对数期、衰亡期3个阶段的种子培养液至带有玻璃珠的三角瓶中,220r/min震荡30min,过滤。参照“1.2.2”项条件进行紫外诱变。将各生长期种子未经紫外诱变处理种子悬液及处理后种子悬液稀释后涂布于固体平板培养基,34℃恒温避光培养7~10d,计数菌落。
1.2.7 致死率计算

1.2.8 发酵培养
将挑出的菌株接斜面培养,待孢子成熟后,取适量接入装有25mL/250mL种子培养基的种子瓶中,34℃、220r/min摇瓶培养30h,以10%的接种量,接入30mL/250mL发酵瓶,34℃、220r/min培养7d。
1.2.9 抗菌活性测定
发酵液经2500r/min离心10min,取上清液,管碟法[7]测定抗生素的活性,根据抑菌圈直径大小分析抗生素的效价。
2 结果
2.1 UV诱变条件选择
使用功率为15W的紫外灯管、照射距离为30cm,对孢子菌悬液进行0~180s的时间处理。将照射不同时间的孢子悬液进行稀释后涂布于平板上,34℃培养,计菌落数,由此得出紫外照射不同时间的致死率,为了确保菌体能够最大程度的正向突变,在诱变研究中,工业诱变育种过程中通常将紫外致死率控制在80%左右[8]。本研究中,产G-418小单孢菌孢子悬液经不同时间紫外线照射的致死率和正突变率如图1所示。
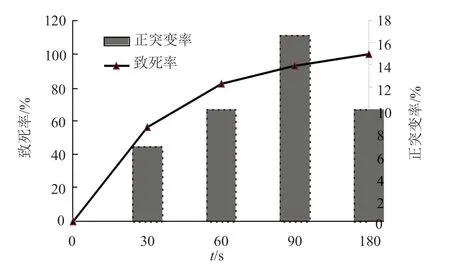
图1 紫外诱变时间对致死率、正突变率的影响Fig.1 Effect of UV irradiation time on spore lethal rate and positive mutation rate
由图1可知,随着照射时间的不断增加,菌株的致死率也不断升高,当UV照射180s时,致死率趋于100%。本研究表明:当照射时间为90s时,菌株的致死率达90%,此时的正突变率最高,为16.7%,因此选择90s作为紫外诱变时间。
2.2 NTG诱变条件选择
采用相同NTG浓度(2.0mg/mL) ,对菌株进行0~60min不同时间处理,其致死率随时间的变化如图2所示。由图2可知,NTG在2.0mg/mL的浓度下,诱变时间为60min时,致死率达到87.5%,当NTG作用时间为30min时,菌株的致死率为61.3%,其正突变率最高为36.7%,所以选择作用时间为30min作为NTG诱变条件。
2.3 微波诱变条件选择
在一定频率下,主要影响微波诱变效果的因素是微波的辐照时间[9]。选用输出功率900W,额定频率2450MHz的微波,对小单孢菌的孢子悬浮液进行辐照处理,辐照时间为10、30、60和90s。辐照处理后,孢子的致死率如图3所示。由图3可知,随着微波照射时间增加,菌株的致死率逐渐增高,在照射时间为90s时,菌株的死亡率接近100%,在照射时间为60s时,致死率为95.8%,菌株的正突变率最高为20%,因此选择60s为最佳辐照时间。

图2 NTG诱变时间对菌株的致死率、正突变率的影响Fig.2 Effects of NTG mutagenic time on spore lethal rate and positive mutation rate
2.4 超声诱变条件选择
在一定的温度下,超声波的作用时间是影响突变效率的主要因素[10],选用频率为50Hz的超声波置于冰水中处理0~2min,孢子的致死率如图4所示。
由图4可知,随着处理时间时间增加,超声诱变致死率逐渐增高,在照射时间为60s时,菌株致死率为90%,其正突变率最高为16.7%,因此选择60s为诱变最佳作用时间。
2.5 诱变菌株筛选
挑取各诱变剂处理后的单菌落至斜面培养,斜面成熟后接入种子瓶培养30h,后转种至发酵瓶,发酵周期为7d。放瓶时取发酵液离心,离心上清液稀释一定的倍数,采用管碟法,以枯草芽孢杆菌为试验菌,以原始菌株为参照,发酵单位高于原始菌株的诱变菌株为正突变菌株,各诱变剂诱变结果如表1。由表1可知,NTG诱变的正突变率高于其他诱变方法,高达36.7%,超声诱变和紫外诱变的正突变率较低,为16.7%,但NTG处理后菌株的发酵单位较原始菌株仅提高36%,紫外诱变处理孢子后正突变幅度最大,发酵单位可提高102%。
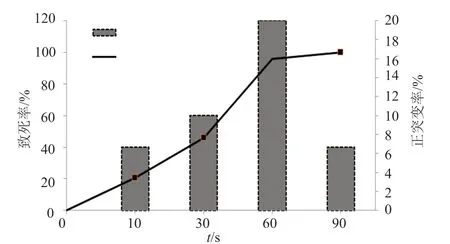
图3 微波辐照时间对菌株致死率、正突变率的影响Fig.3 Effects of microwave irradiation time time on spore lethal rate and positive mutation rate
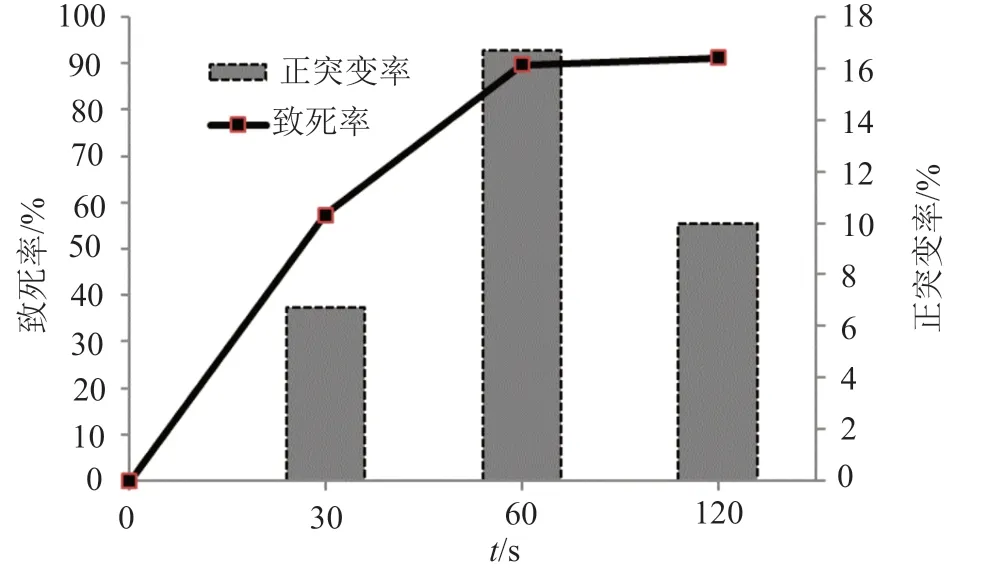
图4 超声诱变时间对菌株致死率、正突变率的影响Fig.4 Effect of ultrasonic mutagenic time on spore lethal rate and positive mutation rate

表1 不同诱变处理方式结果Tab.1 Result of different mutagenic
2.6 紫外线对不同生长时期菌种的诱变结果
2.6.1 种子生长曲线的绘制
将斜面成熟后的菌丝接入种子瓶中,220r/min,34℃培养。定时对种子培养液中的生物量、残糖、pH进行测定并涂片观察菌丝状态,绘制种子生长曲线,结果如图5。根据种子生长曲线及菌丝生长形态,得到菌株的生长特点,0~15h为萌芽期,15~42h为对数生长期,42~44h为稳定期,44~55h为种子衰亡期,可以看出其稳定期较短,考虑具体实验,选择萌芽期、对数生长期以及种子衰亡期进行后续实验。
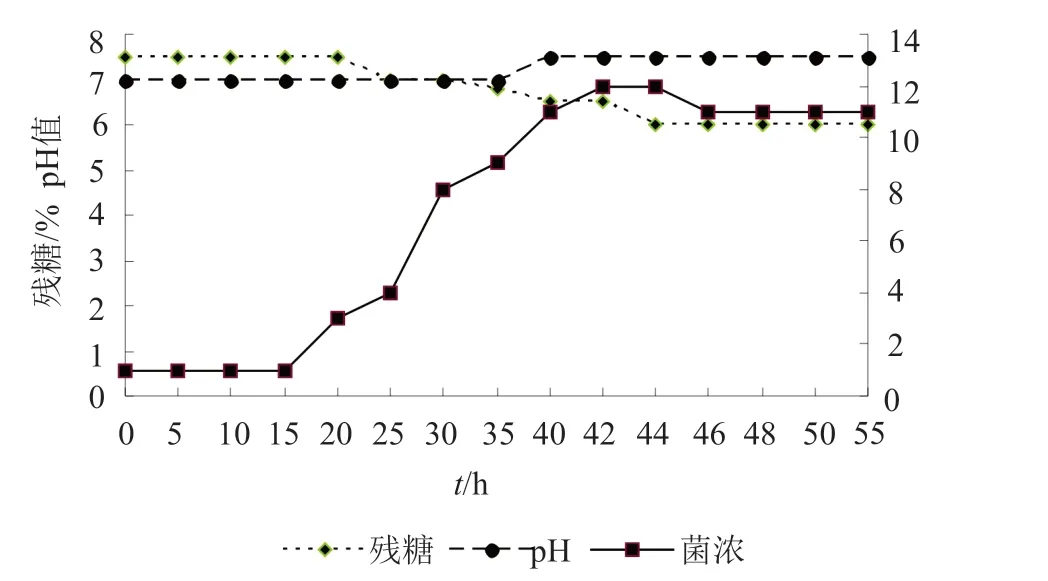
图5 种子生长曲线Fig.5 The growth curve of micromonospora echinoapora seed
2.6.2 不同生长时期紫外诱变
参照“2.6.1”项结果,对种子萌芽期、对数生长期及衰亡期的种子液进行紫外诱变,分别挑取诱变后在固体平板上生长的单菌落至斜面培养,按照“1.2.8”项方法进行发酵培养,活性评价,筛选结果如表2。由表2可知,菌种在不同生长时期对紫外诱变的效应不同,分别将原始菌株产G-418的效价提高了73%~115%。其中,种子液衰亡期的紫外诱变的正突变率高于其他生长时间,高达46.7%,且正突变幅度最大,突变菌株最高单位为1023μg/mL。由此可见,选择种子液衰亡期进行紫外诱变,有望获得G-418的高产突变菌株。
3 结论
采用紫外诱变、NTG诱变、微波诱变和超声诱变和不同生长时期种子液的紫外诱变5种方法分别对产G-418小单孢菌进行处理。比较各种诱变剂,虽然NTG能够得到较高的正突变率,但突变幅度小,NTG处理后菌株发酵单位仅提高36%。紫外线对该G-418产生菌具有较好的诱变效应,在经典的菌种选育研究中,采用紫外线作为诱变剂时,处理对象通常是孢子悬液,而本实验采用对衰亡期种子液进行诱变处理,得到了较高的正突变率与产量,当衰亡期种子液经紫外诱变处理90s后,其正突变率可达46.7%,且突变幅度大。本研究最终筛得优良菌株UV-1和UV-衰亡期-9,G-418效价分别比原始菌株提高102%和115%。
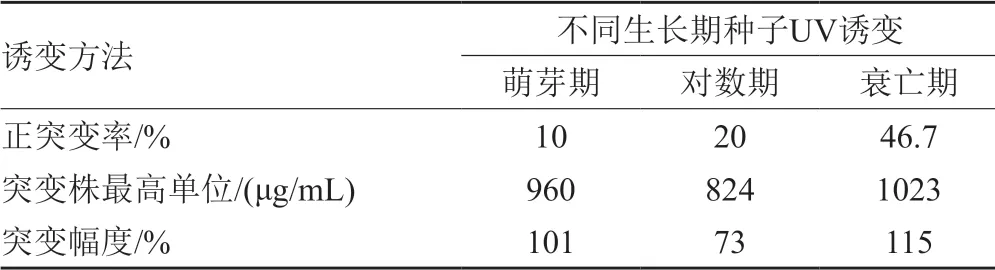
表2 不同生长期种子UV诱变处理正突变率结果Tab.2 Result of UV mutagenic at different growth stages on positive mutation rate