双氢杨梅树皮素与4种抗生素联合对多重耐药金黄色葡萄球菌体外抗菌作用研究
2019-05-05黄郁梅洪正善陈海鹏杨柯曾春晖
黄郁梅 洪正善 陈海鹏 杨柯 曾春晖
(广西中医药大学,南宁 530001)
抗菌药物的滥用导致耐药菌株的产生,在某些条件下易使致病菌毒力增强而破坏宿主的正常菌群,其不合理使用则易引起严重的不良反应、二重感染等问题[1]。金黄色葡萄球菌(Staphylococcus aureus,SA)是引起多种感染的重要致病菌,由于在临床及兽医用药上抗生素的乱用及滥用,导致SA出现耐药,甚至呈现多重耐药现象,使临床治疗及兽医用药治疗难度加大,现已成为治疗的重大难题之一。藤茶[Ampelopsis grossedentata(Hand-Mazz)W.T.Wang]系葡萄科蛇葡萄属植物显齿蛇葡萄的嫩茎叶,为瑶族民间药用的草药之一[2],性凉味甘、淡,具有清热解毒、消肿止痛、祛风湿、强筋骨等功效,主治感冒风热、咽喉肿痛、黄疸型肝炎、急性结膜炎等[3]。其主要化学成分是黄酮类化合物,其中以双氢杨梅树皮素(ampelopsis,APS)含量最高,高达38%[4]。又被称之为双氢杨梅素、白蔹素、蛇葡萄素等。体外抗菌研究结果表明:APS对耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)、标准SA等临床常见致病菌均有极高的抗菌活性,且优于盐酸黄连素,表明APS有较强的抑制或杀灭细菌作用[5]。然而,APS对多重耐药SA的体外抗菌及抗菌机制研究相对较少,为能寻找一种对细菌不易产生耐药且能恢复耐药菌株对抗生素敏感性的抗菌药物,本实验采用多步诱导法和琼脂平皿二倍稀释法,以青霉素为对照,通过测定诱导前后的MIC值,评价标准SA是否容易对APS产生耐药;采用棋盘稀释法测定单用APS、青霉素、庆大霉素、四环素、氯霉素对多重耐药SA的MIC、MBC、及APS分别与这4种抗生素联用对多重耐药SA的FICI,评价APS与这4种抗生素联用效果,考察APS分别与4种抗生素联用对多重耐药SA的抗菌作用。
1 实验材料与仪器
1.1 实验菌株
标准金黄色葡萄球菌(ATCC25923)由广西中医大学食品教研室提供;1株临床分离多重耐药金黄色葡萄球菌由广西中医药大学第一附属医院提供,并鉴定其对青霉素、四环素、庆大霉素、氯霉素均耐药。
1.2 主要药物和试剂
APS:由广西中医药大学中药化学教研室提供,系从广西藤茶[Ampelopsis grossedentata(Hand-Mazz)W.T.Wang]茎叶中分离、纯化,为灰白色粉末,纯度≥98%,结构式如图1。
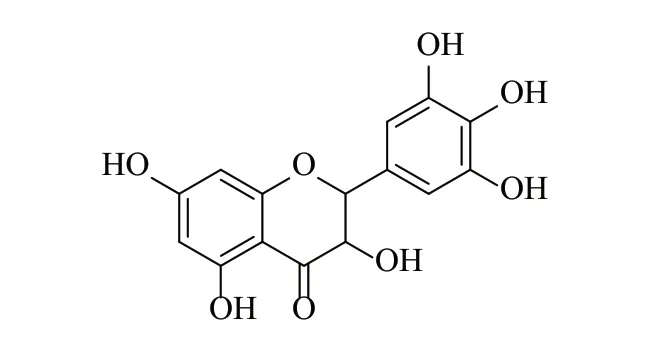
图1 APS化学结构式Fig.1 The chemical structural formula of APS
实验用APS配制:APS加50μL/mL DMSO助溶后,用无菌生理盐水稀释到所需浓度,再用0.22μmol/L针式过滤器过滤备用。
注射用青霉素钠(桂林南药股份有限公司 151107);硫酸庆大霉素注射液(河南润弘制药股份有限公司,批号:1707101);四环素片(广东华南药业集团有限公司,批号:170201);氯霉素注射液(国药集团容生制药有限公司,批号:1708313);氯化三苯四氮唑(TTC)(中国华东师范大学化工厂,批号:20101026);水解酪蛋白胨(MH)肉汤(广东环凯微生物科技有限公司,批号:3105299);二甲基亚砜(DMSO)(天津市富宇精细化工有限公司,批号:20150105);营养琼脂(北京陆桥技术有限责任公司,批号:1001079);MHB培养基(北京陆桥技术有限责任公司,批号:1608231);琼脂(Beijing Solarbio,批号:1295D0330)。
1.3 主要仪器
SW-CJ-1F型洁净工作台(苏净集团苏州安泰空气技术有限公司);HVE-50型高压灭菌锅(广州市深华生物技术有限公司);CD-UPT型纯水仪(成都越纯科技有限公司);SQP型电子天平(赛多利斯科学仪器(北京)有限公司);Mini-15K型高速离心机(杭州奥盛仪器有限公司)。
2 实验方法
2.1 菌液配制
挑取培养好的菌落1~2个接种到3mL MH肉汤中,37℃振摇过夜。
2.2 APS诱导标准SA耐药实验
2.2.1 诱导浓度确定
根据前期实验研究,可知APS对标准SA的MIC为125μg/mL,青霉素对标准SA的MIC为0.0244μg/mL,故选择对标准SA有一定抗菌效果而又不完全抑制细菌生长的1/2MIC浓度作为初始诱导浓度。
2.2.2 药物配置
称取一定量APS,注射用青霉素钠,用无菌生理水配制成一定浓度的溶液,过滤除菌即分别为药液初浓度,根据倍比稀释,将药液用无菌生理盐水稀释成所需浓度。
2.2.3 诱导实验[6]
吸取培养过夜菌液,加入药液,混匀,使其药物终浓度为1/2MIC,37℃振摇培养24h后,1500r/min,离心5min,弃上清液,调菌液浓度至106CFU/mL,再分别吸取100μL稀释菌液接种于不含药MHB琼脂、1/2MIC浓度的含药MHB琼脂及MIC浓度的含药MHB琼脂平皿中,37℃培养24h观察有无细菌生长;并设立空白对照,不加诱导药液,进行相同操作;根据MHB琼脂培养皿中细菌是否有细菌生长情况,调整诱导药物浓度及含药琼脂浓度,若不含药和含药MHB琼脂培养皿均有细菌生长,则挑取含药琼脂培养皿中单菌落接种至 MH肉汤中振摇培养过夜后, 倍比增加诱导药物浓度继续诱导;若不含药MHB琼脂培养皿有细菌生长,而含药MHB琼脂培养皿中无细菌生长,则药物浓度不变继续诱导;若不含药和含药MHB琼脂培养皿均无细菌生长,则实验结束,说明药物不会诱导耐药产生。
2.3 APS分别与4种抗生素联用对多重耐药SA体外抗菌效应实验
2.3.1 APS及4种抗生素单用对多重耐药SA的MIC、MBC测定[7]
药物配制同“2.2.2”项,按棋盘稀释法将药物稀释成9个浓度。药物终浓度见表1。将培养过夜菌液用无菌MH肉汤调菌浓度至106CFU/mL。每孔加入100μL菌液、100μL药液,并设立对照孔,37℃孵育18~24h后。每孔加入10mg/mL(1%)氯化三苯四氮唑(TTC)5μL,37℃孵育4h后观察,有细菌生长孔呈红色,不显红色的最低药物浓度为药物对待测菌的MIC。分别取药物MIC以上未见细菌生长的各孔菌液50μL接种到不含药物的营养琼脂平皿上,置于37℃培养过夜,观察有无细菌生长。平皿培养基中,计数少于5个菌落者作为该药的最低杀菌浓度(MBC)。
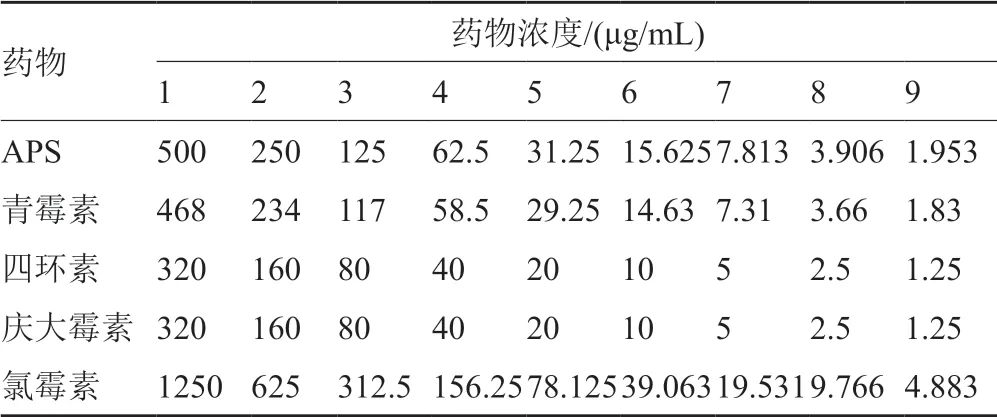
表1 各药物浓度Tab.1 Drug concentration
2.3.2 APS联用抗生素对受试菌的FICI测定
药物配制同“2.2.2”项,按棋盘稀释法将药物配成6个浓度。各药物终浓度见表2。将培养过夜菌液用无菌MH肉汤调浓度至106CFU/mL。每孔加入100μL菌液、100μL药液,并设立对照空,37℃孵育18~24h后。每孔加入10mg/mL(1%)氯化三苯四氮唑(TTC)5μL,37℃孵育4h后观察,有细菌生长孔呈红色。药物体外的相互作用方式以协同抗菌指数(FICI)来判定。FICI为每一种药物联合抑菌时所需最低抑菌浓度(MIC)与单用时MIC的比值,FICI为两种药物部分抑菌浓度之和。FICI的计算与判段标准分别读取两点:一为A药联用的最低MIC;二为B药联用的最低MIC,分别记为MICA及MICB。两药单用时的MIC分别记为A、B。计算公式为:
FICI=MICA/A+MICB/B。当FICI≤0.5为协同作用;FICI=0.5~1.0为相加作用;FICI=1.0~2.0为无关作用;FICI>2.0为拮抗作用。
3 实验结果
3.1 APS诱导标准SA耐药实验
实验结果表明,APS与青霉素分别诱导标准SA 288h后,诱导菌株对32×MIC浓度下的青霉素产生耐药,对APS未产生耐药。青霉素在1/2MIC初浓度下诱导标准SA24h后,菌株出现MIC浓度耐药;诱导浓度增加至MIC浓度继续诱导48h后,出现2×MIC浓度耐药;诱导浓度增加至4×MIC浓度诱导120h后,出现4×MIC浓度耐药;诱导浓度增加至8×MIC浓度继续诱导72h后,出现8×MIC浓度耐药;诱导浓度增加至16×MIC浓度继续诱导24h后,出现32×MIC浓度耐药。而APS在1/2MIC初浓度下诱导标准SA 288h,未见耐药菌株产生(表3和图1)。
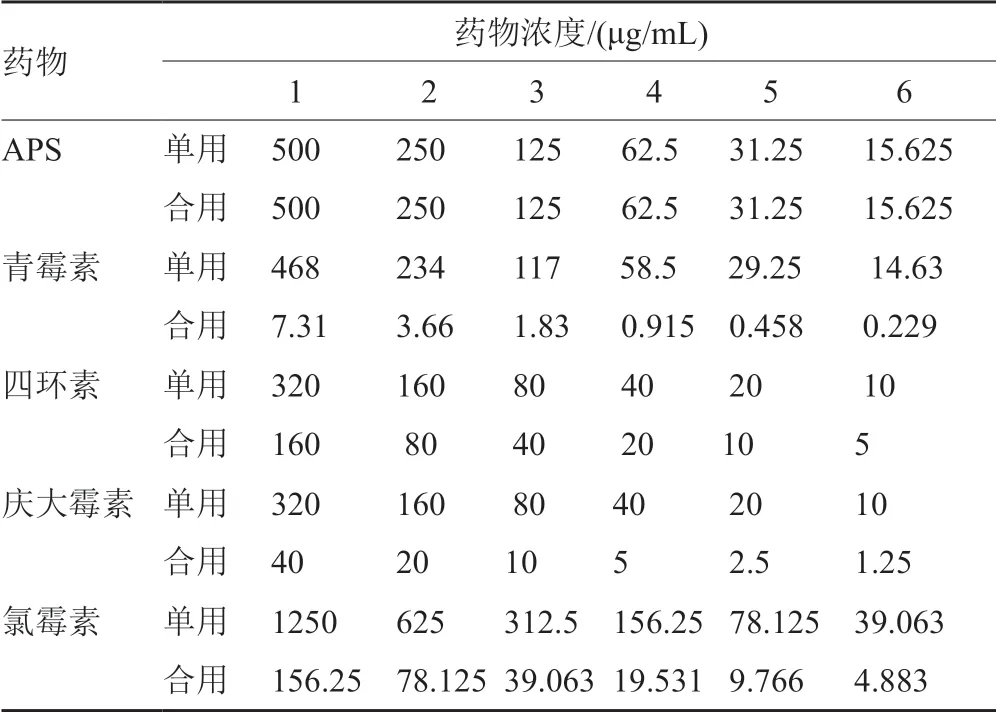
表2 各药物单用及联用终浓度Tab.2 The final concentration of each drug and its combination
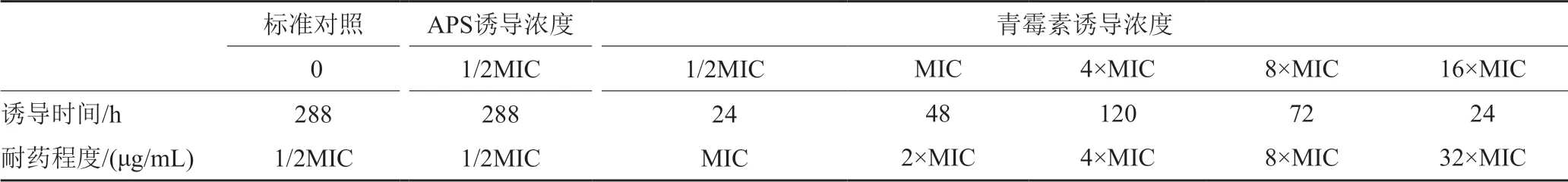
表3 APS及青霉素诱导标准金黄色葡萄球菌耐药/(μg/mL)Tab.3 APS and Penicillin induced resistance to standard Staphylococcus aureus/(μg/mL)
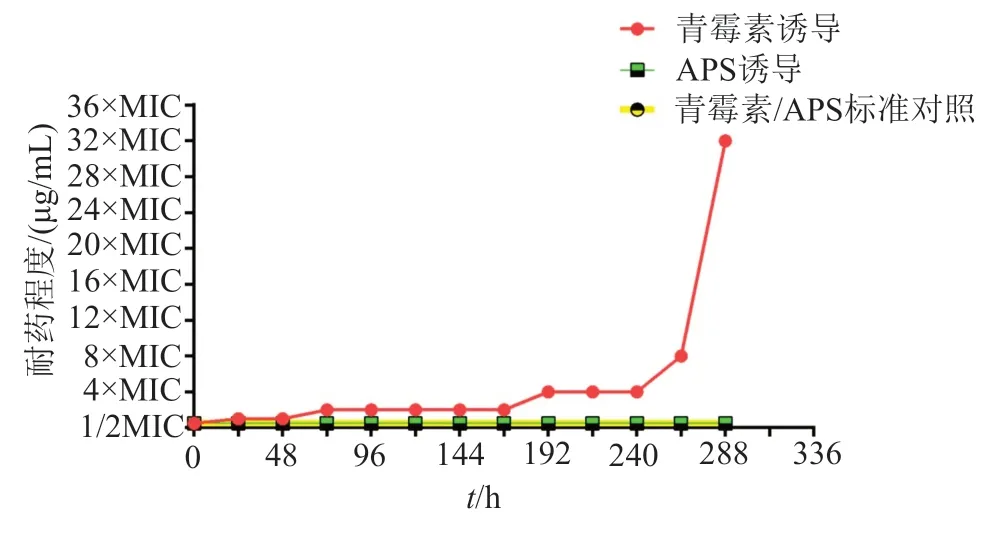
图1 APS及青霉素诱导标准金黄色葡萄球菌耐药Fig.1 APS and penicillin induced resistance to standard Staphylococcus aureus
3.2 APS分别与4种抗生素联用对多重耐药SA抗菌效应实验结果
3.2.1 APS及4种抗生素单用对多重耐药SA的MIC、MBC测定结果
实验结果表明,单用APS、青霉素、四环素、庆大霉素、氯霉素对多重耐药SA的MIC分别为125、29.25、40、40和78.125μg/mL,MBC分别为125、117、320、160和>1250μg/mL。提示APS对多重耐药SA具有杀菌作用,青霉素、四环素、庆大霉素对多重耐药SA高浓度杀菌,低浓度抑菌,氯霉素对多重耐药SA具有抑菌作用(表4)。
3.2.2 APS分别与4种抗生素联用对多重耐药SA的FICI测定结果
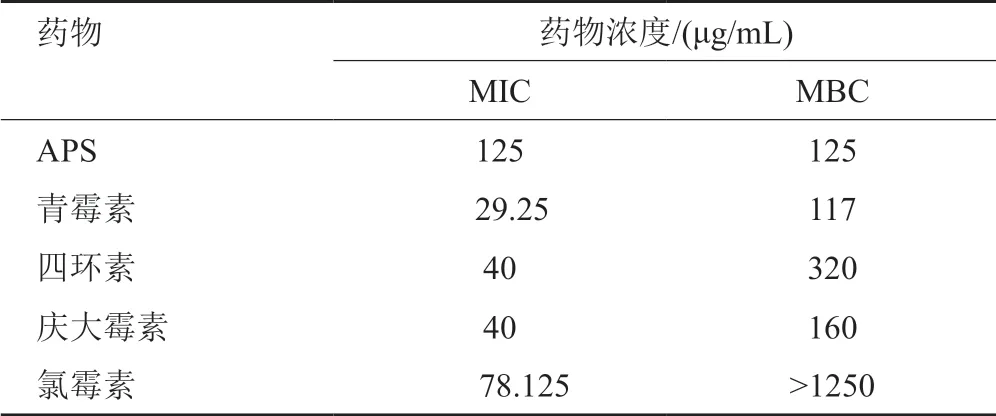
表4 APS及抗生素单用对多重耐药SA的MIC、MBC结果Tab.4 The MIC and MBC results of APS and antibiotics alone against multidrug resistant SA
实验结果表明,APS在单用MIC浓度下,分别与青霉素、四环素、庆大霉素、氯霉素联用对多重耐药SA的作用,随着APS联用浓度不同而表现出不同的抗菌效果。APS与青霉素联用表现出协同或相加作用,以15.625μg/mL APS联用青霉素对多重耐药SA作用效果最佳,表现出协同抗菌作用,青霉素合用剂量降低为单用1/4;APS与四环素联用表现出协同或协同作用,以31.25μg/mL APS联用四环素对多重耐药SA作用效果最佳,表现出协同抗菌作用,四环素合用剂量降低为单用1/8;APS与庆大霉素联用表现出无关或相加作用,以62.5μg/mL APS联用庆大霉素效果最佳,表现出相加抗菌作用,庆大霉素合用剂量降低为单用1/32;APS与氯霉素联用表现出无关或相加作用,以62.5μg/mL APS联用氯霉素效果最佳,表现出相加抗菌作用,氯霉素合用剂量降低为单用1/16。结果提示APS与4种抗生素联用可恢复多重耐药SA对抗生素的敏感性(表5)。
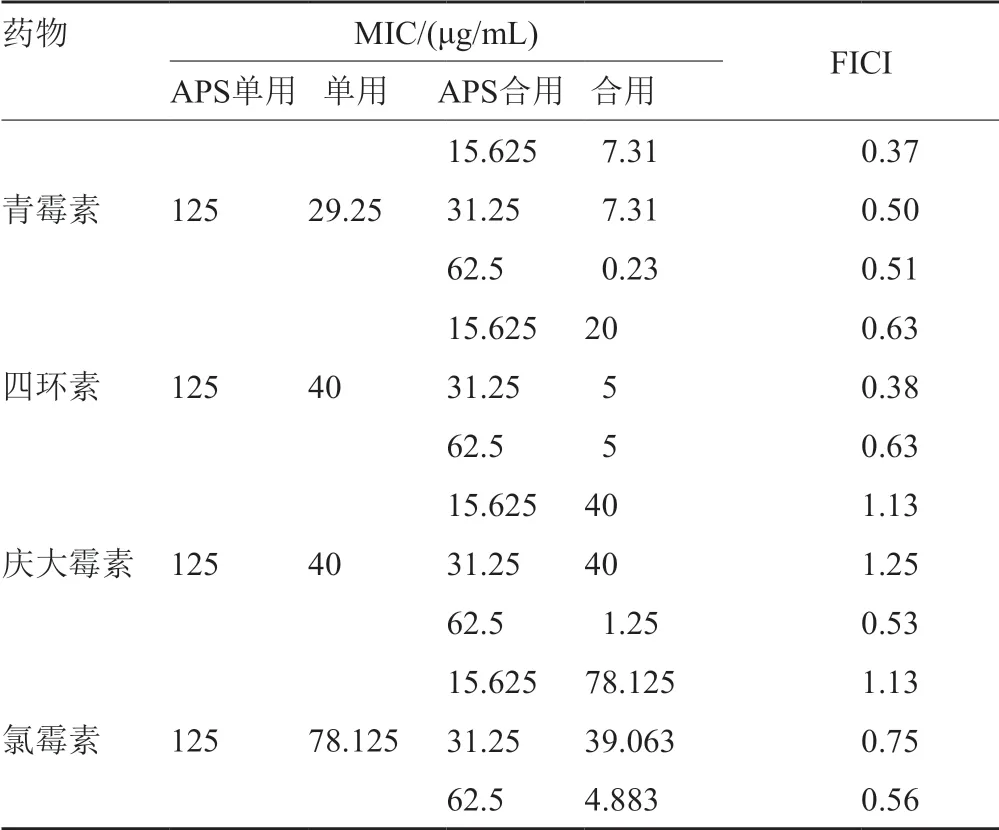
表5 APS联用抗生素对多重耐药SA的FICI结果Tab.5 The FICI results of multidrug resistant SA by APS in combination with antibiotics
3 讨论
金黄色葡萄球菌在临床及畜牧业造成的感染日益加重,是临床常见的重要致病菌。近年,其耐药率呈逐年上升趋势,使得SA感染的治疗难度大大加深。抗生素可用于治疗人和动物因细菌感染而引发的疾病。但是,随着其使用量不断增多,细菌耐药性问题也不断凸显,在临床及畜牧业中被广泛关注[8-9]。抗生素不仅能够预防和治疗细菌、真菌感染所引发的疾病,也能够杀灭相应的肿瘤细胞,应用价值较高[10]。其中以青霉素、四环素、庆大霉素、氯霉素分别为β-内酰胺类、氨基糖苷类、四环素类、氯霉素类抗生素的典型代表,具有其衍生物共性。细菌耐药性的产生使抗生素的使用剂量大大增加,而其不良反应跟抗生素的使用量成正相关, 随剂量增加不良反应加大,从而降低了抗生素的使用效率及疗效,也限制了抗生素的使用范围。而联合用药不但可以减少抗生素的使用量,降低药物的不良反应、提高疗效,还可以治疗细菌引起的混合感染、重症感染,并且能延缓甚至避免细菌耐药性的产生。故研究并开发一种不易诱发细菌产生耐药性又能恢复耐药菌株对抗生素敏感性,或又能对细菌有杀死或抑制作用的抗菌药物迫在眉睫。
许多研究发现[11-14],中药成分毒副作用少,且具有较强的抗菌作用,又不易诱导细菌耐药耐药,在我国资源丰富,与抗生素联用能够减少其使用剂量,提高抗生素疗效的作用。又有研究[15-16]表明:标准SA对青霉素极为敏感,但又易诱导标准SA产生耐药,故本实验以青霉素诱导标准SA作为对照,观察APS诱导标准SA是否易诱导产生耐药,在诱导相同时间内,诱导菌出现32×MIC青霉素耐药,而APS耐药情况与原菌株一致,表明与青霉素诱导耐药相比,APS不易诱导标准SA产生耐药性。并通过研究APS分别联合青霉素、四环素、庆大霉素、氯霉素4种抗生素对多重耐药SA进行体外抗菌实验,发现APS在单用MIC以下浓度与这4种抗生素联用能恢复抗生素对多重耐药SA的敏感性,从而降低抗生素的使用剂量。由此根据这4种抗生素与APS的联用效果推及其衍生物联用作用效果,由此及彼,为提高抗生素的使用效率提供有效依据,为研究出不易诱导细菌耐药且对细菌具有较强抗菌活性或能恢复抗生素敏感性的中药抗菌药物提供实验依据,为提高抗生素在临床及畜牧业的使用效率奠定基础。